中药注射剂的发展前景及其再评价建议
何怡静,李孝栋
(福建中医药大学药学院,福建 福州 350122)
众所周知,2019年12月开始在全球蔓延的新型冠状病毒肺炎疫情,给我国造成重大损失,但中药注射剂在战胜这次疫情的过程中发挥了重要作用,因为疗效确切,《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确收载了8种中药注射剂[1]。建议重型疫毒闭肺证可使用喜炎平注射液;重型气营两燔证可使用痰热清注射液和热毒宁注射液;危重型内闭外脱证使用参附注射液、生脉注射液或参麦注射液固脱,但必须与苏合香丸、安宫牛黄丸或醒脑静注射液开窍合用,且须辨明阴阳,阳脱者使用参附注射液,阴脱者使用生脉注射液,阳闭者使用醒脑静注射液;血瘀证是重型和危重型的共有病机,应选用血必净注射液等改善微循环,保证各组织器官充分灌流,为调动人体抗病潜能,截断扭转病势奠定基础[2]。
在我国,中医药的发展历史源远流长,从最早的《黄帝内经》,到张仲景的《金匮要略》,从《神农本草经》到李时珍的《本草纲目》,至今已有数千年,但这些医籍讲述的均为中药传统剂型,有丸、散、膏、丹等。中药注射剂是在传统中药制剂基础上发展起来的一种现代制剂,特指直接注入人体内的无菌制剂,具有药效迅速、剂量准确、作用可靠、适用于不能口服患者、可局部定位给药和长效作用等优势,它是中药传统给药方式的有益补充,为中医药防治疑难杂症提供了有效的手段。中药注射剂以静脉注射为多,临床要求严格,若研究不够充分,其不良反应可能会涉及多系统、多器官,发生迅速,反应严重[3]。所以,很有必要从安全性、有效性、处方的合理性及工艺制造等方面对中药注射剂进行上市后的再评价。
本文拟对中药注射剂进行较为系统的文献检索,结合相关法规条例,提出再评价建议,以期促进中药注射剂的良性发展。
1 中药注射剂的发展
中药注射剂最早于1941年以柴胡注射液为第一个品种在战火中诞生。1954年,武汉制药厂对柴胡注射剂重新鉴定,并获准批量生产[4],成为国内工业化生产的第一个中药注射剂品种。60年代兴起了研究热潮,但进展不大。进入70年代,中药注射剂逐步被人们认识并接受,80年代后中药注射剂又掀起了研究热潮,取得了可喜的成果[5],主要有参麦注射液、参附注射液、生脉注射液、康莱特注射液等。但90年代时,国家出台《中药注射剂研究的指导原则》后,得到批准的中药注射剂却寥寥无几[6]。不同年份批准或更换的中药注射剂文号数量如表1所示。由于我国于2002年换发批准文号,所以80%以上的批准文号是2002年的。2004年批准的中药注射剂文号远多于2003年,2004年以后批准的中药注射剂数量逐渐下降[7]。绝大部分中药注射剂产品的注册与批准,都是在2007年以前完成的。
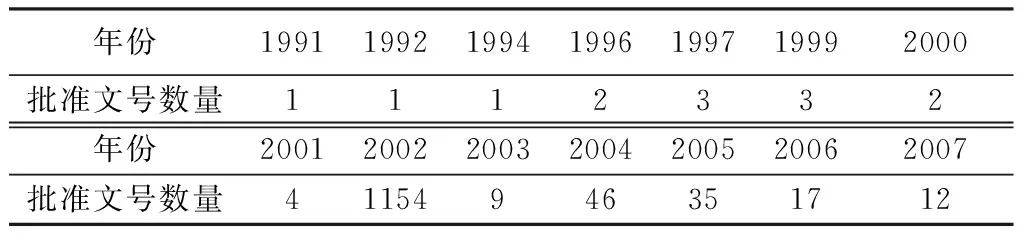
表1 我国历年批准的中药注射剂文号数
目前,中药注射剂在治疗心血管疾病中发挥着重要的作用[8],涉及中药最多的是丹参,其次是红参,包括丹红注射液、丹参注射液、复方丹参注射液、红花注射液等,见表2。

表2 心血管疾病常用中药注射液组成中药及其组分药理作用
2 中药注射剂的药典记载
《中国药典》1963年版第一次收录了4种成分明确的中药注射剂,归于西药部分;《中国药典》1977年版收录中药注射剂24种,是收录品种数最多的一版药典,且首次出现中药复方注射剂。其后至今,经历了数量减少、全部取消又到数量少量增多的一个过程。具体见表3[9]。
3 中药注射剂的不良反应及原因
1980年3月,在昭觉县人民医院有一原发性高血压患者因肌注鹿茸精注射液过敏,抢救无效死亡[10],这也许是关于中药注射剂不良反应最早报告的1例,之后陆续有中药注射剂的不良反应报告[11-19]。《国家不良反应信息通报》通报了2001年11月至2016年10月的8 906例中药不良反应由注射剂引起的最多,共6 625例,占74.4%,其中致死者达6例[20]。不良反应的表现形式以皮肤及其附件损害为主[21],其次为全身性损害和胃肠系统损害。2006年6月,原本临床上用于抗炎、平喘效果较好的鱼腥草注射液因不良反应被紧急暂停、3个月后解禁但给药途径从静脉注射改为肌肉注射的事件,给中药注射剂带来较大的负面影响。
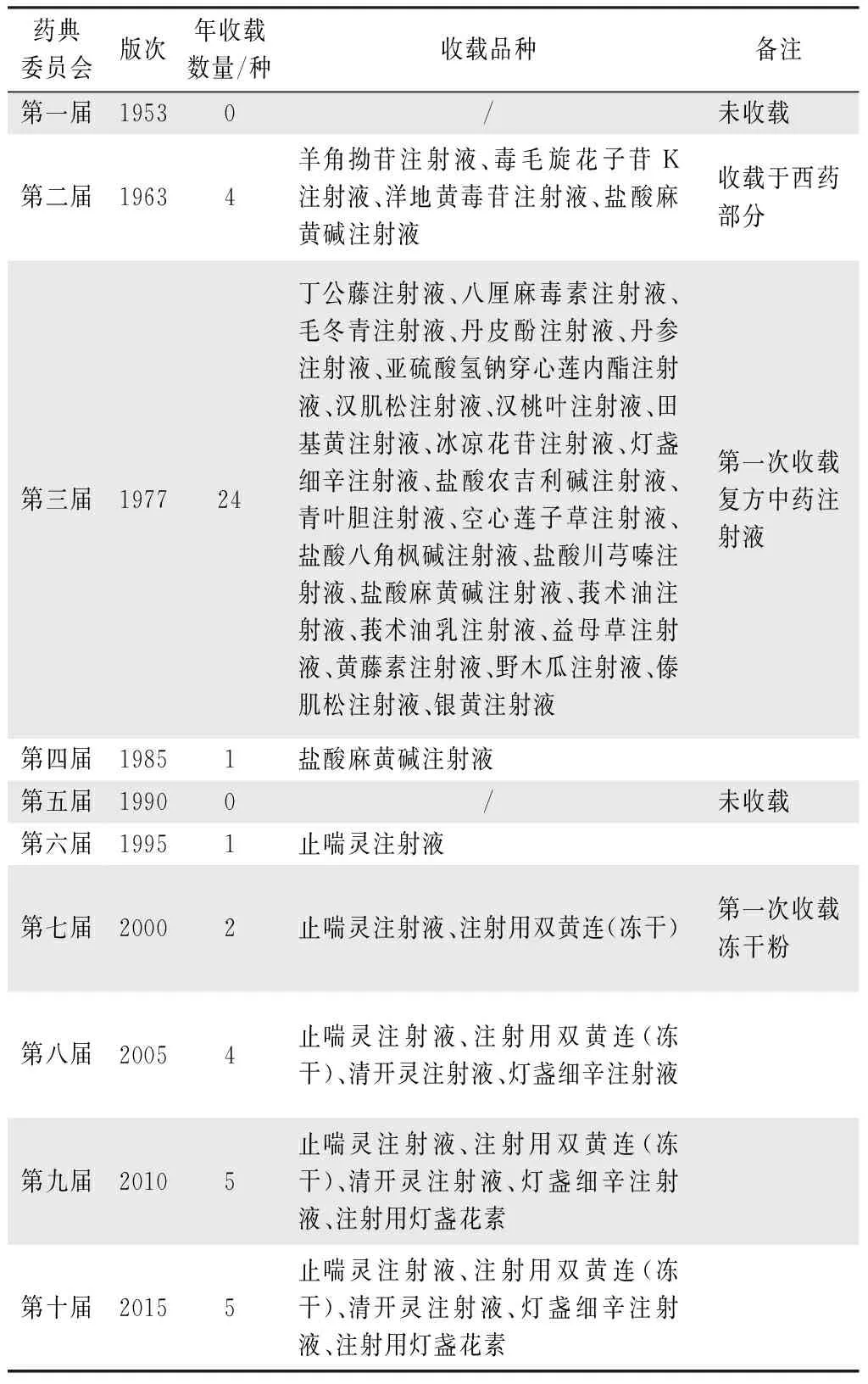
表3 历版《中国药典》中药注射剂品种收载情况
目前,中药注射剂引起不良反应的主要原因表现为:①从中药注射剂本身特点来谈,在有效成分的提取精制过程中,由于制备工艺参差不齐,存在多种杂质不易彻底除去的问题,一旦入血,即易发生过敏反应。附加剂如吐温80,也是引起中药注射剂临床过敏样反应的一个重要因素[22]。西药注射剂也存在不溶性微粒这种问题,只不过比中药注射剂要少[23];②从病患角度来说,部分患者或有家族过敏史;③从医生用药角度来看,存在临床用药不规范现象,如溶媒选择错误、联合用药中出现配伍禁忌(见表4),或超剂量使用、超浓度使用[24]、滴注速度、加药方法不当等;④从质量控制角度来想,中药注射剂大多是20世纪80年代初研制“地标升国标”的品种,当时管理和科技条件受限制,缺乏科学有效的内在质量控制手段,特别是有效成分和杂质成分不清楚,质量检测方法及控制方法专属性差,缺少提取物质量标准、安全性及有毒、有害和致敏成分的质控标准,临床疗效和安全性不能得到充分的保障;⑤中药注射剂一般都来源于经典验方等口服方剂,改成注射剂后,缺乏体内生物利用度和药代动力学等研究,若以口服剂量直接作为注射剂量,则易产生不良反应。

表4 中药注射剂临床配伍不合理应用情况
4 中药注射剂的社会评价
4.1 专家评价 对于中药注射剂出现的不良反应,更多专家对其疗效给予肯定,提出中肯的建议。比如中国工程院院士、天津中医药大学校长张伯礼教授表示[26]:中药注射剂上市后再评价研究不仅仅是阶段性验收,需要贯穿产品整个生命周期。医师黄继斌在丁香园表示[27]:中药注射剂是中国在特殊时期发展出来的一套拥有自主知识产权的医药生产体系,蕴含着几代医学工作者的心血,不能轻易废除。医师王树平回应:中药注射剂存在的问题,不在于中药注射剂本身,而是近年来制造过于泛滥,使用过于无度。孙忠实教授回应:研发的中药注射液错在标准工艺分析等方面缺乏科学手段和研究,不明确构效构毒是要承担风险的。
因为药品上市后,会面对更复杂的临床问题,包括合并疾病、特殊人群、合并用药等等,上述这些专家在正视中药注射剂问题的同时,更是对其临床的合理应用和确切疗效充满期待。
4.2 其他评价 社会上也不乏对中药注射剂的负面评价,如方舟子提及[28]:中药注射剂是一个不中不洋的怪胎。它源自中药,但是不是吃的,而是注射的。中药本身安全性就大成问题,但因为是口服的,有的有害物质没能被身体吸收,排泄掉了。而中药注射剂是直接注射到血液里的,里面有什么有害物质的话,都全部打到血液里了。李盛豪的文章《中药注射剂,所有人都不该用》提及[29]:目前,1 400多种中药注射剂,90%以上都因为历史和临床原因被淘汰了,在剩下的134个品种中,部分中药注射剂的治疗效果和功能很难保障。
5 中药注射剂的研究技术
第一个中药注射剂柴胡注射液的剂型工艺应该是比较粗糙的,到了20世纪50年代至60年代初,中药注射剂多以水煎法和水蒸气蒸馏法制备,研制出板蓝根注射液等。20世纪70年代,水煎醇沉方法开始应用,20世纪80年代中期以来,制备方法不断增多,如超滤、冷冻干燥技术等[30]。20世纪90年代至今,超滤膜分离技术的高效、环保、节能等特点,克服了中药有效成分传统提取分离方法效率低、有效成分被破坏、溶剂残留、操作工序复杂、生产成本高等一系列缺点,在中药注射剂中的应用越来越广泛[31]。其他还有如冷冻干燥技术,具有低温状态去除水分的优点[32]。
为了解决中药注射剂难溶性的问题,常添加增溶剂吐温80的办法来解决,但吐温80作为增溶剂或稳定剂用于中药注射剂时,在一定的限量范围才是安全有效,超量则产生不良反应。指纹图谱,自20世纪末以来,在中药注射剂质量标准提高中,已得到全面、成熟的应用[33]。研究中,液质-联用等先进技术越来越受到重视,它可将色谱法良好的分离能力与波谱法特有的结构鉴别能力相结合,如GC-MS、LC-MS、LC-MS/MS等可提供丰富的多维信息,更适合于中药复杂体系分析的要求,已成为非常有效的药物分离、鉴定和建立表征图谱的手段,将成为中药注射剂研究过程质量保障和安全应用的有力体现[34]。
6 中药注射剂的国家法规和条例
国家对中药注射剂十分重视,先后制定了较多相关的法规和条例。2006年3月15日,《药品说明书和标签管理规定》明确指出:药品说明书应当列出全部活性成分或者组方中的全部中药药味,注射剂还应当列出所用的全部辅料名称[35]。2007年12月6日《中药、天然药物注射剂基本技术要求》的发布,从安全性、有效性、必要性3个方面提高了研发中药注射剂的门槛[36]。2009年,原国家食品药品监督管理局启动中药注射剂再评价。
2017年10月8日,《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》指出:严格药品注射剂审评审批开展药品注射剂再评价。通过再评价的,享受仿制药质量和疗效一致性评价的相关鼓励政策[37]。
7 中药注射剂的再评价建议
7.1 中药注射剂定义的建议 中药药剂学教材中对中药注射剂的定义是:以中医药理论为指导,采用现代化科学技术与方法,从中药或复方中药中提取有效物质制成的注射剂[38]。
正因为中药注射剂是直接注入人体的制剂,尤其是静脉注射,药物进入血液及与血液动态混合的理化状态便要研究清楚。原国家食品药品监督管理总局(CFDA)要求,中药注射剂在成分不能完全明确的情况下,至少要明确其60%成分;在这60%成分中,要知道80%的有效成分;在有效成分中,90%要可控。此为“689原则”[39],作为中药注射剂,建议其定义改为:“以中医药理论为指导,采用现代化科学技术与方法,从中药或复方中药中提取有效物质并经分离纯化使其明确成分不得低于60%而制得的注射剂”,以最大限度保障临床安全。
7.2 中药注射剂剂量确定的建议 临床上应用的绝大部分中药注射剂,其研发均来源于口服方剂,如常用治疗心血管疾病的中药注射液,均源于经典方剂或临床有效小复方或单味药,其中经典方剂有3个,分别为《校注妇人良方·卷九》之参附汤、《症因脉治》之参冬饮和《医学启源》之生脉散,更多的是源自临床或科研处方[8]。
根据生物药剂学与药物动力学有关知识,注射剂的生物利用度远比口服制剂来的高,故中药注射剂的临床用药剂量有必要重新确定。
7.3 药效与不良反应机制阐释的建议 中药注射剂不良反应的发生机制比较复杂,主要可分为A型和B型不良反应。A型是由药品的药理作用增强所致,特点是可以预测,常与剂量有关,停药或减量后症状很快减轻或消失,发生率高,但死亡率低,通常包括副作用、毒性作用、后遗效应、继发反应等。B型是与正常药理作用完全无关的一种异常反应,一般很难预测,常规毒理学筛选不能发现,发生率低,但死亡率高,包括特异质反应、药物过敏反应等[40]。邓筱华等[41-42]分析了A型和B型不良反应的发生机制,前者包括药代动力学方面的因素(药物的吸收、分布、生物转化、排出)、影响体内的离子平衡、靶器官的敏感性增强,后者主要是由于药物因素和机体因素,药物因素包括有效成分的分解产物、添加剂、增溶剂、着色剂、赋形剂等,机体因素主要与患者的特异性遗传素质有关。中药注射剂的药效和毒理研究一般按照传统的药效和毒理试验进行,但较少有开展深层次的体内作用机制研究的,比如以往一直认为中药注射剂的药物超敏反应是过敏性超敏反应,然而,近年来有研究提出[43],中药注射剂的超敏反应可能是以类过敏反应为主而不一定是过敏性超敏反应。
因此,开展中药注射剂的作用机制研究非常重要,它直接与注射剂的安全应用密切相关。
7.4 中药物质标志物的确定
7.4.1 体外研究 刘昌孝院士于2016年提出中药质量标志物(Q-marker)的新概念[44]。中药注射液和口服中药复方一样,化学成分复杂,但确定其有效成分的结构显得十分必要。建议体外研究方面,能够从“宏观”控制中药注射液的指纹图谱整体活性,“微观”通过大孔树脂、柱层析等分离纯化再结合波谱鉴定和分析测试,控制“Q-markers”的含量,构建双标准质量评价体系[45],全面衡量中药注射剂的质量标准。
7.4.2 体内研究 中药药代动力学等体内研究有利于揭示药效试验的作用机制[46]。中医方证代谢组学整合了中药血清药物化学与代谢组学技术,在方证对应并显效的情况下,发现与临床疗效相关、体现方剂配伍、可追溯体内代谢和制备过程的中药药效物质基础的研究策略,是发现中药质量标志物的有效方法[47]。另有文献报道研究中药注射液对CYP2C9酶的调控作用,可以有效预防和避免因药物相互作用引起的药物不良反应,提高中药注射液使用的安全性[48]。
因此,开展中药注射剂再评价时,其体内研究是核心。近年来,有研究[49-52]发现,吸光度-波长曲线下面积与药物多成分总浓度在一定范围内具有良好的线性关系,并可较好地应用于组分中药药动学研究。
7.5 中药注射剂质量标准提高的建议 目前,约有30多个中药注射剂完成了国家规定的质量标准的提高,提高后的质量标准对保证产品的质量、安全、稳定以及评估和防控风险均有一定作用,但从中药注射剂的再评价和前面提及的定义来看,这个提高的质量标准还是不够的。因此,建议国家能够对中药注射剂提出对临床安全更有保障可控的质量标准要求。
7.6 使用说明书规范的建议 药品说明书是经国家药监局批准的具有法律效力的重要文件,是临床正确使用药品的技术性指导[53]。《中药、天然药物处方药说明书撰写指导原则》规定中药制剂说明书应包括药品名称、成分、功能主治、用法用量、禁忌、注意事项等26项基本内容。
说明书中应当对该药品的配伍方义进行简单概括,体现自身用药优点的同时,也使医师和患者对如何用药更加明了。功能主治是说明书中最重要的内容之一,在大量临床证据的基础上,应当逐渐完善说明书主治项内容,一方面使医师用药做到有据可依,另外也可避免不合理的超范围用药情况发生。根据使用说明书,医护人员应当①严格按照说明书进行操作;②严格说明书使用的剂量;③保证说明书提出的治疗疗程的正确;④对特殊群体如儿童、孕妇、老人提出慎用依据;⑤开展配伍研究,以免联合应用导致不良反应[54]。
建议再评价后,每个中药注射剂都能提供一份完整严谨的药品说明书。
8 展望
综上所述,中药注射剂的研发利大于弊,其带来的不良反应,根源不是因为传统中药做成注射剂的思路不可行,而是注射剂这个剂型,若研究不当,不良反应就比其他给药方式较为严重,但不能因此就否定中药注射剂的作用。我们相信,在系统全面的质量控制和国家监管下,通过这次中药注射剂的安全再评价后,中药注射剂的春天会再次到来。

