miR-497-5p靶向VEGFA抑制子宫内膜癌Ishikawa细胞侵袭、迁移和上皮间质转化的实验研究
申 利,刘 佳,林星光
(华中科技大学同济医学院a.附属梨园医院妇产科,武汉 430077; b.附属同济医院妇产科,武汉 430030)
子宫内膜癌是常见的妇科肿瘤,位居世界肿瘤的第6位,近年来其发病率逐年增加,对女性生命健康已构成严重威胁[1-2]。微小RNAs(miRNAs)可通过与靶基因mRNA 3′UTR区不完全互补调控靶基因的表达,进而调控癌细胞的恶性生物学行为,参与子宫内膜癌进程[3-4]。miR-497-5p是miR-15家族成员,被证实在胃癌、卵巢癌和结直肠癌等多种肿瘤组织中低表达,被认为是一种重要的抑癌因子[5-7]。近年有研究[8]发现,在子宫内膜癌组织中miR-497-5p异常低表达,且其表达水平与临床分期、肿瘤浸润深度、淋巴结转移有关,但miR-497-5p在子宫内膜癌细胞转移中的作用未见报道。本研究以子宫内膜癌Ishikawa细胞为研究对象,探讨miR-497-5p对Ishikawa细胞侵袭、迁移和上皮间质转化(epithelial mesenchymal transition,EMT)的影响,旨在初步了解miR-497-5p在子宫内膜癌发展中的作用。
1 材料与方法
1.1 主要试剂与仪器
RPMI-1640培养基、胰蛋白酶和LipofectaminTM2000购于美国Invitrogen公司,胎牛血清购于美国Hyclone公司,基质胶购于美国BD公司,Transwell小室购于美国Corning公司,聚偏氟乙烯(poly vinylidene fluorid,PVDF)膜购于美国Hybond公司,青-链霉素购于美国Sigma公司。RIPA裂解液、结晶紫和多聚甲醇购于中国碧云天,N-cadherin、Vimentin和E-cadherin单抗体购于英国Abcam公司,货号:6781-50、6771-100、AF0131,VEGFA、GAPDH单抗体购于美国Santa Cruz公司,货号:MAB0294、10494-1-AP。辣根酶标记山羊抗鼠/兔IgG多抗购于北京中杉金桥公司,货号:ZB-2301。miR-497-5p mimic、miR-497-5p inhibitor及阴性对照、VEGFA慢病毒表达载体pLV-VEGFA质粒、VEGFA 3′-UTR的野生型(VEGFA-WT)与突变型(VEGFA-MUT)双荧光素酶质粒均是由上海吉玛制药公司设计合成。Trizol Reagent、Real time PCR试剂和总RNA提取试剂盒购于日本TaKaRa公司,反转录试剂盒购于美国Applied Biosystems公司,双荧光素酶检测试剂盒购于美国Promega公司。BCA蛋白浓度测定试剂盒购于美国Pierce公司,ECL发光试剂盒和CO2细胞培养箱购于美国Thermo公司,实时定量PCR仪购于德国Biometra公司,荧光倒置显微镜购于日本Olympus公司。
1.2 细胞培养、分组和转染
将子宫内膜癌Ishikawa细胞(上海中科院细胞库)接种于含有10%胎牛血清、1%青-链霉素的RPMI-1640培养基中,并放入培养箱内培养,培养条件为CO2体积分数5%、湿度饱和和温度37 ℃。将对数生长期的Ishikawa细胞分为:对照组(未转染)、miR-NC组(转染miR-497-5p mimics阴性对照)、miR-497-5p组(转染miR-497-5p mimics)、pLV-VEGFA组(转染pLV-VEGFA质粒)和miR-497-5p+VEGFA组(转染miR-497-5p mimics和pLV-VEGFA质粒),参照LipofectaminTM2000说明书步骤将miR-497-5p mimics阴性对照、miR-497-5p mimics和pLV-VEGFA质粒转染至Ishikawa细胞中。根据实验要求进行后续检测。
1.3 Real-time PCR检测miR-497-5p和VEGFA mRNA的表达
收集对照组、miR-NC组和miR-497-5p组转染48 h后的细胞,参照总RNA提取试剂盒说明书步骤提取各组Ishikawa细胞的总RNA。测定总RNA浓度和纯度,随后进行反转录,将反转录产物作为模板进行PCR扩增。其中,miR-497-5p引物(F:5′-CGCCAGC AGCACACTGTGG-3′;R:5′-GTGCAGGGTCCGAGGT-3′)和VEGFA引物(F:5′-CGAAGTGGTGGTCATGGATG-3′;R:5′-TT-CTGTATCAGTCTTTCCTGGTGAG-3′)是由上海吉凯生物公司合成。2-ΔΔCt计算miR-497-5p和VEGFA mRNA的相对表达量。
1.4 双荧光素酶报告基因实验检测miR-497-5p和VEGFA的靶向关系
参照双荧光素酶检测试剂盒说明书步骤,将VEGFA-WT与VEGFA-MUT双荧光素酶质粒分别与miR-497-5p mimics或miR-497-5p mimics阴性对照共转染至Ishikawa细胞后,置于细胞培养箱中常规培养48 h。弃培养液后,先以磷酸缓冲液洗涤细胞,再加入细胞裂解液。裂解15 min后,离心收集上清液进行检测。以萤火虫荧光素酶活性和海肾荧光素酶活性的比值表示细胞的荧光素酶活性。
1.5 Western blot检测VEGFA、E-cadherin、N-cadherin和Vimentin蛋白的表达
收集miR-NC组、miR-497-5p组、pLV-VEGFA组和miR-497-5p+VEGFA组转染48 h后的细胞,RIPA裂解法液提取总蛋白。定量后,每孔加载60 μg蛋白样品进行SDS-PAGE电泳。电泳完毕后,转PVDF膜。5%去脂奶粉封闭2 h后,加入一抗(VEGFA 1:500,N-cadherin 1:1000,Vimentin 1:1000,E-cadherin 1:1000,GAPDH 1:1000)4 ℃下孵育24 h,次日加入二抗(1:2000)常温下孵育1.5 h。化学发光显影后,Quntity One软件分析各条带灰度值。目的蛋白的相对表达量=目的条带灰度值/内参GAPDH条带灰度值。
1.6 Transwell小室检测Ishikawa细胞的侵袭和迁移
用适量的无血清培养基调整转染48 h细胞浓度至2×104个·mL-1。侵袭实验:在下室中加入含10%胎牛血清的培养基500 μL,Transwell小室(包被基质胶)上室中加入上述细胞悬液200 μL。置于培养箱内常规培养24 h后,小心擦去上室内侧细胞,分别用4%多聚甲醛、0.5%结晶紫对Transwell小室膜底部细胞进行固定和染色。以显微镜下随机选取的5个视野的细胞数均值表示侵袭细胞数量。迁移实验:Transwell小室不需要铺基质胶模拟人工基底膜,其余步骤和侵袭实验一致。
1.7 统计学方法

2 结果
2.1 过表达miR-497-5p对Ishikawa细胞中VEGFA mRNA表达的影响
Real-time PCR检测结果显示,miR-497-5p组细胞中miR-497-5p的表达水平明显高于对照组,而VEGFA mRNA的表达水平明显低于对照组(P<0.05);miR-NC组细胞中miR-497-5p和VEGFA mRNA的表达与对照组比较差异无统计学意义(P>0.05),见表1。

表1 对照组、miR-NC组和miR-497-5p组细胞中miR-497-5p和VEGFA mRNA的表达水平
2.2 VEGFA是miR-497-5p的潜在靶基因
TargetScan生物学信息数据库预测结果显示,VEGFA 3′UTR与miR-497-5p序列存在互补结合位点(表2)。检测荧光素酶活性显示,与VEGFA-WT共转染的miR-497-5p组细胞的荧光素酶活性与miR-NC组比较明显降低(P<0.05),而同VEGFA-MUT共转染的miR-497-5p组细胞的荧光素酶活性与miR-NC组比较,差异无统计学意义(P>0.05),见表3。

表2 VEGFA 3′UTR与miR-497-5p互补结合位点

表3 miR-NC组和miR-497-5p组细胞荧光素酶活性的比较
2.3 miR-497-5p可负向VEGFA蛋白的表达
Western blot检测结果显示,miR-497-5p组细胞VEGFA蛋白的表达水平与miR-NC组比较明显降低,pLV-VEGFA组细胞中VEGFA蛋白表达与miR-NC组比较明显升高(P<0.05);然而,与pLV-VEGFA组比较,miR-497-5p+VEGFA组细胞中VEGFA蛋白表达明显降低(P<0.05),见图1。

A:Western blot检测VEGFA蛋白水平;B:各组细胞中VEGFA蛋白表达水平比较。*P<0.05与miR-NC组比较,#P<0.05与pLV-VEGFA组比较。
2.4 miR-497-5p靶向VEGFA抑制Ishikawa细胞的侵袭和迁移
Transwell小室实验检测结果(图2)显示,miR-497-5p组中的侵袭细胞数和迁移细胞数与miR-NC组比较均明显减少,而pLV-VEGFA组中的侵袭细胞数和迁移细胞数与miR-NC组比较均明显增多(P<0.05);但与pLV-VEGFA组比较,miR-497-5p+VEGFA组中侵袭细胞数和迁移细胞数均明显减少(P<0.05)。
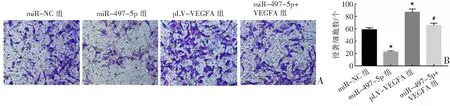
A:Transwell小室实验检测细胞侵袭能力;B:各组侵袭细胞数比较;C:Transwell小室实验检测细胞迁移能力;D:各组迁移细胞数比较。*P<0.05与miR-NC组比较,#P<0.05与pLV-VEGFA组比较。
2.5 miR-497-5p靶向VEGFA抑制Ishikawa细胞的上皮间质转化
Western blot检测结果显示,miR-497-5p组细胞中上皮间质转化的上皮标志物E-cadherin蛋白表达与miR-NC组比较明显升高,间质标志物N-cadherin和Vimentin蛋白的表达水平与miR-NC组比较明显降低(P<0.05);同时,pLV-VEGFA组细胞中E-cadherin蛋白的表达水平明显低于miR-NC组,而N-cadherin和Vimentin蛋白的表达明显高于miR-NC组(P<0.05)。但是,miR-497-5p+VEGFA组细胞中E-cadherin蛋白的表达明显高于pLV-VEGFA组,而N-cadherin和Vimentin蛋白的表达明显低于pLV-VEGFA组(P<0.05),见图3。

A:Western blot检测E-cadherin、N-cadherin和Vimentin蛋白表达水平;B:各组细胞中E-cadherin、N-cadherin和Vimentin蛋白表达的比较。*P<0.05与miR-NC组比较,#P<0.05与pLV-VEGFA组比较。
3 讨论
miR-497-5p是一种由MIR497HG基因编码的miRNA,可通过多种途径或机制调控肿瘤细胞的增殖、侵袭和转移等过程[9-10]。miR-497-5p已被证实在宫颈癌组织中呈低表达,上调其表达可通过靶向IKCa1抑制肿瘤细胞恶性增殖[11-12]。卵巢癌中miR-497表达水平降低与患者总生存率缩短关系密切,外源性miR-497可通过靶向Smad泛素化调节因子1(Smad ubiquitination regulatory factor 1,SMURF1)抑制癌细胞迁移和侵袭[13]。提示,miR-497-5p可能抑制妇科肿瘤的发生和转移,但在子宫内膜癌中的作用鲜有报道。本研究通过转染miR-497-5p mimics成功上调子宫内膜癌Ishikawa细胞中miR-497-5p表达后发现,Ishikawa细胞的侵袭、迁移能力以及间质表型标记蛋白N-cadherin、Vimentin的表达水平均明显降低,而上皮表型标志蛋白E-cadherin表达升高。EMT是赋予肿瘤细胞侵袭和迁移能力的一种过程,也是肿瘤复发和转移的重要原因[14]。E-cadherin、N-cadherin和Vimentin三者是EMT发生的重要标志,在肿瘤细胞的侵袭、浸润和转移过程中发挥着重要作用[15-17]。本实验结果提示,miR-497-5p在子宫内膜癌Ishikawa细胞的侵袭、迁移和上皮间质转化过程中发挥着重要的抑制作用。这与以往关于miR-497-5p抑制妇科肿瘤进展的研究相符。
为探究miR-497-5p在子宫内膜癌中的作用机制,本研究采用TargetScan生物学信息学软件和双荧光素酶报告基因实验证实,VEGFA是miR-497-5p的直接靶基因。VEGFA在子宫内膜癌组织中异常高表达,与肿瘤分期、病理分级有关,而靶向抑制其表达能够明显抑制癌细胞的增殖、侵袭和迁移[18-19]。有研究[20]发现,miR-497可通过靶向VEGFA抑制大肠癌细胞的侵袭和转移。本研究通过转染VEGFA慢病毒表达载体成功上调VEGFA表达后发现,miR-497-5p对Ishikawa细胞侵袭、迁移和上皮间质转化的抑制作用明显减弱。提示,miR-497-5p可通过靶向VEGFA抑制Ishikawa的侵袭、迁移和上皮间质转化。
综上所述,miR-497-5p在子宫内膜癌Ishikawa细胞侵袭、迁移和上皮间质转化过程中发挥着重要的抑制作用,这可能是通过靶向下调VEGFA表达来实现的。

