鲢鱼酶解产物的特性及其对乳酸菌的抗冻保护作用
崔美丽 刘永乐 俞健 李向红 罗阳阳 李彦 王发祥
摘要: 為筛选新型乳酸菌抗冻保护剂,通过复合蛋白质酶水解15 min、30 min、60 min、120 min、240 min制备了不同水解度的鲢鱼酶解产物,研究其相对分子质量分布、氨基酸组成、表面疏水性、活性巯基含量等特性及其不同酶解时间鲢鱼酶解产物和不同质量分数鲢鱼酶解产物对乳酸菌冻融存活率的影响。结果表明,不同酶解时间酶解产物相对分子质量主要在9.00×101~5.40×105,其氨基酸组成和含量基本相同,亲水性氨基酸比例占总量的68%;随着酶解时间增加,酶解产物的表面疏水性和活性巯基含量均呈先降后升趋势,其中酶解120 min的鲢鱼酶解产物表面疏水性最低,酶解30 min鲢鱼酶解产物的活性巯基含量最低;在不添加抗冻保护剂情况下,乳酸菌耐冻性能较差,4次冻融循环后存活率为22.82%;添加不同酶解时间鲢鱼酶解产物均对乳酸菌有一定的抗冻保护效果,其中酶解120 min的酶解产物对乳酸菌的抗冻保护效果最好,添加质量分数为4%时可使乳酸菌4次冻融循环后的存活率提高至85.20%。说明鲢鱼酶解产物是一种潜在的乳酸菌抗冻保护剂。
关键词: 鲢鱼酶解产物;乳酸菌;抗冻保护
中图分类号: TS201.3 文献标识码: A 文章编号: 1000-4440(2021)01-0197-07
Characteristics and cryoprotective effect of silver carp muscle hydrolysates on Lactobacillus plantarum
CUI Mei-li, LIU Yong-le, YU Jian, LI Xiang-hong, LUO Yang-yang, LI Yan, WANG Fa-xiang
(School of Chemistry and Food Engineering, Changsha University of Science and Technology, Hunan Provincial Engineering Research Center for Food Processing of Aquatic Biotic Resources, Changsha 410114,China)
Abstract: To screen new type cryoprotectant for Lactobacillus plantarum, the silver carp muscle hydrolysates (SCMHs) with different degrees of hyolysis were prepared by protamex that hydrolyzed for 15 min, 30 min, 60 min, 120 min and 240 min. The properties of SCMHs such as relative molecular mass, amino acid composition, surface hydrophobicity and active sulfhydryl content were studied, and the influence of SCMHs with different enzymolysis time and different mass percentages on the survival rate of L. plantarum after freeze-thaw were also studied. The results showed that the relative molecular mass of SCMHs with different enzymolysis time mainly ranged from 9.0×101 to 5.40×105. The composition and content of amino acids from different SCMHs were similar, and about 68% of the total amino acids were hydrophilic. With the increase of enzymolysis time, the surface hydrophobicity and active sulfhydryl content of SCMHs all presented the trend of decrease first and then increase. The surface hydrophobicity of SCMHs declined to its minimum after enzymolysis for 120 min, and the active sulfhydryl content of SCMHs reached its minimum after enzymolysis for 30 min. The freezing tolerant properties of L. plantarum was poor without the addition of cryoprotectant, and the survival rate of L. plantarum was 22.82% after four cycles of freeze-thaw. Addition of SCMHs with different enzymolysis time showed cryoprotective effect on L. plantarum, and SCMHs after enzymolysis for 120 min exhibited the best effect. The addition of SCMHs with a mass percentage of 4% could increase the survival rate of L. plantarum to 85.20% after four cycles of freeze-thaw. It is suggested that the SCMHs is a potential cryoprotectant for L. plantarum.
Key words: silver carp muscle hydrolysates;Lactobacillus plantarum;cryoprotective
鲢鱼 (Hypophthalmichthys molitrix) 是中国四大家鱼之一,由于具有价格低廉、生长速度快、养殖量大等优点,2018年养殖产量达3.858 9×106 t,在鱼类产量排名中仅次于草鱼[1]。但是鲢鱼肉薄肌间刺多、口感差、土霉味与鱼腥味重,严重影响了其食用品质。目前除加工成冷冻鱼糜外,仍然缺乏有竞争力的利用途径;同时,鲢鱼肉的营养价值高,有适宜比例的必需氨基酸,是优质的水产资源[2],应合理地充分利用,避免浪费。因此,研究开发新的鲢鱼高值化利用途径具有十分迫切的意义。鲢鱼的酶解产物是一种新型的抗冻改良剂,能有效抑制鱼糜中蛋白质的冷冻变性[3-4],防止冷冻面团品质的冻融损伤[5],同时对酵母菌等微生物[6-7]也具有良好的抗冻保护活性,值得进一步深入研究。
乳酸菌(Lactic acid bacteria,LAB)是一类能够利用可发酵的碳水化合物来产生大量乳酸的无芽孢细菌统称,因其良好的发酵性能和优越的益生作用,引起了与人类生活领域密切相关研究者的注意。目前,乳酸菌在与发酵相关的调味品[8]、果蔬制品[9]、植物蛋白质饮品[10]等食品行业被广泛应用,但许多发酵食品通常需要贮藏在低温的环境中,常采用冷冻干燥技术来生产乳酸菌直投式发酵剂,在低温贮藏或冷冻干燥过程中,往往存在冷冻损伤和蛋白质的冷应激变化等现象,导致乳酸菌存活率降低及部分功能的丧失[11-13]。当前,为了提高乳酸菌的存活率通常采用添加抗冻剂这一方法,已有多种抗冻剂被添加使用,如甘油、氨基酸类物质、抗冻蛋白质等[14-16]。鲢鱼酶解产物已被证实具有良好的抗冻保护效果[3-7],但其是否对乳酸菌具有抗冻保护作用,还需要进一步研究证实。本研究在课题组前期试验基础上,通过使用复合蛋白质酶酶解鲢鱼肉,制备系列酶解产物,研究其对乳酸菌冻融循环处理后存活率的影响及其与酶解产物性质的相关性,旨在为利用鲢鱼酶解产物提高乳酸菌在冷冻或冻藏过程中的存活率提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鲢鱼购于湖南省长沙县高云小区菜市场;乳酸菌为植物乳杆菌(Lactobacillus plantarum,CICC20272),本实验室传代保藏。
MRS肉汤培养基和改良MRS培养基购自广东环凯微生物科技有限公司;复合蛋白质酶(Protamex,酶活性≥1.5 AU/g),购自诺维信(中国)生物技术有限公司;巯基含量测定试剂盒,购自南京建成生物工程研究所;氨基酸分析用生理体液(PF-1~PF-4、PF-RG)和茚三酮缓冲液,购自日本和光纯药工业公司;其他试剂均为国产分析纯。
1.2 仪器与设备
L-8900全自动氨基酸分析仪,日本日立有限公司生产;LC-20A高效液相色谱仪,日本岛津公司生产;BIOTECH-5L生物酶反应器,上海保兴生物设备工程有限公司生产。
1.3 方法
1.3.1 鲢鱼酶解产物的制备 参考熊思佳等[6]的方法稍作修改。新鲜鲢鱼宰杀取肉,用组织捣碎机搅碎,按固液比1∶5与水混匀后加入酶反应器,按鱼肉干质量(鱼肉水分含量按80%计)的3%添加复合蛋白质酶,在50 ℃、pH 6.50±0.05的条件下分别对其水解15 min、30 min、60 min、120 min、240 min,90 ℃条件下灭酶15 min,于4 000 g离心后,收集上清液进行冷干,得到系列不同水解度的鲢鱼酶解产物。
1.3.2 体积排阻色谱法测定酶解产物相对分子质量分布 参考赵城彬等[17]的方法并做修改。采用配备TSKgel 4000SWXL蛋白质凝胶柱的高效液相色谱仪测定鲢鱼酶解产物的相对分子质量分布,使用牛血清白蛋白、核糖核酸酶A、过氧化物酶、甘氨酸四聚体和对氨基苯甲酸在柱中的平均保留时间得到相对分子质量校准曲线。
准确称取0.050 0 g 水解15 min、30 min、60 min、120 min、240 min酶解产物,使用超纯水分别溶解并定容至100 ml后,于微孔滤膜(0.45 μm)过滤。利用高效液相色谱仪进行测定,条件为:流速1 ml/min;检测波长220 nm;进样量20 μl;柱温30 ℃;流动相为pH6.5的超纯水。
1.3.3 氨基酸组成分析 参考食品安全国家标准[18],分别准确称取25 mg酶解15 min、30 min、60 min、120 min、240 min的酶解产物于水解管中,加入10 ml 6 mol/L的盐酸,于110 ℃条件下消化22 h,待其冷却后,以超纯水定容至50 ml,吸取1 ml减压干燥,用1 ml的超纯水溶解残留物,蒸干后用1 ml的柠檬酸钠缓冲液(pH为2.2)进行溶解,0.22 μm微孔濾膜过滤后用氨基酸自动分析仪进行测定。
1.3.4 酶解产物表面疏水性分析 酶解产物冻干粉以超纯水配制成质量浓度为5.0 mg/ml的溶液,参考陈赛等[19]的方法采用反相高效液相色谱法分析酶解产物表面疏水性,疏水性系数是11~30 min的峰面积与总峰面积比值,值越大代表样品的表面疏水性越强。
1.3.5 活性巯基含量测定 准确称取350 mg酶解产物冻干粉,定容至50 ml,参考巯基测定试剂盒说明书测定其活性巯基含量。
1.3.6 乳酸菌培养液的制备 从斜面挑取1环乳酸菌,接种至50 ml MRS肉汤中(100 ml三角瓶),于37 ℃条件下静置24 h,得到一级种子液。按照接种量为2%将其接种至100 ml MRS肉汤中,于37 ℃条件下静置18 h,即得乳酸菌培养液(菌体含量大于1×108CFU/ml),备用。
1.3.7 乳酸菌冷冻存活率的测定 吸取1.0 ml的乳酸菌培养液加入原先预装有9.0 ml无菌水或者相应溶液的离心管中,振荡混匀后制成菌悬液,随机取一离心管稀释度为1×10-1的乳酸菌悬液,以稀释平板法(MRS培养基固体平板)测定其菌落总数,计为初始活菌数(N0,N0=2.28×107~4.35×107CFU/ml);余下各离心管置于-20 ℃冰箱进行冻融循环处理(-20 ℃冷冻18 h,4 ℃解冻6 h为1个冻融循环),每间隔2个冻融循环取出一离心管以稀释平板计数法测定其菌落总数,计为此时的活菌数(Ni),反复冻融1~6个循环,分别计算乳酸菌的存活率(第i个冻融循环的存活率=Ni/N0×100%)。
1.3.8 不同酶解产物对乳酸菌的抗冻保护能力 参考熊思佳等[6]的方法分别称取0.2 g系列酶解产物,加入9 ml的无菌水和1 ml的乳酸菌培养液,制得含终含量为2%(质量体积分数)的酶解产物乳酸菌悬液;置于-20 ℃冰箱,对其进行4次冻融循环,取出测定其活菌数,计算乳酸菌的存活率;空白对照为无菌水并计算初始的活菌数,阳性对照为8%的甘油,阴性对照为2%(质量体积分数)的牛血清白蛋白(BSA)。
1.3.9 不同质量分数酶解产物对乳酸菌冻融存活率的影响 称取酶解120 min的酶解产物,按方法1.3.8的方法制备质量分数为2%、4%、 6%、 8%酶解产物的乳酸菌悬液,于-20 ℃冰箱中进行4次冻融循环后,测定其乳酸菌的存活率。
1.3.10 数据处理 每组试验进行3个平行,试验结果以x-±s表示,以Microsoft Excel软件计算并绘图;采用SPSS 21.0软件,对数据进行单因素方差分析,用Duncans检验法进行多重比较和差异显著性分析( P<0.05)。
2 结果与分析
2.1 鲢鱼酶解产物的氨基酸组成
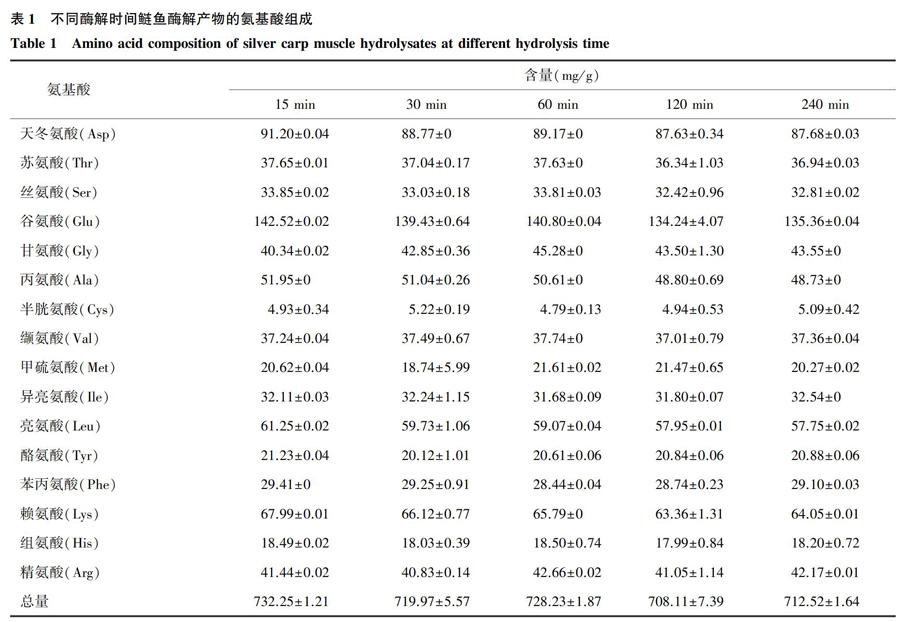
课题组以前的研究结果表明,随着酶解时间的增加,鲢鱼酶解产物(Silver carp muscle hydrolysate,SCMH)的水解度逐渐增加,15 min、30 min、60 min、120 min、240 min酶解产物的水解度分别为9.68%、13.57%、18.42%、23.27%、29.10%,不同酶解产物的基本组成差别不大,其中蛋白质(包括蛋白质、肽和氨基酸)约占总质量的85%[6]。本研究进一步分析了其氨基酸组成,结果如表1所示。
由表1可见,不同酶解时间鲢鱼酶解产物的氨基酸组成和含量均比较接近。其中,必需氨基酸含量接近氨基酸总量的40%,表明其营养价值比较丰富;亲水性氨基酸含量超过氨基酸总量的68%,说明酶解产物具有较好的溶解性[20],也与抗冻蛋白质具有较高亲水性氨基酸含量的特征相似[21];另外,谷氨酸含量在所有氨基酸中最高,再依次为天冬氨酸、赖氨酸和精氨酸,有研究结果[22-23]表明这4种氨基酸具有优先与自由水相互结合的能力,通过热滞活性抑制冰晶的形成,从而具有较好的抗冻保护活性。
2.2 鲢鱼酶解产物的相对分子质量分布
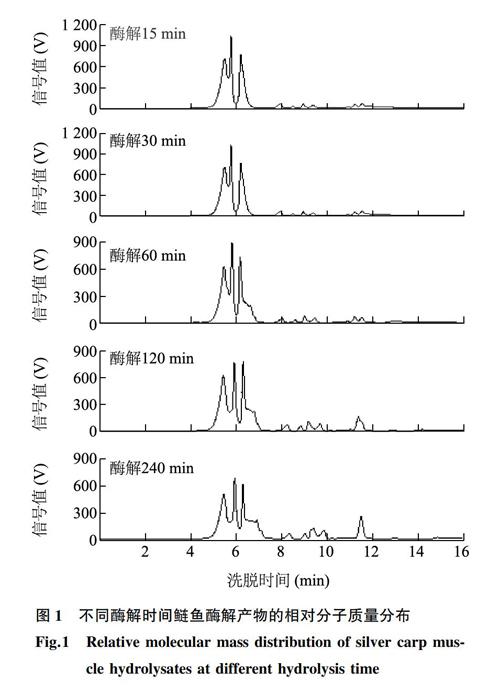
体积排阻色谱法 (Size exclusion chromatography,SEC)是按照分子大小的順序对其进行分离的色谱方法,已被广泛应用于大分子物质的相对分子质量分布分析。图1为不同酶解时间鲢鱼酶解产物的SEC色谱图,可见随着酶解时间的增加,酶解产物的组分及其含量发生了明显变化。以相同条件下分离5种标准蛋白质获得的标准曲线为参考,酶解产物组分的相对分子质量主要分布在9.00×101~5.40×105,表明其含有许多不同相对分子质量的肽和相对分子质量小的游离氨基酸。但随着水解时间的增加,洗脱时间7 min以前的峰(相对分子质量>9.1×104)强度明显减小,8 min以后的峰(相对分子质量<3.0×104)强度逐渐增强,且部分洗脱峰出峰时间稍有后移,其中酶解120 min和240 min酶解产物尤为明显,表明大分子的蛋白质或肽被逐步降解,小分子的肽片段或游离氨基酸含量增加。孙丽洁等[24]认为小分子肽更容易通过羟基及疏水相互作用与冰晶表面结合,阻碍冰晶生长,从而增强抗冻保护活性。另外,Chen 等[25]的研究结果证明相对分子质量为600~2 700的肽有利于吸附到冰的表面或抑制冰重结晶,从而具有较高的乳酸菌抗冻保护作用。本研究中,相对分子质量600~2 700肽洗脱峰对应洗脱时间为10.0~11.5 min。由图1可见,从酶解时间120 min开始,该部分洗脱峰出现明显变化,在酶解120 min酶解产物的色谱图中,保留时间11.4 min左右的峰面积相对于酶解15~90 min酶解产物增加了约1倍,占总峰面积的6.14%。然而,在酶解240 min酶解产物的色谱图中,对应峰的面积继续增加,占总峰面积的7.03%,但其洗脱时间右移至11.53 min,相对分子质量已小于600。
2.3 鲢鱼酶解产物的表面疏水性
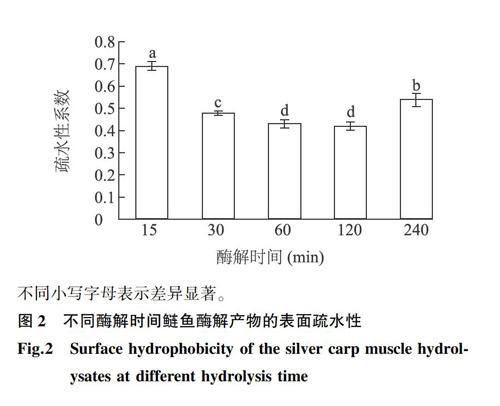
表面疏水性是蛋白质表面残基的疏水基团引起的一种表面性质,决定了其溶解度、稳定性和自缔合能力等。根据反相高效液相色谱的出峰时间和特征,以保留时间11 min为分界点,根据11 min后峰面积与总峰面积的比值计算样品的疏水性系数,结果如图2所示。由图2可见,随着酶解时间增加,酶解产物的疏水性系数呈先下降后上升的趋势,酶解时间为120 min时达到最低值(0.42),至酶解时间为240 min时又显著回升(P<0.05)。酶解产物表面疏水性的变化可能与其水解过程中生产的肽、游离氨基酸的比例和性质有关,颜阿娜等[26]认为抗冻多肽的表面疏水性一般都比较弱,但鲢鱼酶解产物的组成比较复杂,其表面疏水性与抗冻性能的相关性还有待明确。
2.4 鲢鱼酶解产物的活性巯基含量
鲢鱼酶解产物中活性巯基含量随酶解时间的变化如图3所示。可见,随着酶解时间延长,酶解产物中活性巯基含量呈先降后升趋势。酶解前期,可能部分巯基被氧化形成二硫键,导致活性巯基含量有所下降,酶解30 min时酶解产物的活性巯基含量最低(72.50 μmol/g);随着酶解时间的延长,水解度逐渐增大,大量内部的巯基暴露或游离出来,因而活性巯基含量显著增加(P<0.05),酶解240 min时酶解产物的活性巯基含量增加至105.01 μmol/g。目前还没有报道证实抗冻蛋白质(或肽)的活性巯基含量与其抗冻性能的联系,但体系中适量的巯基存在可以起到稳定水分子的作用,从而抑制水分迁移和冰晶形成,减轻蛋白质冷冻变性和细胞机械损伤[23]。
2.5 乳酸菌的耐冻性能
乳酸菌经2、4、6个冻融循环处理后存活率分别为56.90%±5.43%、22.82%±3.02%、1.12%±0.42%,各处理之间差异显著。可见,随着冻融循环次数增加,乳酸菌的存活率越来越低,经过6次冻融循环后存活率仅为1.12%,说明本研究使用的乳酸菌耐冻性能较差。因此,为提高乳酸菌冷冻后的活菌数,添加抗冻保护剂十分必要。
2.6 不同酶解时间鲢鱼酶解产物对乳酸菌的抗冻保护效果
在乳酸菌悬液中添加不同酶解时间的鲢鱼酶解产物,经4次冻融循环后,其存活率如图4所示。可见,相对于对照组(无菌水),不同酶解时间鲢鱼酶解产物对乳酸菌均具有一定的抗冻保护作用,其中酶解120 min的酶解產物对乳酸菌的抗冻保护效果最好,存活率超过80%,显著优于阳性对照(8%甘油)(P<0.05)。另外,添加牛血清蛋白(BSA)对乳酸菌存活率的提高并不理想,表明鲢鱼酶解产物的抗冻保护作用并不是因为其是蛋白质,而可能是因为其中的某种活性组分。此外,抗冻蛋白质(肽)通常亲水性强、表面疏水性较弱[21,26],120 min酶解产物的抗冻保护效果最好,可能与其表面疏水性最小(图2)有关,也可能是因为其水解度和相对分子质量分布(相对分子质量600~2 700的肽含量最高)比较适合于发挥对乳酸菌的低温保护作用。
2.7 不同质量分数鲢鱼酶解产物对乳酸菌冻融存活率的影响
以酶解120 min鲢鱼酶解产物为材料研究其对乳酸菌冻融存活率的影响,结果如图5所示。可见,当酶解产物质量分数为4%时,乳酸菌的存活率可达85.20%,质量分数继续增加,存活率反而显著下降(P<0.05),这可能与高质量分数酶解产物导致的高渗环境对乳酸菌细胞的渗透损伤有关[27]。杨云等[28]研究指出,高质量分数保护剂的使用会给细胞带来副作用,在冷冻保护剂加载和去除过程中,由于胞外渗透压的急剧变化,会引起细胞体积的急剧收缩或膨胀,从而造成细胞膜结构和细胞骨架系统的损伤。同时,冷冻保护剂自身的化学毒性也会对细胞造成毒性损伤。
3 结论
本研究制备了酶解15 min、30 min、60 min、120 min、240 min的鲢鱼酶解产物,分析了其相对分子质量分布、氨基酸组成、表面疏水性、活性巯基含量及其对乳酸菌的抗冻保护活性。结果表明,系列酶解产物的相对分子质量分布主要在 9.00×101至5.40×105,不同酶解时间鲢鱼酶解产物的氨基酸组成和含量基本相同,亲水性氨基酸比例较高,大于氨基酸总量的68%;随着酶解时间增加,酶解产物的表面疏水性和活性巯基含量均呈先降后升趋势,其中酶解120 min鲢鱼酶解产物的表面疏水性最低,酶解30 min鲢鱼酶解产物的活性巯基含量最低。本研究使用的乳酸菌耐冻性能较差,经过4次冻融循环后存活率为22.82%;不同酶解时间鲢鱼酶解产物均对乳酸菌有一定的抗冻保护作用,其中酶解120 min酶解产物对乳酸菌的抗冻保护效果最好,添加质量分数为4%时可使乳酸菌经过4次冻融循环后的存活率提高至85.20%。说明鲢鱼酶解产物是一种良好的乳酸菌抗冻保护剂,对乳酸菌低温保藏或冻干过程中提高其存活率具有潜在价值。
参考文献:
[1] 农业农村部渔业局. 2019中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2019.
[2] 贾成霞,曲疆奇,李永刚,等. 密云水库鲢鱼、鳙鱼营养成分分析与评价[J]. 水产科学, 2019, 38(1): 40-47.
[3] 李向红,李 敏,刘永乐,等. 鲢鱼加工副产物酶解产物对冻融鱼糜肌原纤维蛋白性质的影响[J]. 中国食品学报, 2018, 18(3): 59-66.
[4] MUELLER J P, LICEAGA A M. Characterization and cryoprotection of invasive silver carp (Hypophthalmicthys molitrix) protein hydrolysates[J]. J Aquat Food Prod Technol, 2016, 25: 131-143.
[5] 郭星辛,王发祥,俞 健,等. 鲢鱼酶解产物和鱼胶原肽对冷冻面团品质的影响[J]. 食品与机械, 2018, 34(11): 16-19.
[6] 熊思佳,王发祥,俞 健,等. 鲢鱼酶解产物对酵母菌的抗冻保护作用[J]. 食品与机械, 2018, 34(2): 116-119,180.
[7] WANG F X, XIONG S J, LI X H, et al. Cryoprotective effect of silver carp muscle hydrolysate on baker's yeast Saccharomyces cerevisiae and its underlying mechanism[J]. Food Sci Nutr, 2020, 8(1): 190-198.
[8] 董晓婉,李宝坤,卢士玲,等. 传统分离培养结合PCR-DGGE技术分析传统乳制品中的乳酸菌[J]. 食品与发酵工业, 2014, 40(3): 97-101
[9] 周光燕,张小平,钟 凯,等. 乳酸菌对泡菜发酵过程中亚硝酸盐含量变化及泡菜品质的影响研究[J]. 西南农业学报, 2006, 16(2): 290-293.
[10]李 彤,彭 珍,熊 涛. 乳酸菌发酵对复合豆乳饮料营养成分、香气成分及抗氧化活性的影响[J]. 食品与发酵工业, 2018, 44(4): 111-118.
[11]刘振民,骆承庠. 乳酸菌冷冻损伤研究[J]. 食品与发酵工业, 2002(10): 18-21.
[12]雷雨婷,张英华,霍贵成. 保加利亚乳杆菌的冷适应性与冷应激蛋白的研究[J]. 东北农业大学学报, 2008, 16(5): 101-105.
[13]李明慧,尚一娜,霍麒文,等. 真空冷冻干燥对乳酸菌损伤机制的研究进展[J]. 食品科学, 2018, 39(19): 273-279.
[14]袁亚宏,岳田利,高振鹏,等. 冻干高活力乳酸菌粉保护剂的研究[J]. 西北农林科技大学学报(自然科学版), 2003, 20(S1): 82-84,88.
[15]DELLER R C, CARTER B M, ZAMPETAKIS I, et al. The effect of surface charge on the thermal stability and ice recrystallization inhibition activity of antifreeze protein III (AFP III)[J]. Biochem Biophys Res Commun, 2018, 495(1): 1055-1060.
[16]JIN J, YURKOW E J, ADLER D, et al. Improved freeze drying efficiency by ice nucleation proteins with ice morphology modification[J]. Food Res Int, 2018, 106(4): 90-97.
[17]趙城彬,尹欢欢,鄢健楠,等. 不同热处理条件下大豆蛋白体外模拟消化产物结构和分子质量分布[J]. 中国食品学报, 2020, 20(5): 59-65.
[18]中华人民共和国国家卫生和计划生育委员会国家食品药品监管理总局.食品安全国家标准食品中氨基酸的测定: GB 5009.124-2016[S]. 北京: 中国标准出版社, 2017.
[19]陈 赛,刘永乐,俞 健,等. 壳聚糖复合保鲜对草鱼肌肉蛋白质变化的影响[J]. 食品科学, 2019, 40(11): 207-212.
[20]赵玉红,孔保华. 鱼蛋白水解的研究进展[J]. 肉类工业, 2000(3): 31-34.
[21]刘 尚,廖祥儒,张建国,等. 一种女贞叶抗冻蛋白的分离纯化[J]. 植物学通报, 2007(4): 505-510.
[22]CHEN N J, MORIKAWA J, HASHIMOTO T. Effect of amino acids on the eutectic behavior of NaCl solutions studied by DSC[J]. Cryobiology, 2005, 50(3): 264-272.
[23]HEINZ K A, GLOFCHESKIl D J, LEPOCK J R , et al. Mechanism of freeze-thaw damage to liver alcohol dehydrogenase and protection by cryoprotectants and amino acids[J]. Cryobiology, 1990, 27(5): 521-538.
[24]孙丽洁. 鱼皮抗冻多肽的制备及其提高冷冻面团抗冻性的研究[D]. 无锡: 江南大学, 2017.
[25]CHEN X, LI L, YANG F, et al. Effects of gelatin-based antifreeze peptides on cell viability and oxidant stress of Streptococcus thermophilus during cold stage[J]. Food Chem Toxicol , 2020, 136(1):111056.
[26]颜阿娜,陈 旭,吴金鸿,等. 天然抗冻多肽的性质与对乳酸菌的低温胁迫保护作用[J]. 中国食品学报, 2018, 18(10): 38-44.
[27]ZAWLODZKA S, TAKAMATSU H. Osmotic injury of PC-3 cells by hypertonic NaCl solutions at temperatures above 0 ℃[J]. Cryobiology, 2005, 50(1):58-70.
[28]杨 云,周新丽,戴建军,等. 微流控线性加载低温保护剂减少猪MⅡ期卵母细胞的渗透损伤[J]. 生物化学与生物物理进展, 2016, 43(6): 616-623.
(责任编辑:张震林)
收稿日期:2020-06-09
基金项目:国家自然科学基金项目(31972106);湖南省自然科学基金项目(2020JJ4096);湖南省教育厅科学研究项目(17B016、17C0059、18C0233)
作者简介:崔美丽(1996-),女,山东滨州人,硕士研究生,从事农产品加工与贮藏的研究。(E-mail)cml1070857060@163.com
通讯作者:王发祥,(E-mail)wfx@csust.edu.cn

