水杨酸对刚毛藻生长的抑制作用
熊珍珍,毕永红
1. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉 430072 2. 中国科学院大学,北京 100049
刚毛藻(Cladophora)隶属于绿藻门(Chlorophyta)、刚毛藻属(CladophoraKütz.),是一种大型丝状绿藻,细胞多呈核管状,植物体为分枝或不分枝丝状体,分布广泛,在全球范围内的淡水水体和海水水体中均有分布[1],在自然水体中,刚毛藻的生长一般遵循双季节模式,在春季3月开始快速生长和增殖,夏季6月左右生物量达到最大,此后生物量会减少,但是到了秋季9月左右,又会重新生长[2]。环境条件适宜的情况下,刚毛藻会快速生长和繁殖,形成刚毛藻水华,这种现象在诸多水域中均有发生[3-4]。刚毛藻过度增殖会大量消耗水体中营养物质,影响其他水生生物生长。藻体过度增殖和死亡后腐烂分解,影响水体中氧气的动态平衡,产生有害物质,导致水质恶化,对养殖水体和饮用水等产生严重影响[5-6]。因此,如何有效控制刚毛藻的过度增殖成为目前水生生态系统的一个关注焦点。
酚酸类物质是一类重要的植物次生代谢产物,也是研究最多、被证实是化感活性较强的一类物质[7],对多种藻类生长具有较强的抑制效果[8-9]。且酚酸类物质作为植物的次生代谢产物,其结构简单,能在自然条件下被降解,不易在生态系统中积累,生态安全性较好[10]。Nakai等[11]从狐尾藻中分离出的鞣花酸、没食子酸、焦性没食子酸和(+)-儿茶素几种酚酸类化感物质,对铜绿微囊藻(Microcystisaeruginosa)均具有明显的抑制效果。张庭延等[12]发现对羟基苯甲酸和阿魏酸均对水华鱼腥藻(Anabaenaflos-aquae)和蛋白核小球藻(Chlorellapyrenoidosa)具有明显的抑制作用。目前,酚酸类化感物质对藻类的抑制研究主要集中在铜绿微囊藻、水华鱼腥藻和蛋白核小球藻等水华藻类,对刚毛藻这种大型丝状绿藻的抑制研究鲜有报道。
水杨酸(salicylic acid, SA),即邻羟基苯甲酸,是一种植物体内产生的简单酚酸类化合物,广泛存在于高等植物[13],也是药物与个人护理品(pharmaceuticals and personal care products, PPCPs)的一种重要组成成分,会通过各种人类活动进入到水体中。我国东江检测到的20种PPCPs药物中,水杨酸最高浓度达1 000 ng·L-1以上,广州珠江三角洲河水中普遍检出浓度为2 098 ng·L-1。已有研究显示,水杨酸通常在自然水体中易发生降解,如光降解行为[14]。因此在水环境中不易积累,生态安全性良好。前人的研究表明,水杨酸能抑制多种藻类生长,对铜绿微囊藻和蛋白核小球藻混合体系具有一定抑制作用,半数效应浓度(EC50)为64.9 mg·L-1[15]。当水杨酸浓度为70~100 mg·L-1时,显著抑制池塘水华混合藻类的生长[16]。吴安平等[17]的研究表明,0.6 mmol·L-1的水杨酸能有效抑制水华鱼腥藻的生长繁殖。马艳芝和王向东[18]研究不同除藻剂对青苔去除效果,发现0.4 g·L-1的水杨酸对青苔的去除效果最佳。浓度高于12 mg·L-1的水杨酸处理会抑制拟微绿球藻(Nannochloropsissp.)生长,2.5~40 mg·L-1浓度范围内,水杨酸对三角褐指藻(Phaeodactylumtricornutum)均具有抑制作用,且浓度越高,抑制作用越明显[19],50 mg·L-1外源水杨酸能明显降低龙须菜(Gracilarialemaneiformis)的生长速率[20],表明其具有开发成生物杀藻剂的巨大潜能。本研究根据前期的初步筛选试验结果发现水杨酸对刚毛藻表现出良好的抑制效果,因此开展其对刚毛藻的抑制试验,并初步探讨其作用机理,以期为水杨酸作为抑制剂控制刚毛藻的过度增殖提供试验依据。
1 材料与方法(Materials and methods)
1.1 试验材料
水杨酸购自中国国药有限公司,分析纯,纯度>99.5%。实验开始前将水杨酸配成一定浓度的母液,现配现用。刚毛藻采自武汉市东湖绿道沿岸,经形态学鉴定为寡枝刚毛藻(C.oligoclona)。取回实验室后,先用自来水清洗数遍,挑选去除变老发黄的部分,于室内预培养5 d后进行实验,培养温度(25±1) ℃,光暗比12 h∶12 h,日光灯照射。
1.2 试验处理
将预培养后的刚毛藻用自来水冲洗后,参照郭亮亮等[21]的方式获取刚毛藻鲜质量,刚毛藻初始浓度为(4±0.1) g·L-1(鲜质量),称好的藻体放入1 L烧杯中,于人工气候光照培养箱(PGX-350B,宁波莱福)中静置培养,培养温度(25±1) ℃,光照度40 μmol·m-2·s-1,光暗比12 h∶12 h,每天定时调换烧杯在培养箱中的位置,使藻体受光均匀。根据预试验结果,设置水杨酸浓度梯度分别为0.2、0.25、0.3、0.35和0.4 g·L-1,对照组用蒸馏水代替水杨酸溶液。每个处理(含对照组)设置3个平行,实验周期为96 h。每隔24 h,取样测定刚毛藻细胞叶绿素a(Chla)含量。用概率单位-浓度对数法计算96 h-EC50。以Chla含量的变化评估水杨酸对刚毛藻生长的抑制情况。抑制率(IR)按照公式计算:
IIR(%)=(1-N/N0)×100
式中:IIR表示抑制率,N0为对照组刚毛藻细胞Chla含量;N为水杨酸处理组刚毛藻细胞Chla含量。
1.3 指标测定
Chla含量的测定采用丙酮萃取-分光光度法,参照张志良[22]的方法,取(2±0.1) mg(鲜质量)刚毛藻,采用90%丙酮研磨破碎细胞后,转移至离心管中,于4 ℃浸提24 h后,3 000 r·min-1离心10 min后,取上清,采用紫外分光光度计(UV-1206,Shimadzu,日本)测定750、663、645和630 nm波长下的吸光值,参照公式计算Chla的含量:
mChl a(mg·g-1)=11.64(OOD663-OOD750)-2.16(OOD645-OOD750)+0.1(OOD630-OOD750)×B稀释倍数
式中:mChl a表示Chla的含量,OOD750、OOD663、OOD645和OOD630表示750、663、645和630 nm波长下的吸光值,B稀释倍数表示稀释倍数。
利用植物效率分析仪(Handy PEA,Hansatech,英国)测定PSⅡ最大光化学效率(Fv/Fm),测样前,样品经暗处理15 min后,于室温黑暗条件下测定;超氧化物歧化酶活性(SOD)、过氧化物酶活性(POD)和蛋白含量采用南京建成公司相应试剂盒测定;丙二醛(MDA)含量的测定参照硫代巴比妥酸比色法;细胞显微结构采用Nikon研究显微镜(Ni-U,Nikon,日本)在40×物镜下观察拍照。
1.4 数据处理
采用Origin 9.1软件(https://www.originlab.com)制图,统计分析采用SPSS 25.0(IBM,USA),对试验数据进行单因素方差分析,若有显著差异则进行LSD多重比较来检验组间差异显著性,P<0.05、P<0.01表示差异显著。
2 结果(Results)
2.1 水杨酸对Chl a含量的影响
水杨酸处理对刚毛藻细胞Chla含量影响如图1所示。对照组Chla含量起初维持在稳定水平,48 h后开始上升。与对照组相比,在试验浓度范围内(0.2~0.4 g·L-1),各处理组Chla含量均在初始24 h暴露时下降,且处理组浓度越高,其下降趋势越明显。随处理时间延长,暴露96 h,各水杨酸处理组的Chla含量明显低于对照组(P<0.05),且水杨酸处理组浓度越高,刚毛藻细胞内Chla含量越低,呈明显剂量依赖关系。
2.2 水杨酸对生长的影响
水杨酸对刚毛藻生长的抑制率如表1所示。结果表明,水杨酸处理24 h,各浓度处理组对刚毛藻的
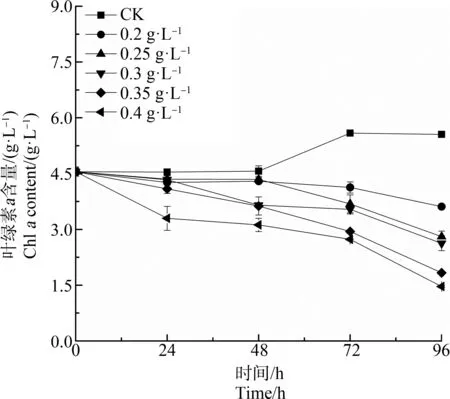
图1 不同浓度水杨酸对刚毛藻细胞 叶绿素a(Chl a)含量的影响Fig. 1 Effect of salicylic acid at different concentration on chlorophyll a (Chl a) content of C. oligoclona
生长均表现出抑制效应,且水杨酸浓度越高,抑制效果越明显。暴露24 h,对刚毛藻的抑制率为3.42%~27.40%,经过96 h暴露,抑制率升高至34.95%~73.64%,表明其抑制效果会随处理时间的延长而增强。高浓度组0.4 g·L-1水杨酸处理对刚毛藻的抑制率最高,暴露96 h抑制率可高达73.64%。如表2所示,采用概率单位-浓度对数法计算得出,水杨酸对刚毛藻96 h-EC50为0.262 g·L-1。
2.3 水杨酸对叶绿素荧光活性的影响
如图2所示,不同浓度水杨酸处理对刚毛藻PSⅡ的Fv/Fm具有显著影响。对照组Fv/Fm始终保持在相对稳定的水平,其值在0.73左右。水杨酸处理24 h,各浓度处理组的刚毛藻细胞Fv/Fm均显著下降(P<0.01),仅为对照组的1.37%~2.6%。这表明刚毛藻PSⅡ对水杨酸的暴露十分敏感。随处理时间延长,各浓度处理组之间刚毛藻的Fv/Fm差异不显著(P>0.05),均稳定在较低水平,但各个处理组的Fv/Fm均显著低于对照组(P<0.01)。
2.4 水杨酸对MDA含量的影响
不同浓度水杨酸对刚毛藻MDA含量的影响如图3所示,随水杨酸处理浓度的增加,MDA含量逐渐升高。最高浓度0.4 g·L-1处理时,MDA含量显著增加,为对照组的4.5倍,显著高于对照组(P<0.01)。MDA是衡量膜脂过氧化的一个指标,可反映藻细胞膜脂过氧化程度。结果表明,浓度为0.2~0.4 g·L-1水杨酸处理刚毛藻时,水杨酸浓度越高,对藻细胞膜系统损伤程度越高,膜系统通透性受到破坏。
2.5 水杨酸对抗氧化酶活性和可溶性蛋白含量的影响
不同浓度水杨酸暴露96 h后刚毛藻细胞SOD和POD活性如图4(a)和图4(b)所示。结果表明,各浓度处理组SOD活性均与对照组有显著差异(P<0.01)。0.2 g·L-1处理96 h,SOD活性为对照组的34.76%,SOD活性显著降低(P<0.01),0.35~0.4 g·L-1处理,SOD活性仅为对照组活性的31.77%~32.77%。刚毛藻POD活性对水杨酸暴露十分敏感,各浓度处理组POD活性与对照组相比,均显著降低(P<0.01)。在0.2 g·L-1水杨酸中暴露96 h后,POD活性仅为对照组的9.75%,表明水杨酸处理能显著降低刚毛藻细胞POD活性。
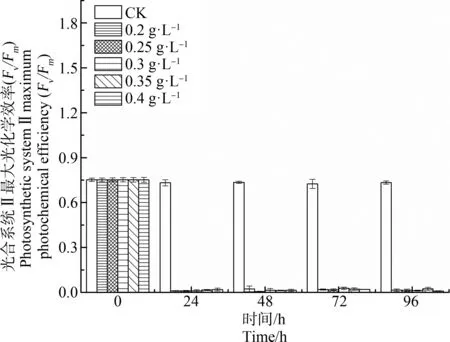
图2 不同浓度水杨酸对刚毛藻细胞光合 系统Ⅱ最大光化学效率(Fv/Fm)的影响Fig. 2 Effect of different concentration of salicylic acid on the maximum photochemical efficiency of photosynthetic systemⅡ (Fv/Fm) of C. oligoclona
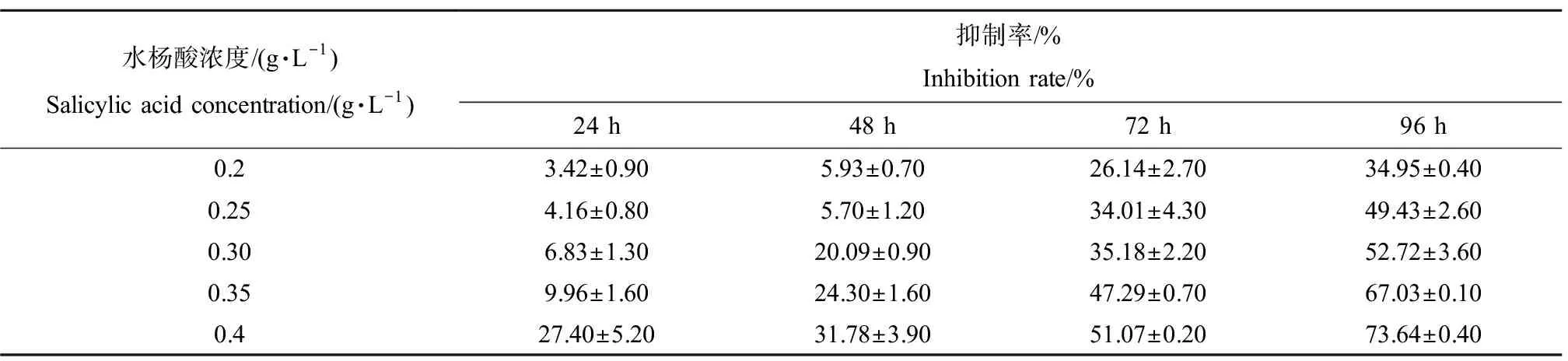
表1 水杨酸对刚毛藻抑制率的影响Table 1 Inhibition rate of salicylic acid on C. oligoclona

表2 水杨酸处理对刚毛藻的半数效应浓度(EC50)Table 2 The median effect concentration (EC50) value of salicylic acid to C. oligoclona
如图4(c)所示,添加不同浓度水杨酸后刚毛藻细胞中的蛋白含量均显著降低。对照组可溶性蛋白含量为0.45 mg·g-1,0.2 g·L-1和0.25 g·L-1处理96 h后,刚毛藻细胞可溶性蛋白含量分别降至对照组的39.11%和44%,高浓度0.4 g·L-1水杨酸暴露下,可溶性蛋白含量仅为对照组的36.22%。
2.6 水杨酸对刚毛藻细胞显微结构的影响
水杨酸暴露后刚毛藻细胞显微结构如图5所示,对照组刚毛藻细胞(图5(a))整体结构完整,细胞内物质均匀分布,色素体结构完整,蛋白核清晰可见,细胞呈鲜绿色。
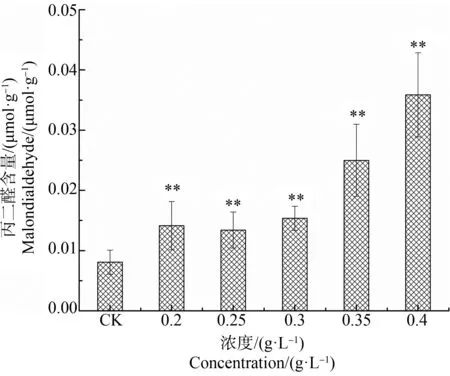
图3 不同浓度水杨酸对刚毛藻丙二醛(MDA)含量的影响注:*表示P<0.05,**表示P<0.01。Fig. 3 Effect of different concentration of salicylic acid on malondialdehyde (MDA) of C. oligoclonaNote: *represents P<0.05; **represents P<0.01.
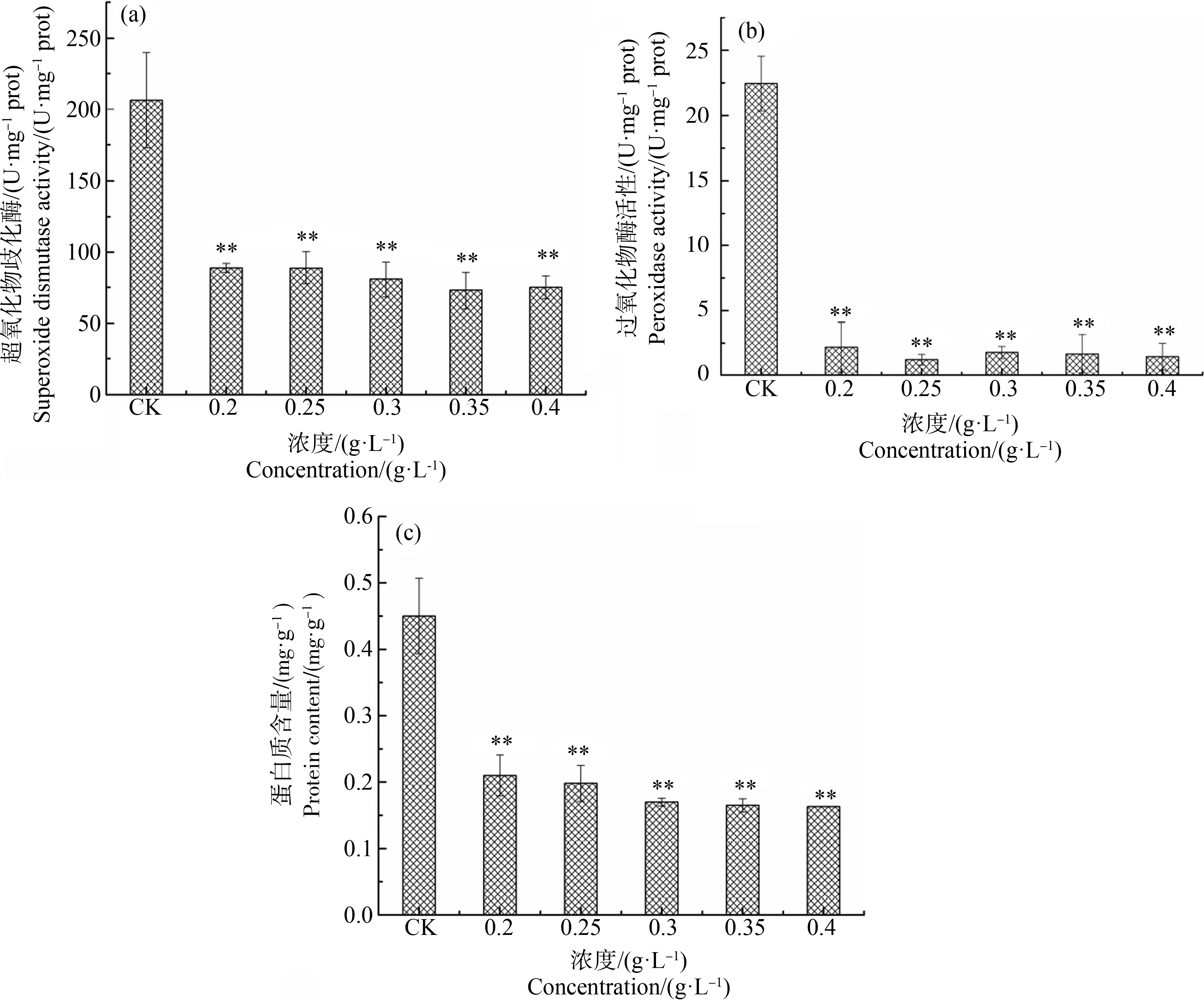
图4 不同浓度水杨酸对刚毛藻超氧化物歧化酶(SOD)活性(a)、过氧化物酶(POD)活性(b)和蛋白含量(c)的影响注:*表示P<0.05,**表示P<0.01。Fig. 4 Effect of different concentration of salicylic acid on superoxide dismutase (SOD) activity (a), peroxidase (POD) activity (b) and protein content (c) of C. oligoclonaNote: *represents P<0.05; **represents P<0.01.

图5 不同浓度水杨酸(SA)对刚毛藻细胞显微结构的影响(比例尺10 μm) 注:(a) CK;(b) 0.2 g·L-1 SA;(c) 0.25 g·L-1 SA;(d) 0.3 g·L-1 SA;(e) 0.35 g·L-1 SA;(f) 0.4 g·L-1 SA。Fig. 5 Effects of salicylic acid (SA) at different concentrations on the cell microstructure of C. oligoclona (scale 10 μm)Note: (a) CK; (b) 0.2 g·L-1 SA; (c) 0.25 g·L-1 SA; (d) 0.3 g·L-1 SA; (e) 0.35 g·L-1 SA; (f) 0.4 g·L-1 SA.
暴露在0.2~0.4 g·L-1水杨酸下的刚毛藻细胞(图5(b)~图5(f)),随处理浓度的增大,色素含量逐渐减褪;蛋白核数量减少,藻细胞颜色变黄发白。
3 讨论(Discussion)
藻细胞生物膜中的不饱和脂肪酸会在活性氧物质的胁迫下,发生过氧化,形成脂质过氧化产物,MDA是膜脂过氧化的主要产物之一,其含量高低可反映细胞内膜脂过氧化损伤程度[23-24],还可作为细胞内活性氧增多的衡量指标。前人的研究表明,酚酸物质能影响藻细胞膜结构和功能,使藻细胞膜完整性和通透性发生改变。在香草酸、对羟基苯甲酸和焦性没食子酸3种酚酸物质作用下,中肋骨条藻(Skeletonemacostatum)细胞发生膜脂过氧化,MDA含量明显升高,生长受到显著抑制[25]。铜绿微囊藻因受到邻苯三酚和咖啡酸的胁迫,细胞内MDA含量增加,细胞膜完整性受影响,显著抑制藻类生长[26]。本研究发现,水杨酸处理后,刚毛藻细胞中MDA含量显著升高,这是由于在水杨酸处理后,诱导产生活性氧等物质,在活性氧的作用下,刚毛藻细胞膜系统发生过氧化,导致MDA含量升高,膜系统完整性被破坏,使水杨酸更加容易进入到细胞内,进一步作用藻细胞内其他组织,加速藻细胞死亡。
有研究表明,酚酸类化感物质可以通过影响藻细胞内叶绿素含量,降低其光合作用效率,使同化产物减少,从而抑制藻类生长[27-28]。胡利静等[29]研究外源水杨酸对铜绿微囊藻生长和光合系统的影响,发现0.12 g·L-1水杨酸能有效抑制铜绿微囊藻Chla的合成,阻碍其对光能的吸收和转化,抑制藻类生长。本研究结果表明,在实验浓度范围内,水杨酸处理后,刚毛藻细胞Chla含量明显降低,且暴露浓度越高,其效果越明显,呈现出明显剂量依赖关系。细胞显微结构也显示出刚毛藻细胞色素含量随水杨酸浓度升高逐渐减褪,证明一定浓度水杨酸处理能导致刚毛藻细胞Chla含量的明显下降,这与诸多研究结果相一致[15,30]。PSⅡ是化感物质作用于藻类细胞的位点之一[31],Fv/Fm是衡量藻类PSⅡ光合性能的主要参数,是表征藻类光合作用效率的重要指标[32]。Gao等[33]研究发现,水杨酸处理莱茵衣藻(Chlamydomonasreinhardtii)后,其Fv/Fm迅速下降,PSⅡ光合活性显著降低。Dziga等[34]认为焦桔酸、对苯二酚对铜绿微囊藻生长的抑制可能与藻细胞光合系统受到抑制有关。本试验结果中,添加水杨酸处理后的刚毛藻细胞Fv/Fm均显著低于对照组,可见添加一定量水杨酸能够导致藻细胞PSⅡ受损,降低刚毛藻光合作用效率,使同化产物减少,从而抑制其生长。
生物在进化过程中形成了一套完整的抵抗外界不良因素的抗氧化酶系统,SOD和POD是生物抗氧化酶系统中的2种重要的酶[35-36],能消除植物体内过量的氧自由基,使体内的氧代谢处于一个动态平衡中[37]。当植物受到外界胁迫时,细胞内氧自由基浓度上升,当其浓度超过一定范围,抗氧化体系酶不能及时清除,过量的氧自由基会导致抗氧化体系酶活的降低[38-39]。在本试验设定浓度范围内,水杨酸处理后刚毛藻SOD和POD活性明显下降,蛋白含量显著低于对照组,推测是刚毛藻在受到水杨酸胁迫后,诱导产生的活性氧剂量上升至或者是超过其细胞抗氧化体系酶的催化阈值,导致SOD和POD不能及时有效清除细胞体内过剩的活性氧,代谢平衡被打破,过量的活性氧破坏了细胞内蛋白质等生物大分子,表现出酶活性的下降和蛋白含量的减少,从而抑制藻类生长。
前人研究证明了酚酸类物质是一类重要的化感物质,可快速抑制多种藻类的生长,易降解,不易在生态系统中积累,在藻类控制方面具有良好的应用前景[40]。由于不同藻类的细胞结构和生理特性等存在差异,对水杨酸敏感程度不同,水杨酸对其抑制浓度也存在明显差异。本研究证明了一定浓度的水杨酸能有效抑制刚毛藻生长,在0.2~0.4 g·L-1处置浓度范围内,随水杨酸浓度增加,对刚毛藻抑制效果更明显。通过拟合计算得出,水杨酸对刚毛藻96 h-EC50为0.262 g·L-1,结合光合活性、抗氧化酶活性和膜脂过氧化等生理指标测定结果可知,在半数抑制浓度0.262 g·L-1下,就能使刚毛藻光合色素和光合活性显著降低,导致藻细胞PSⅡ失活,无法进行光合作用,同时使膜脂过氧化加剧破坏膜系统完整性,并抑制细胞抗氧化酶活性,对刚毛藻表现出了良好的抑制效果。这说明,水杨酸具有被开发成刚毛藻快速增殖抑制剂的潜力,具有一定应用价值。结合本试验结果并从经济成本角度综合考虑,针对刚毛藻过度增殖、大量暴发的水域,建议添加使用浓度为0.262 g·L-1的水杨酸为辅助手段,同时联用物理打捞和生物生态技术,可达到良好的处置效果。

