稀土元素La(Ⅲ)对铜绿微囊藻生长和生理特性的影响
卢桂蓉,王应军,范子奇
四川农业大学环境学院,成都 611130
铜绿微囊藻是引起我国湖泊蓝藻水华的优势藻种之一,其大量增殖会释放危害人体健康的藻毒素[1],并破坏自然生态系统[2]。氮、磷是易限制藻类生长的元素[3]。研究发现,在贫营养湖泊中,少量的稀土能作为蓝藻细胞的一种营养元素被利用与储存,并对藻细胞的生长和生理活性产生影响,稀土的输入是引起低营养水体发生“水华”现象的原因之一[4-5],因此,有研究开始关注稀土元素能否取代氮、磷,进而引发贫营养水体向富营养方向发展[6]。
如今,稀土元素的优质功能不断被挖掘,导致市场需求量急剧增加,稀土矿山挖采过程中产生的废水会对环境造成严重的污染。在詹鸿峰等[7]对某地区离子型稀土矿矿山废水的调查研究中发现,该矿山废水中含有较多的镧(La)、钕、镨和钇等稀土元素,其含量分别可达0.70、0.15、0.25和0.14 mg·L-1。而La作为稀土中含量第二丰富的元素,因其独特的物化性质被广泛应用,使得大量的La从原矿区逐渐转移至其他区域环境,以枯水期长江部分流域为例,其含量达到0.1 mg·L-1[8],远远超过世界淡水中含量的平均水平,且含量呈现逐渐增加的趋势,因此,在自然水体中存在高浓度La的可能性也逐渐增加。
但是,目前关于稀土对水生植物影响的研究较少,已有实验表明La3+能提高植物叶绿素含量、促进植物对营养元素的吸收、刺激幼苗的萌发生长[9],增强植物在逆境下的抗逆性[10-11]。根据物化性质可把稀土元素分为轻、重2种稀土。其中,杜金戈等[12]研究证明重稀土钇对缺N或P胁迫影响下的铜绿微囊藻有明显的“Hormesis”效应[13],而La作为一种轻稀土,在营养元素限制的条件下,对铜绿微囊藻是否有类似的影响机制,目前尚无清楚的认知。因此,本实验以缺N、缺P胁迫的实验条件模拟贫营养水体,测定不同浓度La3+对铜绿微囊藻生长量及抗氧化酶活性等生理指标的影响,进一步研究轻稀土元素La对贫营养水体发生富营养化现象的影响及作用机制,并为潜在的稀土污染风险评价及预测提供参考依据。
1 材料与方法(Materials and methods)
1.1 受试藻种与镧贮备液的配制1.1.1 受试藻种
本实验所使用的藻种是铜绿微囊藻FACHB912,购自中国科学院水生生物研究所藻种库(FACHB),此株系从太湖中经过分离、纯化后获得。在藻种购得后,用BG-11培养基进行扩培,并将培养的光照度设置为2 000~2 500 lx,温度为(25±0.5) ℃,光暗比为12 h∶12 h。
1.1.2 镧贮备液
称取0.5888 g La2O3(AR,成都恒瑞新材料有限公司),再加入少量的超纯水以及浓盐酸(AR)并进行加热溶解,当盐酸充分挥发后,转移至100 mL容量瓶用超纯水定容至刻度线,再移取1 mL定容后的溶液至1 000 mL容量瓶中用超纯水定容,得到浓度为5 mg·L-1的La3+溶液,将贮备液经蒸汽高压灭菌后备用。
1.2 藻类培养实验与指标测定1.2.1 藻类培养
当铜绿微囊藻处于对数生长期时,取一定量的藻液,经5 000 r·min-1离心10 min后收集藻细胞,分别用不含P、不含N以及不含N、P的BG-11培养基洗涤4次后,重新接种到新的缺P、缺N以及同时缺N、P的BG-11培养基中;再取适量藻液重新接种到含有N、P元素的BG-11培养基中(对照组),将所有组的藻密度均调为1.2×106cells·mL-1。在无菌环境下,分别向锥形瓶中加入500 mL含藻的缺P的BG-11培养基、缺N的BG-11培养基、缺N、P的BG-11培养基、正常BG-11培养基,再分别加入0、2.5、5、12.5和25 mL La3+储备液,使各锥形瓶中La3+浓度分别为0、0.10、0.20、0.50和1.00 mg·L-1,并分别设置3个平行。将接种后的培养基均置于光照培养箱中静置培养16 d,培养条件与扩培条件相同。在同时缺N、P组中,铜绿微囊藻不能正常生长,后续指标均未测量。
1.2.2 藻密度测定
采用分光光度法测定铜绿微囊藻数量,每天定时取3 mL藻液,在波长为680 nm处测定其吸光度,再通过相应的标准曲线换算出培养液中藻细胞的浓度[14]。
1.2.3 叶绿素a含量的测定
采用丙酮萃取法[15]。在实验的第4、8、12和16天,从培养基中取10 mL藻液,经5 000 r·min-1离心10 min,弃去上清液,再加入5 mL 90%丙酮,摇匀后在温度为4 ℃下避光萃取24 h,再经5 000 r·min-1离心10 min,取上清液,用90%的丙酮作参照,分别在波长630、645、663和750 nm处测定其吸光度,并按以下公式计算叶绿素a含量[16]。
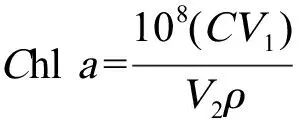
式中:V1为提取液体积(mL);V2为藻液体积(mL);ρ为藻细胞密度(cells·mL-1);Chla为叶绿素a含量(μg·(108cells)-1)。
1.2.4 粗酶液的提取
在实验的第4、8、12和16天取10 mL藻液,10 000 r·min-1离心10 min,收集藻细胞,加0.05 mg·L-1、pH为7.8的磷酸缓冲液1.5 mL,并于液氮内反复冻融5次后用匀浆器研磨5 min,然后在4 ℃下40 000 r·min-1离心10 min,所得上清液即为粗酶液。
1.2.5 可溶性蛋白含量、抗氧化酶活性、丙二醛含量和可溶性糖的测定
取由实验1.2.4所提取的粗酶液,以考马斯亮蓝法测定可溶性蛋白含量[17],以愈创木酚法[18]测定过氧化物酶(POD)活性,以钼酸铵比色法[19]测定过氧化氢酶(CAT)活性,以硫代巴比妥酸TBA比色法[20]测定丙二醛(MDA)含量,以蒽酮硫酸比色法[21]测定可溶性糖含量。以上指标均采用南京建成生物工程研究所测试盒测定。
1.3 数据处理
结果采用Origin2019软件进行处理和绘图,同时,使用SPSS 20.0软件进行差异显著性分析及检验,当P<0.05差异显著。
2 结果与讨论(Results and discussion)
2.1 La3+对铜绿微囊藻生长量的影响
由图1可知,在对照组中,培养初期藻细胞处于适应阶段,生长差异不明显,第10天藻细胞进入对数生长期。藻的生长量总体高于缺N和缺P这2组,可知N、P元素的缺乏会对藻类的正常生长产生不利影响[22]。当La3+浓度在0~1.00 mg·L-1范围内,铜绿微囊藻生长量随La3+浓度增加呈现先增后减的趋势,均表现为促进作用。在La3+浓度为0.50 mg·L-1时,La3+对铜绿微囊藻的刺激作用达到最大,藻细胞的增长幅度明显高于不加稀土La3+的空白组(P<0.01),在第16天达到最大生物量1.77×105cells·mL-1,比空白组(0 mg·L-1La3+)生物量增加了43.59%。
在缺P组中,藻细胞增长较为缓慢,当La3+浓度为0.10~0.20 mg·L-1时,藻细胞的生长幅度显著高于单一缺P组(P<0.01),且La3+浓度为0.20 mg·L-1时,促进作用达到最大,在第16天达到最大生物量6.59×106cells·mL-1,比单一缺P组增加了7.32%;随着La3+浓度的增加(0.50~1.00 mg·L-1),铜绿微囊藻的生长受到抑制,其藻细胞的生长幅度低于空白组(P<0.01),且浓度越大,抑制作用越强。
在缺N组中,在La3+浓度为0 mg·L-1时,藻可以维持11 d的缓慢生长,其细胞密度最大为2.71×106cells·mL-1,而La3+浓度为0.10~1.00 mg·L-1时,藻细胞量在7 d缓慢增加后迅速减少,且藻细胞在整个培养期内的生长量均低于单一缺N组,说明La3+在缺N胁迫下,对铜绿微囊藻表现为迫害作用。铜绿微囊藻在缺N培养基中细胞的生物量明显低于缺P培养基中的生长,铜绿微囊藻对P缺乏的耐受能力高于对N缺乏的耐受能力(P<0.01)。铜绿微囊藻在适应期结束后未迅速进入对数生长期,而出现停止生长甚至下降的趋势,因此,测定藻细胞内各生理指标意义不大,后续分析中不考虑缺N组。
由此可见,缺乏N、P营养元素不利于铜绿微囊藻的生长,而适量的La能促进藻类的生长。缺P会降低铜绿微囊藻对稀土La3+浓度的耐受能力,可能是因为藻细胞对稀土的富集能力与磷元素有关。崔宜淳[23]的培养实验结果表明,少量稀土元素能够改变藻类细胞器的某些结构及相应的功能,此外,稀土可以与某些特定的酶结合,并激活酶的活性,进而加快藻细胞的生长代谢,促进藻类生长,这一结论与吕赟等[24]对水华鱼腥藻的培养实验结果相似;而在高浓度稀土的培养下,藻类的生长会受到抑制,相关实验研究也证明,过量的稀土元素会竞争性地结合活性中心,抑制多种与藻类生长相关酶的活性,导致藻类的生长受到抑制[25]。铜绿微囊藻对P缺乏的耐受力高于对N缺乏的耐受力,适宜浓度的稀土La3+能短时间抵抗由于缺P造成的损害,维持铜绿微囊藻的正常生长;但在缺N胁迫下,稀土La3+不能减少缺N胁迫的损害,反而与缺N共同对铜绿微囊藻的生长造成了负面影响。
2.2 La3+对Chl a含量的影响
大多数藻细胞通常需要通过光合作用才能合成维持其自身正常生命代谢活动所需要的有机物,而Chla作为一种重要的光合色素,具有吸收并转化光能的功能,其转换效率即光合作用效率能够直接反映藻细胞将光能转化为自身所需化学能的能力,是光合作用的重要指标之一[26]。因此,Chla可以作为评估植物或藻类生长状况的一项重要指标。
如图2所示,在对照组中,Chla含量在整个培养周期内均呈现增加趋势,随着藻进入对数期,Chla增长幅度增加,且增加量随着La3+浓度的升高呈现先增后减的趋势。在La3+浓度为0.50 mg·L-1时Chla含量达到最大,在第4、8、12和16天的生长量分别比空白组藻Chla的含量提高了22.81%、45.68%、71.00%和80.95%(P<0.01)。即适宜浓度的稀土La3+能提高铜绿微囊藻的光合效率,促进叶绿素的合成。
在缺P组中,低浓度的La3+(0.10~0.20 mg·L-1)对Chla表现为刺激作用(P<0.01),浓度为0.20 mgL-1时促进作用达到最大,其Chla含量在第12天为0.89 mg·L-1,比单一缺P组(0 mg·L-1La3+)中铜绿微囊藻中Chla含量提高了31.75%,而高浓度的La3+(0.50~1.00 mg·L-1)表现为抑制作用,在La3+浓度为1.00 mg·L-1抑制作用达到最大,第16天的Chla含量为0.57 mg·L-1,比单一缺P组降低了15.48%。在相同La3+浓度下,缺P组藻细胞内Chla含量低于对照组,即缺P会影响藻细胞内Chla的合成,这一结果与张杰等[9]研究La对水稻幼苗影响的实验结果类似。本研究表明,适宜La3+浓度能够刺激细胞内Chla的合成从而提高光合效率,有利于铜绿微囊藻细胞合成大量有机物。已有的研究表明,适宜的稀土元素可以作为一种中间物质与K+、Na+和Ca2+等离子发生相互作用,调节细胞对某些营养元素的吸收效率,进而增加细胞内叶绿素的合成量,而高浓度La3+对细胞的活化作用低于Mg2+,使细胞内叶绿素的合成受到较强的抑制作用[27]。
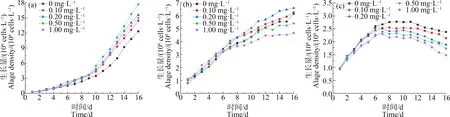
图1 在不同生长环境下不同浓度La3+对铜绿微囊藻生长量的影响注:(a)对照组;(b)缺磷组;(c)缺氮组。Fig. 1 Effects of La3+ with different concentration on the growth of Microcystis aeruginosa under different growth environmentsNote:(a) Control group; (b) Phosphorus deficiency group; (c) Nitrogen deficiency group.
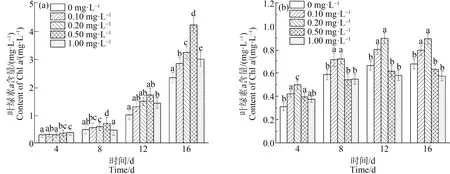
图2 不同浓度La3+处理下对叶绿素a (Chl a)的影响注:(a)对照组;(b)缺磷组。Fig. 2 Chlorophyla (Chl a) content under different La3+ treatmentsNote: (a) Control group; (b) Phosphorus deficiency group.
2.3 La3+对可溶性糖含量的影响
可溶性糖在植物的整个生命周期中具有十分重要的作用。已有的研究表明,可溶性糖可作为植物生长发育和有关基因表达的重要调节因子之一,也是维持藻细胞正常渗透压的重要调节物质,能表示藻类细胞的抗逆性大小,其含量在一定的程度上能够定性地反映藻类细胞抵御外界不良环境的能力[28]。同时,可溶性糖作为植物光合作用的主要产物,是储存、积累及运输有机物的主要形式[29]。
如图3所示,对照组中,在整个培养周期内,随着培养时间的延长,不同La3+浓度处理下的藻细胞内可溶性糖的含量均逐渐减少。在La3+浓度为0.10~0.50 mg·L-1时,可溶性糖含量低于空白组,且随La3+浓度增加可溶性糖含量减少。在前半个周期中,当La3+浓度为1.00 mg·L-1时,可溶性糖含量明显高于空白组(P<0.01)。在第4、12和16天中,La3+浓度为0.50 mg·L-1时,可溶性糖含量分别达到同一时间测定的最低量,分别为425.89、195.32和114.73 mg·L-1。
缺P胁迫下,La3+浓度在0.10~0.02 mg·L-1范围内可溶性糖含量减少,在La3+浓度为0.10 mg·L-1时,可溶性糖含量最低,其在第4、8、12和16天含量分别为554.34、421.02、305.93和224.74 mg·L-1,分别比单一缺P胁迫下的铜绿微囊藻中可溶性糖含量降低了11.91%、26.13%、33.40%和28.89%。当稀土La3+的浓度大于0.20 mg·L-1时,可溶性糖的含量随稀土La3+浓度增加而增多。
不同浓度的稀土La3+对缺P组和对照组的藻有不同的影响机制,缺P组中藻内可溶性糖的含量整体高于对照组,且在可溶性糖含量最低时对应的稀土La3+浓度存在差异。在轻度胁迫下,可溶性糖可作为渗透压调节剂,维持着细胞内渗透压平衡[30];有研究表明,重金属胁迫下,细胞内的可溶性糖会出现几种不同的变化趋势[30-33]。在本实验中,可溶性糖的含量随着稀土La3+浓度增加呈现先减后增的趋势,这与王琼等[30]的实验结果一致,可知对照组中可溶性糖含量的变化趋势主要是由于渗透压引起。在缺P组中,低浓度的La3+可能通过改变细胞器结构功能,促进细胞利用糖类作为能量供给来加快藻类细胞的代谢;而高浓度的La3+可能使细胞外渗透压增大,藻细胞破灭导致可溶性糖流出,测定出的可溶性糖含量增加。同时,在高浓度La3+的胁迫下,藻细胞的结构受损,而P元素是细胞内能量直接来源ATP合成的必要元素,缺P会导致ATP含量减少,使可溶性糖的利用量大大降低,可溶性糖在细胞内的积累量增加,造成其含量明显高于对照组中的含量。
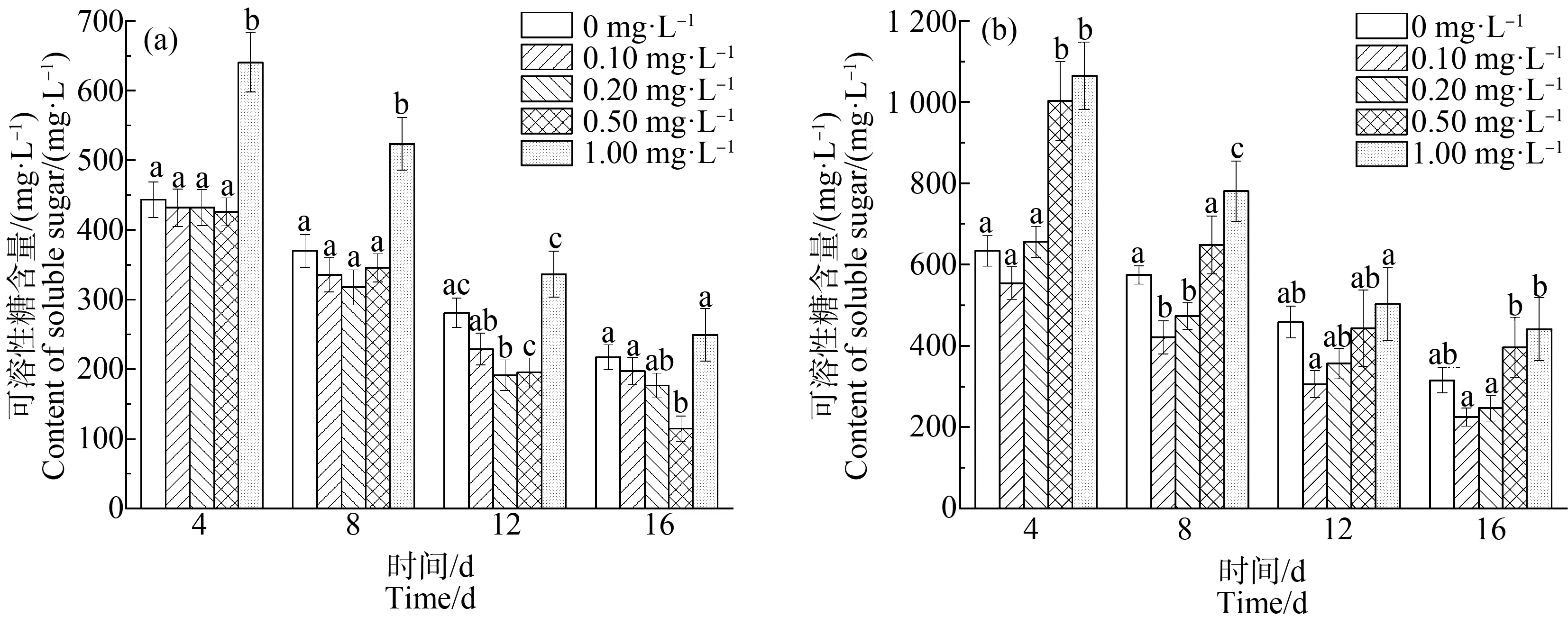
图3 不同浓度La3+处理下可溶性糖含量变化注:(a)对照组;(b)缺磷组。Fig. 3 Soluble sugar content under different La3+ treatmentsNote: (a) Control group; (b) Phosphorus deficiency group.
2.4 La3+对可溶性蛋白含量的影响
藻细胞中的大部分可溶性蛋白质是参与藻类各种代谢有关的酶类,因此,可溶性蛋白含量可以作为衡量藻类或植物的生理生化反应及总代谢的重要指标之一。
由图4可知,对照组中,浓度为0.10~1.00 mg·L-1的稀土La3+能显著提高铜绿微囊藻的蛋白质含量(P<0.01),在浓度为0.50 mg·L-1时,藻类蛋白质含量达到最大,在第8、12和16天的含量分别为0.70、1.45和1.91 mg·L-1,分别比空白组中铜绿微囊藻的蛋白质含量提高了22.81%、46.46%和0.24%。蛋白质的含量与光合作用密切相关,在此浓度范围内,稀土La3+促进Chla的合成,提高了藻细胞的光合速率,使光合作用制造的蛋白质明显增多。
缺P组中,在La3+浓度为0.10~0.20 mg·L-1时,蛋白质含量高于单一缺P组,表现为促进作用,且在浓度为0.2 mg·L-1时促进作用最明显,在第12天的蛋白质含量提高量最大(P<0.01),为34.54%;随着培养液中La3+浓度增加(La3+浓度>0.2 mg·L-1),藻细胞内的可溶性蛋白的含量呈下降趋势。
缺P组中,蛋白质含量及增长速度均低于相同浓度La3+处理下的对照组,对照组中的蛋白质含量在第16天最高达到1.906 mg·L-1,比缺P组中最高含量0.844 mg·L-1提高55.7%。因此,缺P会影响藻细胞内蛋白质的合成,进而影响藻类的正常代谢。低浓度的La3+均能增加可溶性蛋白质的含量,已有的研究结果表明,适量的稀土能通过某种机制将信号传递到细胞内,促进钙调蛋白(CaM)基因表达,激活依赖于CaM的各种酶活性,引起蛋白质含量升高[34];而高浓度的La3+则抑制CaM基因表达[35-36],使合成的蛋白质等有机物量减少。
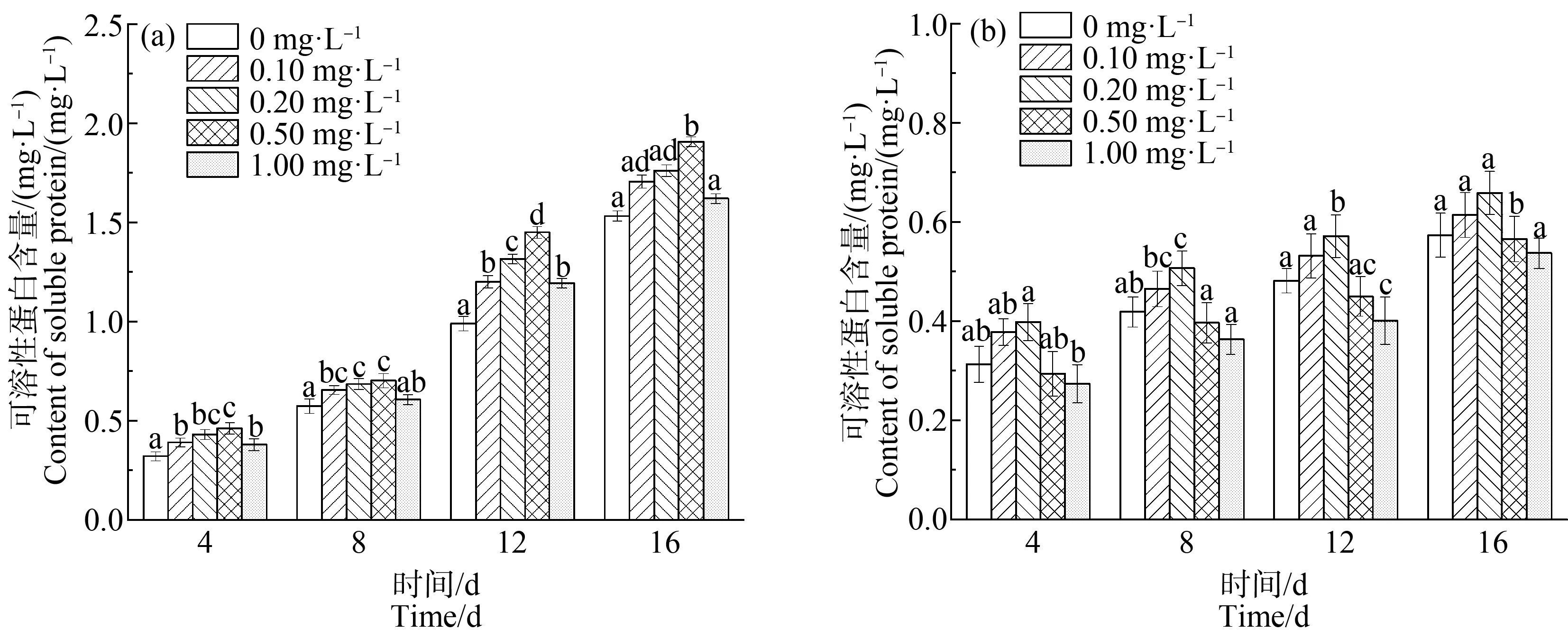
图4 不同浓度La3+处理下蛋白质含量变化注:(a)对照组;(b)缺磷组。Fig. 4 Protein content under different La3+ treatmentsNote: (a) Controll group; (b) Phosphorus deficiency group.
2.5 La3+对CAT、POD活性的影响
植物在生长发育过程中需要吸收、利用氧气来维持自身的正常生长代谢,在此过程中,细胞内会生成一定量的有害物质活性氧(ROS)[37]。活性氧作为自然生理过程中产生的有害代谢产物,具有氧化植物细胞内的蛋白质、脂质和核酸,以及破坏植物细胞正常结构和生理功能的危害作用[38-39]。在植物正常的生长过程中,植物体内的ROS会保持一种动态平衡,即植物体内产生的ROS与体内抗氧化系统清除ROS的物质存在一定关系[40]。但是,当植物细胞受到严重胁迫时,细胞体内产生的ROS将无法及时被抗氧化系统消除,进而大量累积,抑制了抗氧化酶活性[41]。
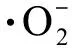
如图5和图6所示,缺P组中,CAT和POD的活性均随La3+浓度的增加,表现出先增后减的趋势。在第12天,La3+浓度达到0.20 mg·L-1时,CAT和POD活性均达到最高,分别为11.29 U·(108cells)-1和7.29 U·(108cells)-1,比单一缺P组分别提高了25.58%和30.65%(P<0.01);而高浓度La3+下,CAT和POD活性下降,可能是因为高浓度的La3+破坏了藻细胞内的抗氧化平衡,导致抗氧化酶活性降低。在第16天时,在长时间的缺P和La3+的协同胁迫下,铜绿微囊藻受到抑制作用增强,叶绿素合成减少,蛋白质含量下降,CAT活性也随之下降。对照组中,CAT和POD的活性与缺P组表现出类似的变化趋势,但CAT(P<0.01)和POD在La3+浓度为0.5 mg·L-1时活性达到最大值。
对比2组实验可以发现,缺P组中CAT和POD活性高于对照组,而藻细胞对La3+的耐受能力低于于对照组,即营养元素P的缺乏会加重铜绿微囊藻膜脂过氧化的程度。与杜金戈等[12]的实验结果类似,即低浓度的稀土元素能促进酶活性的增强,高浓度则抑制酶活性。
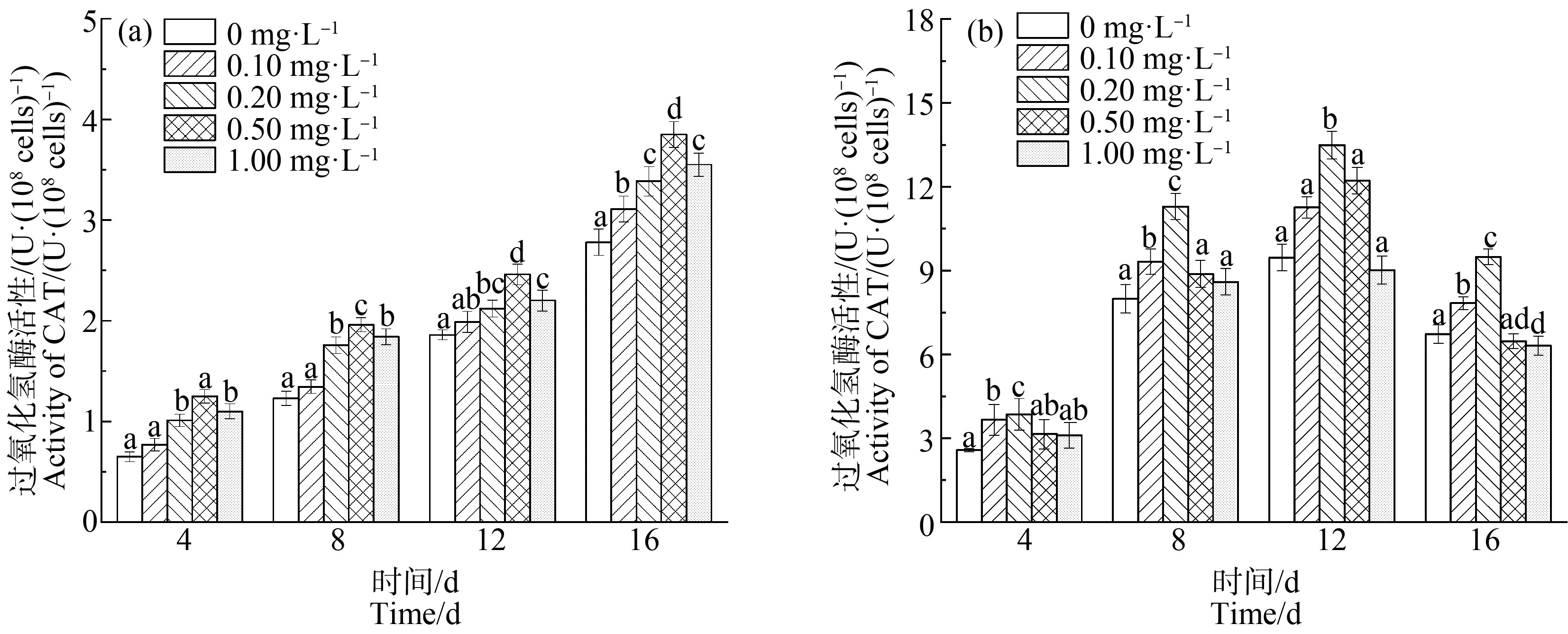
图5 不同浓度La3+处理下过氧化氢酶(CAT)活性变化注:(a)对照组;(b)缺磷组。Fig. 5 The catalase (CAT) activity under different La3+ treatmentsNote: (a) Control group; (b) Phosphorus deficiency group.
图6 不同浓度La3+处理下过氧化物酶(POD)活性变化注:(a)对照组;(b)缺磷组。Fig. 6 The peroxidase (POD) activity under different La3+ treatmentsNote: (a) Control group; (b) Phosphorus deficiency group.
2.6 La3+对MDA含量的影响
MDA是细胞膜脂过氧化过程中的一种重要产物,常作为反映植物衰老生理和抗性生理状况的指标,其含量可用来表达细胞膜膜脂过氧化的程度,间接确定膜系统受损程度以及植物的抗逆性。因此,MDA的含量可以作为判断细胞膜结构损伤程度以及藻体受胁迫程度的重要依据[46-47]。
如图7所示,在对照组和缺P组中,不同La3+浓度对铜绿微囊藻中MDA含量变化有相似的影响,但在缺P和稀土La3+同时胁迫下,铜绿微囊藻MDA含量高于单一稀土La3+胁迫下的含量。
在缺P组中,MDA含量随稀土La3+浓度的增加表现出先减少后增加的趋势,且不同La3+浓度处理下MDA含量均随处理时间的延长而增加。在第16天,稀土La3+浓度为0.10~0.20 mg·L-1时,MDA含量低于单一缺P组(P<0.01),在稀土La3+浓度为0.20 mg·L-1时,MDA达到最低含量2.25 mg·L-1,比单一缺P组中MDA含量降低6.25%,而La3+浓度>0.20 mg·L-1时,MDA含量上升,即适量的稀土元素La3+有利于铜绿微囊藻抵御缺P胁迫。
对比CAT、POD活性和MDA含量可知,低浓度的稀土La3+能增强细胞中抗氧化酶的活性,降低MDA含量,减少缺P胁迫对细胞的损害,维持藻细胞的正常生长代谢;而高浓度的La3+严重阻碍抗氧化酶的合成,使藻类细胞的抗氧化体系无法正常运行,细胞膜脂过氧化,干扰和破坏细胞的正常功能。同时,产生并积累的大量MDA反过来抑制抗氧化酶活性[48],严重影响藻细胞的正常生命代谢水平。
2.7 生理毒理指标相关性
此外,本研究对藻的生理毒理指标进行了相关性分析。由表1可知,生物量、叶绿素a含量、可溶性蛋白含量、CAT活性、POD活性、MDA含量之间均呈显著正相关(P<0.05或P<0.01)。其中,铜绿微囊藻的生物量与CAT活性、POD活性、MDA含量之间相关系数达到0.90以上,呈现显著正相关(P<0.01),说明铜绿微囊藻的生长状况与酶活性存在一定的关联;而CAT、POD作为藻细胞内2种重要的抗氧化酶,在一定程度上,其活性对藻细胞受损程度有相似的反映;同时,铜绿微囊藻藻细胞密度对于叶绿素a和可溶性蛋白的合成有重要的影响,直接影响两者的含量。但是,可溶性糖与其他6项生理毒理学指标均呈显著负相关(P<0.05),即在实验测定时间内,在一定浓度稀土La的影响下,铜绿微囊藻藻细胞中可溶性糖含量越低,藻细胞抗氧化酶活性越高,铜绿微囊藻生长越好。
综上所述,不管是正常水体还是在缺P的贫营养水体中,轻稀土La3+对铜绿微囊藻的生态学效应在细胞层次上均表现出典型“Hormesis”现象,具体表现为:
(1)在对照组中,低浓度La3+(0.10~0.50 mg·L-1)对铜绿微囊藻的生长有一定促进作用,高浓度(>0.50 mg·L-1)La3+对铜绿微囊藻的生长有一定抑制作用。
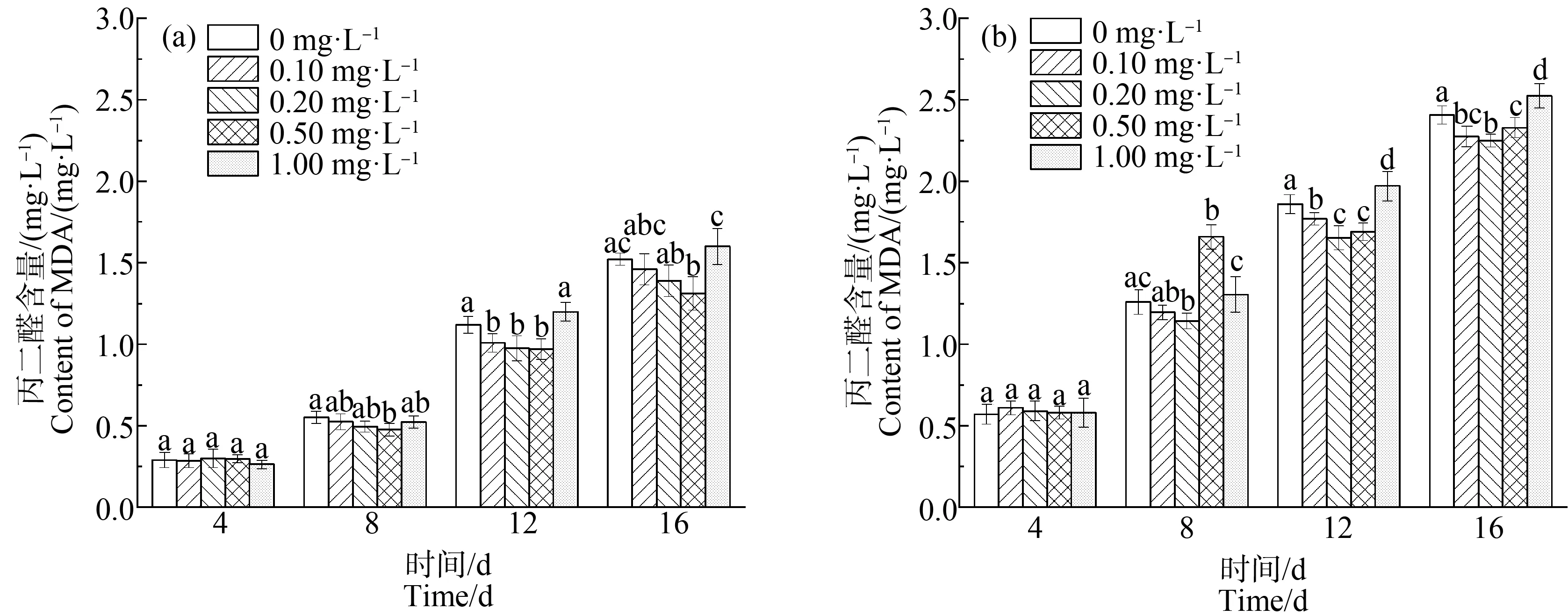
图7 不同浓度La3+处理下丙二醛(MDA)含量变化注:(a)对照组;(b)缺磷组。Fig. 7 Malondialdehyde (MDA) content under different La3+ treatmentsNote: (a) Control group; (b) Phosphorus deficiency group.
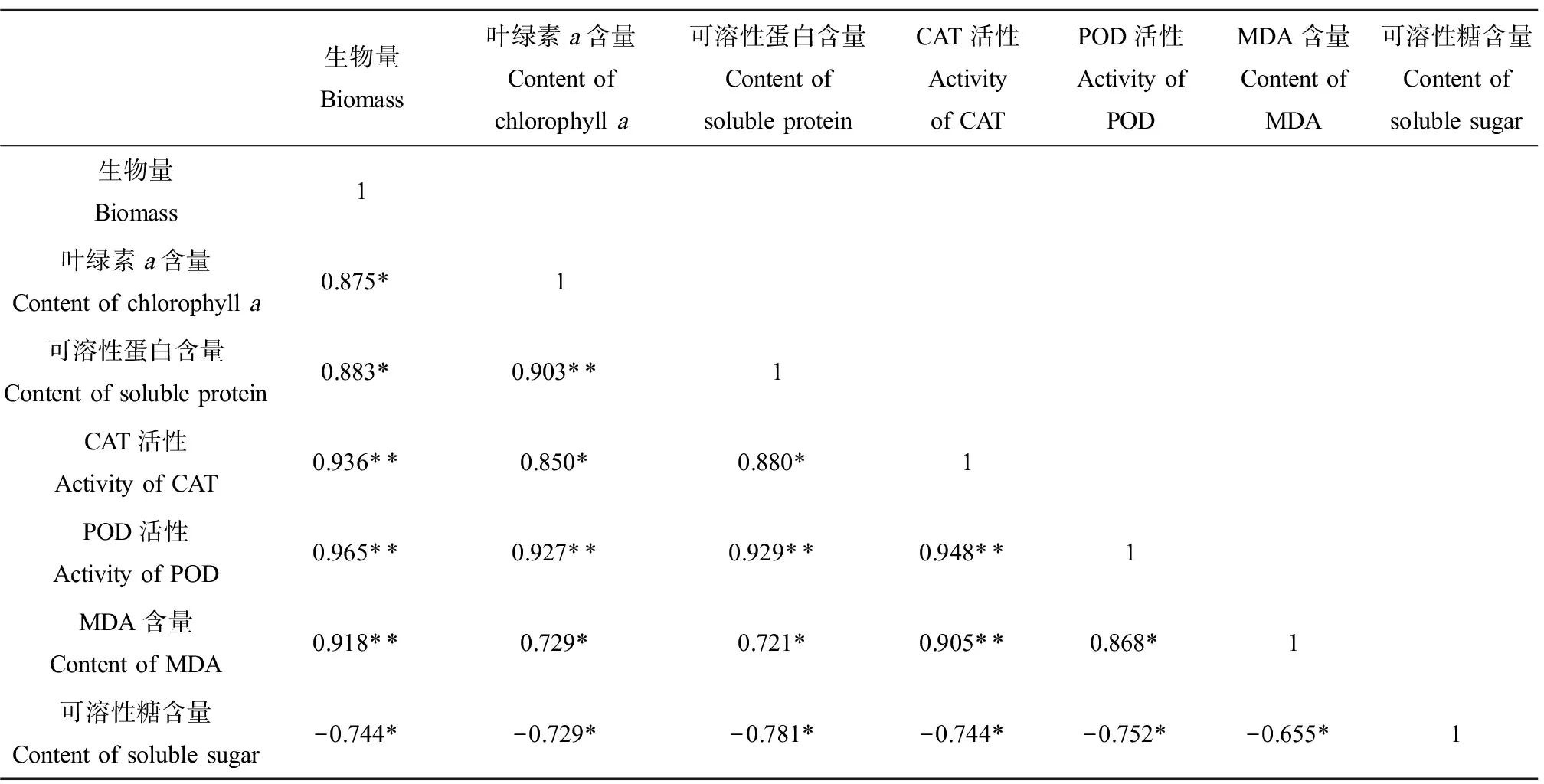
表1 生理毒理指标相关性Table 1 Correlation of physiological and toxicological indexes
(2)在缺P的胁迫下,低浓度La3+(0.10~0.20 mg·L-1)对铜绿微囊藻的生长有一定促进作用,表现为藻密度、蛋白质、叶绿素a和抗氧化酶活性的明显增加,可溶性糖含量降低,铜绿微囊藻生长状态良好,稀土La3+对藻细胞的抗氧化体系表现出一定的保护作用;高浓度La3+(0.50~1.00 mg·L-1)对铜绿微囊藻的生长有破坏作用,表现为藻密度、蛋白质、叶绿素a和抗氧化酶活性的下降,可溶性糖含量增加,抗氧化平衡遭到破坏,膜脂过氧化严重,藻类代谢处于较低水平。
(3)在缺N组中,不同浓度La3+对铜绿微囊藻的生长均表现为抑制作用,铜绿微囊藻不能正常生长。
(4)在一定时间、适宜La3+浓度内,P缺乏与否,稀土刺激生物效应同样存在,但缺P会降低铜绿微囊藻对La3+浓度和La3+处理时间的耐受能力。
本研究表明,在贫营养水体中,La对铜绿微囊藻产生的“Hormesis”现象在实际工程中有重要的应用意义。它可以为稀土在实际工程应用上的使用量提供合理依据,并为由稀土元素引发的潜在环境事故提供一定理论依据;同时,也可据此推测稀土元素La3+的输入可能引发贫营养水体发生藻类大量繁殖现象,但其更深层次的影响机制还有待进一步研究。

