土壤重金属镉对高等植物的毒性效应研究进展
熊敏先,吴迪,许向宁,郑明阳,邢涛
1. 成都理工大学生态环境学院,国家环境保护水土污染协同控制与联合修复重点实验室,成都 610059 2. 四川省生态环境科学研究院,成都610041 3. 四川省地质矿产勘查开发局四〇五地质队,成都611830
随着工业和城市化发展,人类在生产过程中产生了大量含镉(cadmium, Cd)废弃污染物。同时人们在农业生产过程中大量使用含Cd化肥农药,采用受工业污染的含Cd水源进行灌溉。此外,在矿产资源开采过程中产生的含Cd尾矿堆积,均是造成土壤中Cd含量超标的重要因素[1]。由于Cd易被植物根系所吸收且具有较高的向上迁移率,受污染土壤中的植物吸收Cd后通过食物链最终累积传递给人类,对人类健康造成危害。人类所摄取的Cd 70%来源于植物,且其半衰期长达10~30 a[2]。植物根系所吸收的Cd通过导管的蒸腾拉力向地上各部位运输并积累。土壤Cd污染还会导致植物体内Cd积累,当植物体内Cd浓度超过一定阈值,会对植物的生长发育[3-4]、生理生化过程[3,5]及作物产量和品质[6-8]产生危害,当Cd含量达到5~10 mg·g-1时,甚至导致植物死亡[9]。本文主要探讨Cd污染土壤上具有食用和其他经济价值的作物和药材类植物所受影响,未考虑Cd对藻类、菌类和地衣类等低等植物毒性效应。重点综述了上述高等植物在生长发育、生理生化、细胞超微结构及产量和品质方面所受影响,并着重介绍了Cd对植物保护酶系统、光合作用等毒性效应机理,旨在为土壤重金属Cd的环境风险与生态安全性评价提供理论依据,也为Cd污染土壤的植物萃取修复技术提供基础理论支撑。
1 Cd对植物生长发育的影响(Effects of cadmium on plant growth and development)
已有的研究表明,低浓度的Cd促进植物种子萌发和植株生长[10-12],而过量的Cd会导致植物生物量减少、生长发育迟缓,甚至萎黄坏死[13-15]。Cd对植物生长发育的影响主要体现在种子萌发(表1)、营养生长(表2)和生殖生长(表3) 3个方面。
1.1 对种子萌发的影响
Cd主要通过抑制发芽种子中淀粉酶活性、降低可溶性糖和还原糖的含量,从而减少种子萌发所需的物质和能量,最终降低种子发芽率并影响幼苗的后续生长[16]。不同种类的高等植物种子对Cd耐受性差异较大,野茼蒿(GynuracrepidioidesBenth)[17]、水稻(OryzasativaL.)[18]和豌豆(PisumsativumL.)[19]种子萌发在较低浓度的Cd胁迫下便被显著抑制,而小麦(TriticumaestivumL.)[11]对Cd胁迫的响应表现为经典的“低促高抑”现象。此外,以玉米(ZeamaysL.)[11, 20]、桑树(MorusalbaL.)[21]为例,同一种植物不同品种对Cd的耐受性也存在显著差异。而无论Cd浓度高低,均显著抑制3个芥菜品种(Pusabold、Pusabahar与Pusaagrani)的种子萌发[22](表1)。不同物种种子萌发对Cd的耐受差异较大,可能是由于单、双子叶植物种子结构不同,以及参与种子萌发相关基因在单、双子叶植物中存在功能分化。而水稻、玉米虽同为单子叶植物,但其Cd耐受性也存在显著差别,可能与不同单子叶植物间相关萌发调控机制存在差异有关。玉米、桑树等同种植物不同品种间存在Cd耐受性的差异,可能由于不同品种间相关基因存在SNP/InDel或表达量的差异。
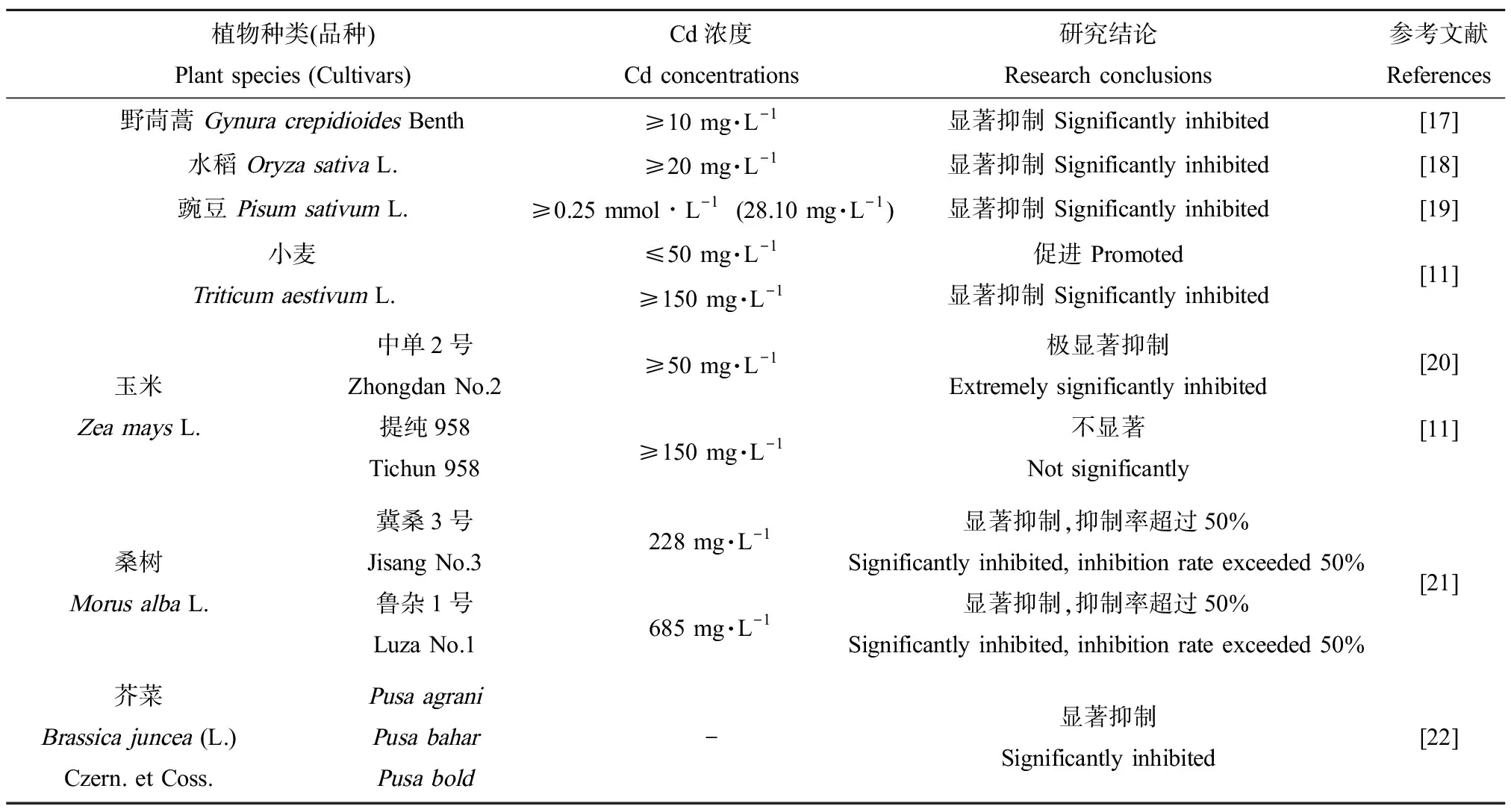
表1 Cd对高等植物种子萌发的影响Table 1 Effects of Cd on seed germination of higher plants
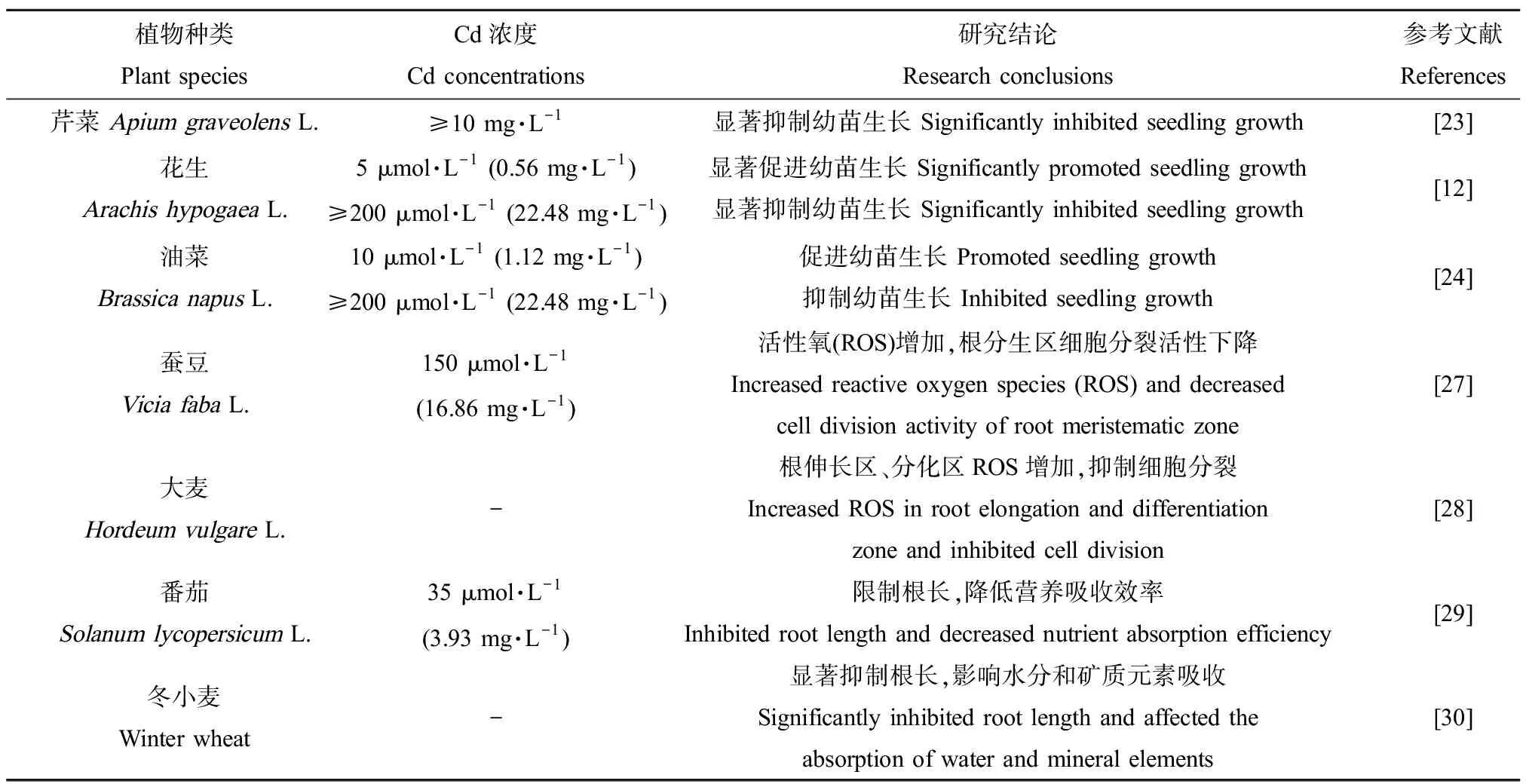
表2 Cd对高等植物营养生长的影响Table 2 Effects of Cd on vegetative growth of higher plants

表3 Cd对高等植物生殖生长的影响Table 3 Effects of Cd on reproductive growth of higher plants
1.2 对营养吸收及生长的影响
Cd对芹菜(ApiumgraveolensL.)[23]、花生(ArachishypogaeaL.)[12]和油菜(BrassicanapusL.)[24]幼苗生长的影响也主要表现为“低促高抑”现象(表2)。过量Cd胁迫不仅严重抑制植物地上部分生长,造成株高降低,还会导致其叶片出现明显的萎黄和坏死[12, 23-26]。此外,根是植物重要的营养吸收和代谢器官,也是土壤重金属Cd进入植物的第一道屏障,其生长状况和代谢强度将直接影响植物的生长状况。Cd胁迫通过引起根系中活性氧(ROS)积累,造成蚕豆(ViciafabaL.)[27]、大麦(HordeumvulgareL.)[28]等植物根尖细胞发育异常,如分生区细胞分裂活性下降及细胞伸长受抑制等。Cd胁迫还限制了番茄(SolanumlycopersicumL.)[29]、冬小麦[30]等植物根的长度,导致其根系比表面积降低,营养元素与水分吸收效率下降,最终影响植株的营养生长。
1.3 对生殖生长的影响
Cd胁迫对植物的开花和成花过程也具有毒性效应,可能是由于植物根系水分和矿质营养吸收、体内激素合成、运输及响应等生理过程以及相关酶活性受到抑制,从而直接或间接影响到开花相关基因的表达。研究表明,Cd胁迫会导致鼠尾草(SalviajaponicaThunb.)花序的数量减少[31],黄瓜(CucumissativusL.)开花延迟、花的性向转变[32],以及玉米[33]、曼陀罗(DaturastramoniumL.)花粉与胚珠发育异常[34]等。此外,Cd胁迫下油菜花粉粒受损,而胞质中Ca2+浓度升高,可能是由于Cd胁迫诱发了花粉细胞中一系列依赖于Ca2+的生理生化反应[35](表3)。
2 Cd对植物生理生化特性的影响(Effects of cadmium on plant physiological and biochemical properties)
Cd对植物生理生化特性的影响是一个较为复杂的过程,Cd胁迫导致植物细胞内ROS的积累,损伤蛋白质、核酸等生物大分子,破坏抗氧化系统,诱发膜脂过氧化伤害,诱导渗透调节物质合成,并影响光合作用(图1)。
2.1 对抗氧化系统的影响
Cd胁迫诱导植物细胞氧化应激并产生ROS,ROS的产生与清除间的动态平衡被打破是植物受Cd毒害的原因之一。植物长期进化过程中形成的ROS清除系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等抗氧化酶系统及谷胱甘肽(GSH)、抗坏血酸(AsA)等非酶系统[1](图2)。
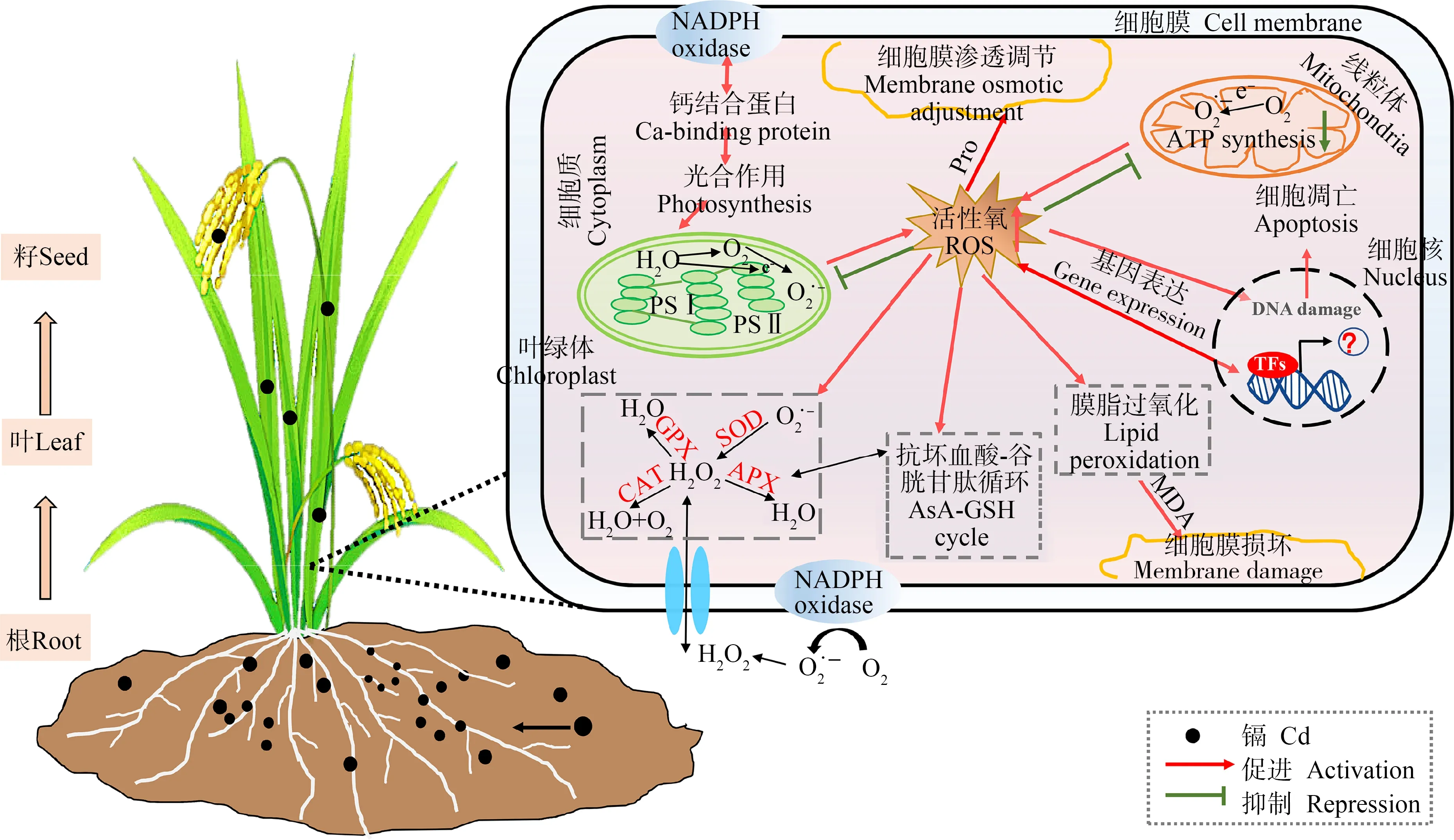
图1 Cd对高等植物生理生化特性的影响注:ROS表示活性氧;SOD表示超氧化物歧化酶;CAT表示过氧化氢酶;GPX表示谷胱甘肽过氧化物酶;APX表示抗坏血酸过氧化物酶; AsA表示抗坏血酸;GSH表示谷胱甘肽;MDA表示丙二醛;Pro表示脯氨酸;TFs表示转录因子; NADPH表示还原型烟酰胺腺嘌呤二核苷酸磷酸。Fig. 1 Effects of Cd on physiology and biochemistry of higher plantsNote: ROS stands for reactive oxygen species; SOD stands for superoxide dismutase; CAT stands for catalase; GPX stands for glutathione peroxidase; APX stands for ascorbate peroxidase; AsA stands for ascorbic acid; GSH stands for glutathione; MDA stands for malondialdehyde; Pro stands for proline; TFs stands for transcription factors; NADPH stands for reduced nicotinamide adenine dinucleotide phosphate.

图2 Cd对高等植物抗氧化系统的影响注:SOD表示超氧化物歧化酶;CAT表示过氧化氢酶;GPX表示谷胱甘肽过氧化物酶;APX表示抗坏血酸过氧化物酶;AsA表示抗坏血酸; MDHA表示单脱氢抗坏血酸;MDHAR表示单脱氢抗坏血酸还原酶;DHA表示双脱氢抗坏血酸;DHAR表示脱氢抗坏血酸还原酶;GSH表示谷胱甘肽; GSSG表示氧化型谷胱甘肽;GR表示谷胱甘肽还原酶;NADPH表示还原型烟酰胺腺嘌呤二核苷酸磷酸;NADP表示烟酰胺腺嘌呤二核苷酸磷酸。Fig. 2 Effects of Cd on antioxidative defense system of higher plantsNote: SOD stands for superoxide dismutase; CAT stands for catalase; GPX stands for glutathione peroxidase; APX stands for ascorbate peroxidase; AsA stands for ascorbic acid; MDHA stands for monodehydroascorbic acid; MDHAR stands for monodehydroascorbate reductase; DHA stands for didehydroascorbic acid; DHAR stands for dehydroascorbate reductase; GSH stands for glutathione; GSSG stands for oxidized glutathione; GR stands for glutathione reductase; NADPH stands for reduced nicotinamide adenine dinucleotide phosphate; NADP stands for nicotinamide adenine dinucleotide phosphate.
通常情况下,一定浓度的Cd胁迫过程中植物抗氧化酶活性增加,而Cd一旦超过一定浓度,抗氧化酶活性则被抑制,且呈现浓度依赖性[18, 36-37]。研究发现水蓼(PolygonumhydropiperL.)[38]的SOD活性、水稻[39]的CAT活性随Cd浓度增加呈先增后降的趋势。究其原因,一方面可能是高浓度Cd存在时,与抗氧化酶的金属结合位点竞争加剧,改变其空间结构,使酶失活;另一方面,可能ROS的产生超过其清除能力,导致酶活下降。而大豆(GlycinemaxL.)[40]在高浓度Cd胁迫下,其SOD、CAT活性却显著提高,原因在于Cd耐受相关基因的高表达。白三叶草(TrifoliumrepensL.)[41]、橡木(QuercusroburL.)[42]植株细胞中,CAT活性随Cd浓度升高均呈下降趋势,其原因不仅是CAT相关基因的表达在转录水平上降低,也可能与过量的氧自由基抑制CAT活性有关。此外,同一种类不同性向的植株抗氧化酶活性也存在差异,如南方四季杨(Populusdeltoides×nigra)在Cd处理后,雌株SOD活性变化不显著,而雄株SOD活性显著下降。其原因可能是雄株需要消耗大量的SOD来清除氧自由基,也暗示Cd对雄株的毒害作用更严重[43]。
植物大量元素S的代谢活动会受Cd胁迫的影响,而S的代谢产物之一GSH在植物应对Cd胁迫防御过程中起着重要作用。一方面GSH可形成与Cd结合的植物螯合肽,维持细胞内的离子平衡;另一方面,GSH可以通过AsA-GSH循环清除Cd诱导产生的ROS。大麦[44]根中的GSH含量随Cd浓度增加呈先增后减,且具有剂量和时间依赖性,其原因与抗氧化酶活性变化机制类似,即当Cd含量超过其代谢强度时,GSH合成相关的酶活性丧失,GSH含量下降。苎麻(Bechmerianivea(L.) Gaud)[45]、柑橘(CitrussinensisL.)[46]在Cd胁迫后,其叶中的AsA-GSH途径都被明显激活,AsA及脱氢抗坏血酸(DHA)浓度增加,从而通过AsA-GSH循环降低Cd对细胞的毒害效应。
2.2 对丙二醛和脯氨酸代谢的影响
Cd胁迫下,ROS作用于生物膜脂质发生过氧化反应,氧化终产物之一为丙二醛(MDA),MDA的积累会对细胞产生一定程度的毒害作用,同时其含量高低也反映了植物受胁迫的程度。随Cd浓度的升高,不同小麦品种“平安8”和“百农160”叶片的MDA浓度在拔节期和灌浆期均显著上升[47],与Amirjani[48]在小麦研究中的结论类似。Cd处理后的蚕豆(ViciafabaL.)幼苗根部[49]、土豆(SolanumtuberosumL.)块茎[50]中MDA含量也显著提高。脯氨酸(Pro)在细胞渗透调节中起重要作用,如清除活性氧、保护膜结构及调节氧化还原平衡等。植物通过促进合成并抑制降解体内积累的Pro缓解逆境胁迫对植物的伤害[51]。番茄幼苗[52]、萝卜(RaphanussativusL.)[53]和茶叶[54]中的Pro含量均随Cd浓度增加而显著上升(表4)。
2.3 对光合作用的影响
光合作用同化二氧化碳并合成有机物,是植物生长发育过程中物质和能量的重要来源。光合作用主要在植物叶片细胞中的叶绿体中进行,而叶绿体中组织精细且能量利用高效的捕光色素复合体和2个光反应中心(PS Ⅱ和PS Ⅰ)等诸多结构对重金属极其敏感,任一单元受影响都会成为整个光合作用的限速步骤,并最终导致植物生物量降低和作物减量减产。
Cd对植物光合作用会造成间接与直接2个方面的影响。在间接影响方面:(1)Cd会显著抑制根部Fe3+还原酶活性,使Fe2+转化量降低,而Fe2+是绝大多数高等植物根系吸收铁的主要形式,因此导致植物出现明显的缺铁症[55]。缺铁会影响叶绿素合成前体物质——卟啉环的正常合成,最终导致光合色素含量降低。同时,类囊体膜基质侧PSⅠ中铁硫蛋白也会因缺铁导致NADPH合成受限,影响后续碳同化所需物质的合成。(2)Cd能显著抑制根部硝酸还原酶活性,导致植物氮素缺乏,进而影响类囊体膜上相关光合蛋白合成[56],尤其是显著降低光反应中心Ⅱ(PS Ⅱ)的D1蛋白(半衰期仅20~30 min)损伤修复的快速周转速率,加剧植物在高光条件下因PS Ⅱ电子传递受阻导致的光抑制和光损伤[57]。(3)Cd胁迫下植物叶片气孔导度也会显著降低,造成叶绿体基质中光合固碳底物CO2缺乏,降低整体光合效率[58-60]。
Cd对叶绿体直接影响与Cd浓度和胁迫持续时间有关。在高浓度和长时间Cd胁迫下,叶绿体会因此解体,类囊体破裂并产生数量与体积逐渐增长的质体小球和淀粉粒,光合功能完全丧失[61]。在相对较低浓度和短期Cd胁迫下,叶绿体中光合电子传递链上各单元均会受到影响。本文以叶绿体基质到类囊体膜上电子传递链顺序综述Cd对叶绿体光合作用的直接影响(图3)。
(1)叶绿体基质
叶绿体基质侧的碳同化过程首先受到Cd胁迫影响。Ahammed等[62]的研究表明,Cd首先破坏光合电子传递链下游的碳还原过程,再影响上游各光合电子传递单元,最终降低整个光合作用效率。其原因可能是碳还原位于叶绿体基质中,Cd跨叶绿体膜后优先影响基质中碳还原过程相关酶与底物,随后再逐渐影响类囊体膜上的光合构件。Krupa等[63]的研究也表明,Cd胁迫下PSⅡ光化学效率降低可能与卡尔文循环(Calvin cycle)中碳还原过程对ATP和NADPH利用受限有关。
(2)类囊体膜
光反应类囊体膜结构因Cd胁迫而发生改变。Moussa和El-Gamal[64]研究发现,Cd胁迫会导致类囊体膜垛叠程度降低,造成类囊体膨胀。类囊体膜上各主要光合单元,如PS Ⅱ、细胞色素复合体Cytb/f、PS Ⅰ和ATP合成酶相对位置因而受到影响,使得各单元之间的光合电子高效传递速率降低。
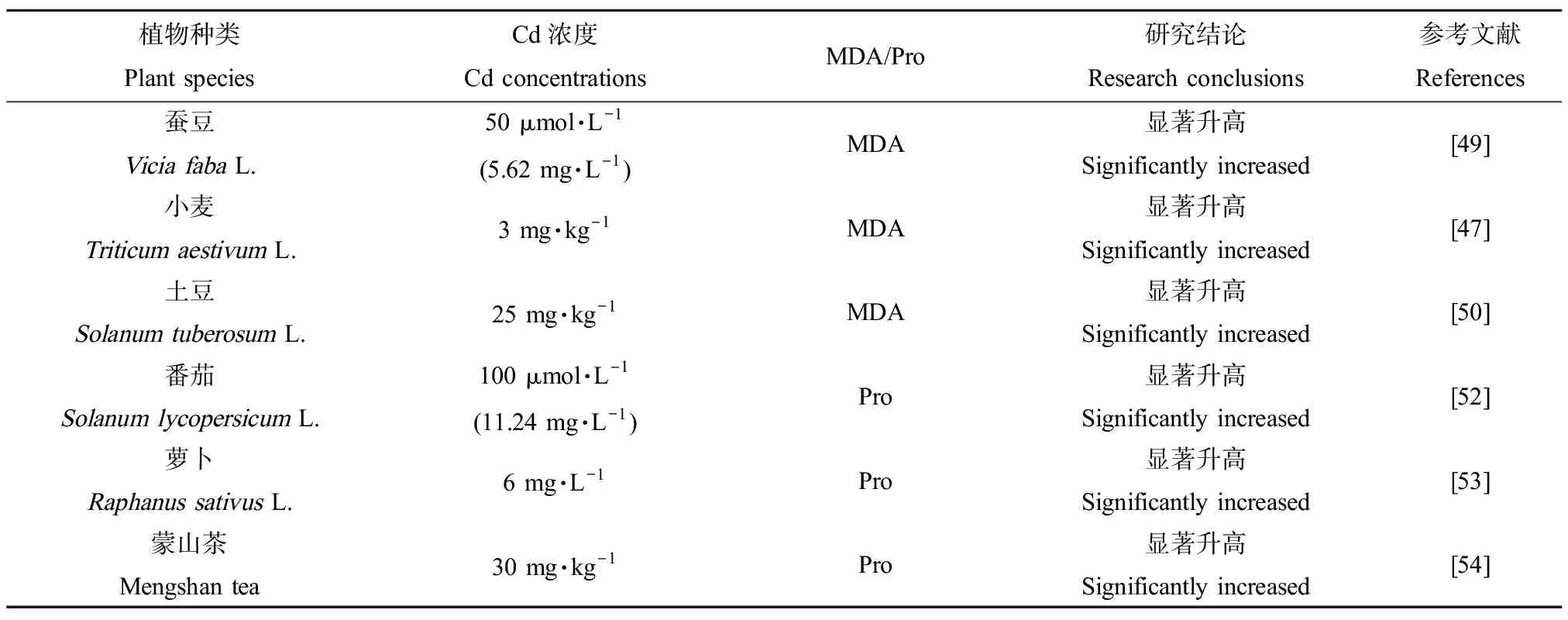
表4 Cd对高等植物MDA和Pro含量的影响Table 4 Effects of Cd on the content of MDA and Pro in higher plants
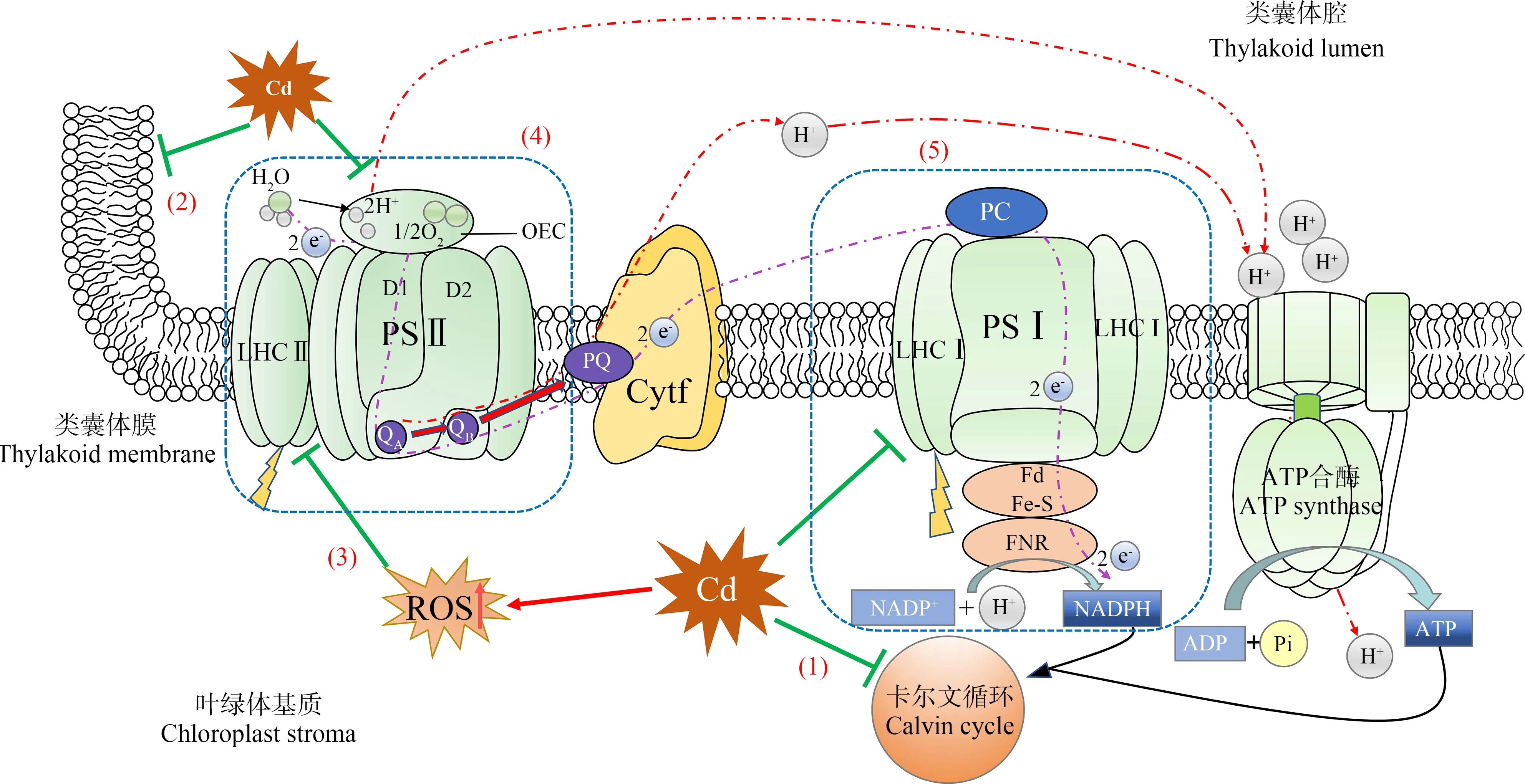
图3 Cd对高等植物光合作用的影响注:绿色平箭头表示抑制;红色实线箭头表示促进;PSⅡ表示光系统Ⅱ;LHCⅡ表示捕光复合体Ⅱ;OEC表示光合放氧复合体;PQ表示质体醌; Cytf表示细胞色素;PC表示质体蓝素;PSⅠ表示光系统Ⅰ;LHCⅠ表示捕光复合体Ⅰ;Fd表示铁氧还蛋白;FNR表示NADP还原酶; ADP表示二磷酸腺苷;ATP表示腺嘌呤核苷三磷酸;(1)Cd对卡尔文循环的影响;(2)Cd对类囊体膜垛叠的影响;(3)ROS对光合色素的影响; (4)Cd对PSⅡ的影响;(5)Cd对PSⅠ的影响。Fig. 3 Effects of Cd on photosynthesis of higher plantsNote: The green flat arrow indicates inhibition; the red solid arrow indicates promotion; PSⅡ stands for photosystem Ⅱ; LHCⅡ stands for light-harvesting complex Ⅱ; OEC stands for photosynthetic oxygen-evolving complex; PQ stands for plastoquinone; Cytf stands for cytochrome; PC stands for plastocyanin; PSⅠ stands for photosystem Ⅰ; LHCⅠ stands for light-harvesting complex Ⅰ; Fd stands for ferredoxin; FNR stands for NADP reductase; ADP stands for adenosine diphosphate; ATP stands for adenosine triphosphate; (1) The influence of Cd on Calvin cycle; (2) The influence of Cd on thylakoid membrane stacking; (3) The influence of ROS on photosynthetic pigment; (4) The influence of Cd on PSⅡ; (5) The influence of Cd on PSⅠ.
(3)光合色素
类囊体膜上光合色素含量受Cd胁迫影响而降低,使植物叶片出现明显的萎黄病。其主要有3个方面原因。①叶绿素合成代谢因Cd胁迫受阻[62],如Cd会干扰还原酶蛋白上的硫代硫酸位点,抑制叶绿素生物合成相关酶活性[65];②Cd胁迫下抗氧化酶如SOD和CAT等活性降低[4, 66],造成叶绿体中ROS含量升高,直接破坏相关光合色素,甚至导致捕光色素复合体(LHCⅡ)三聚物结构解体[67];③Cd2+会与叶绿素分子中的Mg2+竞争活性位点,造成脱镁叶绿素含量增加[68]。Cd胁迫下光合色素含量降低已被很多文献证实,Kapoor等[69]的研究表明,0.6 mmolL-1Cd胁迫下,芥菜总叶绿素含量由对照组26.75 mg·g-1降低至13.38 mg·g-1。其中叶绿素a(Chla)含量由16.78 mg·g-1降低至7.1 mg·g-1,而叶绿素b(Chlb)含量则由7.54 mg·g-1显著降低至2.24 mg·g-1。An等[4]研究发现,经5 mg·kg-1Cd土培后,棉花叶片中Chla、Chlb和类胡萝卜素含量分别降低了29%、30%和31%。崔振等[70]研究也发现柽柳和银水牛果2种植物叶绿素合成受Cd胁迫抑制,其总叶绿素、Chla和Chlb含量也随Cd浓度增加而显著降低。
(4)PSⅡ反应中心
PSⅡ反应中心活性也会因Cd胁迫而受到显著抑制,并且其电子传递过程相对于PSⅠ更容易受到Cd胁迫影响[71]。其原因在于PSⅡ反应中心复合物两侧的电子供体和受体都是Cd攻击目标,Cd胁迫使其电子传递速率受限,最终导致PSⅡ反应中心失活[71-72]。如Cd2+会竞争PSⅡ电子供体侧光合放氧复合体(OEC)中Mn4Ca簇上Ca2+结合位点,造成光合放氧速率降低,底物H2O无法有效供应PSⅡ高效运转所需电子[73]。而PSⅡ电子受体侧醌受体QB也会因Cd胁迫,降低电子从QA到QB的速率[73]。同时,前述Cd胁迫下PSⅡ反应中心D1蛋白快速损伤修复速率可能受限,PSⅡ反应中心本身电子传递速率亦降低。以上原因导致Cd胁迫下PSⅡ电子传递受阻,光化学效率显著降低。张栋栋等[74]研究发现苍耳叶片光化学效率(Fv/Fm)、光化学淬灭系数(qP)和电子传递速率(ETR)均随Cd浓度升高而显著降低,在刺苋中也发现类似趋势[58]。PSⅡ反应中心电子传递速率降低,造成植物在高光条件下吸收的光能不能有效以光化学淬灭形式耗散,被迫提高其非光学淬灭(NPQ)能力耗散过剩光能。Qu等[75]研究发现在Cd胁迫下玉米幼苗叶片NPQ显著增加了58.9%,而另一项研究发现苏里南维罗蔻木叶片经60 mg·L-1Cd处理后,其NPQ值显著增加了66.9%[76]。
(5)PSⅠ反应中心
PS Ⅰ相关光合功能也会受Cd胁迫影响。尽管大部分情况下植物的PS Ⅱ相对较为敏感,但仍有少数植物被报道其PS Ⅰ相对更易受Cd胁迫影响[77]。与PS Ⅱ相似,Cd会显著降低PS Ⅰ捕光色素复合体LHC Ⅰ中天线色素含量,使其光能捕获效率降低[77]。同时,PS Ⅰ还原侧电子供体也会因Cd胁迫而受抑制,造成PS Ⅰ整体光化学效率降低。Wodala等[78]的研究表明,Cd胁迫会降低PS Ⅰ光化学效率以及相关光系统间电子传递链中电子数量。此外,Cd胁迫下类囊体膜上产生的ROS也会直接攻击PS Ⅰ上铁氧还蛋白的Fe-S中心,降低类囊体基质侧NADPH产量[79]。
3 对细胞超微结构的影响(Effects of cadmium on cell ultrastructure)
在低浓度Cd胁迫下,植物可通过细胞壁阻隔、细胞膜结合钝化和液泡区隔化等方式抵御Cd的毒害[80]。但当Cd浓度超过阈值时,就会对植物细胞超微结构造成损伤。研究表明,Cd处理会导致芹菜[81]、玉米[82]叶片细胞壁变形,凤仙花(ImpatiensbalsaminaL.)[83]叶片细胞质膜破坏和细胞质收缩造
成细胞内空间减少,桃树(AmygdaluspersicaL.)根尖细胞线粒体脊突凌乱、双层膜消失[84],以及金丝草(Pogonatherumcrinitum(Thunb.) Kunth)[85]、烟草(NicotianatabacumL.)[86]细胞叶绿体受损致使基质外流,且具有剂量依赖性,随着Cd浓度的升高,细胞受损程度和空泡化程度进一步加剧,甚至造成线粒体、叶绿体和细胞核等细胞器皆破裂消失。此外,Cd胁迫还会引起蚕豆[49]、番茄[87]根细胞的染色体畸变,有丝分裂异常等(表5)。由此可见,Cd对植物细胞的毒害作用不只是破坏其单一的细胞器或膜结构,而是对其膜结构和非膜结构都有不同程度的损害。且不同植物细胞对Cd的耐受程度存在差异,因而最终表现出的毒性症状也有所不同。
4 Cd对植物生物量和产量的影响(Effects of cadmium on plant biomass and yield)
4.1 对植物生物量的影响
土壤重金属Cd造成植物细胞内相关生理生化过程紊乱,如光合速率降低、营养吸收减少等,使可供植物正常生长的物质和能量减少,导致植物生物量显著降低。当施加外源Cd时,小报春(PrimulaforbesiiFranch.)[88]、印度芥菜(Brassicajuncea)[89]生物量变化表现为“低促高抑”现象,而小麦[90]、水稻[91]和草莓(Fragaria×ananassaDuch.)[92]等生物量均随Cd浓度增大而显著降低(表6)。不同植物对Cd的敏感程度存在差异,可能与植物体内基因表达和内源激素水平差异有关,但总体而言,Cd会导致植物生物量降低。
4.2 对植物产量的影响
一般情况下,低浓度Cd会刺激植物生长,具有一定的增产作用,但浓度过高会加剧植物受毒害程度,导致作物减产。水稻在低浓度Cd时产量增加,较高浓度时产量下降[93-94]。可能是低浓度Cd激活其逆境响应作用,提高生理生化代谢活性并促进植株生长。另外,小麦[90]、甘薯(Dioscoreaesculenta(Lour.) Burkill)[95]、草莓[92]产量随着Cd浓度增加而减少。而油菜在30 mg·kg-1Cd浓度处理后,其产量几乎不受影响,表明油菜对一定浓度Cd胁迫具有耐受性[96](表7)。
5 Cd对作物营养品质的影响(Effects of cadmium on crop nutritional quality)
相较于生理生化影响,Cd胁迫对作物营养品质影响的相关报道较少。作物营养品质可表现为以下4个方面:(1)粮食作物籽粒中氨基酸和蛋白质含量;(2)蔬菜、水果的碳水化合物含量;(3)油料作物的脂肪酸含量及含油量;(4)中药有效成分含量[80]。
5.1 对粮食作物籽粒氨基酸和蛋白质含量的影响
Cd污染土壤中生长的作物对氮素的吸收和同化效率受到影响,导致其体内相关的氨基酸和蛋白质含量发生变化。作物的氨基酸含量,尤其是必需氨基酸赖氨酸(Lys)的含量,是评估作物营养品质的重要指标。Cd处理后的玉米未成熟谷粒中,2种直接参与Lys生物合成的酶——天冬氨酸激酶(AK)和二氢二吡啶甲酸合酶(DHDPS)活性增加,Lys含量增多[97]。而在玉米成熟谷粒中,Cd处理组Lys含量没有明显变化,可能是由于AK对Lys反馈抑制的高敏感性抵消了AK和DHDPS两者比活性的增加[97]。然而,Cd胁迫的小麦氨基酸含量降低,其中Lys尤为显著[98],可能是Cd胁迫抑制了小麦Lys合成相关的酶。蛋白质的基本组成单位是氨基酸,Cd胁迫后氨基酸含量的变化也会导致相应蛋白质含量发生改变。小麦[99]、玉米[100]籽粒中蛋白质含量随Cd浓度的增加先升高后降低[99],而甘薯[95]和莲藕(NelumbonuciferaGaertn.)[101]中的蛋白质含量随Cd浓度增加呈显著降低趋势。

表5 Cd对高等植物超微结构的影响Table 5 Effects of Cd on ultrastructure of higher plants

表6 Cd对高等植物生物量的影响Table 6 Effects of Cd on biomass of higher plants

表7 Cd对高等植物产量的影响Table 7 Effects of Cd on yield of higher plants
5.2 对蔬菜碳水化合物含量的影响
Cd胁迫会影响作物和果实中可溶性糖及淀粉含量,从而影响其口感和品质[92]。研究发现,Cd胁迫下莴苣(LactucasativaL.)[102]、甘薯[95]中的葡萄糖和果糖含量呈“低促高抑”现象。莴苣[102]、马铃薯[103]的蔗糖含量随Cd浓度升高均表现为显著增加。莴苣叶片中的淀粉含量无明显变化[102],马铃薯根、茎和叶中的淀粉积累则受抑制[103],而甘薯块根中淀粉含量随Cd浓度的增加呈先升后降的趋势,但变化不显著[95]。此外,Cd胁迫显著降低了小麦籽粒中总淀粉和支链淀粉含量,且胁迫浓度越高,淀粉含量下降幅度越大,但其直链淀粉含量和直链/支链淀粉的比例不受影响[98]。此外,作物中淀粉崩解值小、消减值大是其食味性不良的表现,而高浓度Cd会降低淀粉谱(RVA)崩解值,增加其消减值,从而导致作物品质下降[104]。
5.3 对油料作物脂肪酸含量与含油量的影响
作物中脂肪酸的组成和含量能够体现作物的品质和营养价值。花生油脂脂肪酸中的油酸/亚油酸(O/L)比值是花生耐储存的指标,其较高的比值可以延长花生的储存时间,使其不易变质。研究发现,Cd胁迫显著增加了豫花15和XB023这2个花生品种亚油酸含量,降低其O/L值,导致其可储存时间降低[105]。棕榈油酸是一种具有重要营养和医药价值的单不饱和脂肪酸,但其在油料作物中的含量极低,而棉籽油中含有的大量棕榈酸是合成该物质的前体。随Cd处理浓度的升高,棉花(AnemonevitifoliaBuch.)的棉籽油中棕榈酸含量显著降低[106]。除了脂肪酸含量的变化,一些油料作物的含油量也会受影响,如玉米[100]、花生[107]籽粒中的脂肪含量随Cd浓度的升高呈先升高后降低的趋势,而Cd处理后的橄榄果实的油含量则显著降低[108]。由此可见,Cd对不同作物的影响机制有所差别,但整体而言,Cd胁迫都会导致作物品质下降。
5.4 对中草药品质的影响
土壤重金属Cd污染一方面会导致部分中药材中Cd含量超标,影响药材的质量与药效,并且服用后会导致Cd在人体积累,而半衰期长达10~30 a的Cd会对人体造成持续性危害。以我国国家食品重金属允许量标准(Cd<0.2 mg·kg-1)为参考,雷泞菲等[109]测定了常用6种中草药中的重金属Cd含量,发现黄芪(Astragalusmembranaeus)超标57%,其次是板蓝根(IsatistinctoriaL.)和地黄(Rehmanniaglutinosa(Gaetn.) Libosch.),分别超标26.5%和17%。而丹参(SalviamiltiorrhizaBge.)、红花(CarthamustinctoriusL.)中的Cd含量超标更甚,在Cd含量25~100 mg·kg-1的土壤条件下,丹参根系和叶片中Cd含量分别为8.83 mg·kg-1和7.76 mg·kg-1[110],红花芽中Cd含量高达148.6~277.2 mg·kg-1[111]。
另一方面,Cd会干扰中药材细胞中次生代谢产物的积累,进而影响到中药材的药效与品质。皂苷是三七(Panaxnotoginseng(Burkill) F. H. Chen ex C. H.)主要活性成分,也是人参属植物中广泛存在的重要次生代谢产物。不同浓度Cd处理对皂苷单体及总皂苷含量均有不同程度的影响,其总体趋势表现为显著抑制作用[112]。经Cd处理后的野菊花(ChrysanthemumindicumL.)中活性成分蒙花苷、总黄酮含量均显著下降,表明Cd污染会降低野菊花药材品质[113]。根茎是川芎(LigusticumchuanxiongHort.)主要的药用部位,其药用成分主要包括阿魏酸、川芎嗪和藁本内酯等[114]。Cd处理显著降低了川芎根茎中不同次生代谢产物的含量,其中阿魏酸、川芎嗪和藁本内酯的含量分别降低了36%、25.85%和10.60%[114]。此外,Cd胁迫下丹参(SalviamiltiorrhizaBunge)根系脂溶性丹参酮类化合物二氢丹参酮、丹参酮和隐丹参酮含量均显著降低,且叶片中水溶性酚酸类化合物合成关键酶苯丙氨酸解氨酶(PAL)和酪氨酸氨基转移酶(TAT)的活性显著降低[110]。因此重金属Cd会降低药材的有效药用成分积累,使其药用品质下降。然而,有研究发现适当浓度Cd能够促进黄花蒿(ArtemisiaannuaL.)青蒿素的合成,其原因在于Cd能够激活黄花蒿MAPK基因,而MAPK级联途径可能在Cd影响黄花蒿次生代谢产物合成中承担着将细胞外Cd信号传递到细胞内的作用,从而使青蒿素合成途径关键酶基因表达量上调以响应Cd刺激[115]。
6 展望(Prospects)
目前,有关土壤重金属Cd对植物生长发育、细胞超微结构、生理生化代谢以及作物产量和品质等方面的研究已经取得较大进展,但仍有大量的科学问题有待深入研究探讨,主要有以下4个层面的切入点。
(1)微观层面,植物生长发育、生理生化响应和细胞超微结构变化等都与其基因表达水平有较大的相关性。深入研究重金属Cd胁迫下相关基因表达,并采用以基因组学、转录组学、蛋白质组学和代谢组学等不同层次组学为基础的系统生物学研究方法,建立从基因到蛋白质最终到如何影响植物生理生化和代谢响应的网络关系,将有助于全面深入了解重金属Cd对植物的毒害效应及其分子机理。
(2)宏观层面,目前的研究多聚焦于重金属Cd对单种植物的毒害效应,而其对种群、群落甚至整个生态系统水平效应的研究相对较少。自然条件下,不同种类的植物在某生态系统下共存,Cd胁迫下超累积植物的存在是否能影响Cd对周围植物毒害效应,优势种群和劣势种群在整个群落中如何演替,以及某区域生态功能是否因Cd胁迫而受影响及其影响程度等都需要进一步研究。
(3)时间层面,现有的Cd胁迫对植物毒害效应的研究多集中于短期实验,而长时间尺度下毒害作用是否会逐代积累的相关研究较少。此外,植物在长期进化过程中可能会对Cd胁迫进化出一系列防御机制,植物是否能逐代进化出耗能更少、效率更高的防御机制仍有待深入研究。
(4)空间层面,我国土壤类型繁多,不同区域的土壤成土过程受成土母岩、地形和气候等因素影响,使其土壤重金属背景值差异较大,并且人为污染会加剧不同区域中各重金属相对含量。不同区域土壤中其他重金属如铅(Pb)、汞(Hg)和铬(Cr)等含量有较大差异,是否对Cd的毒害作用产生不同程度的协同或拮抗效应也需要进一步深入研究。此外,不同区域土壤中微生物群落组成有较大差异,土壤微生物与植物根际相互作用对缓解Cd对植物毒害作用的程度也存在差异。因此,研究不同区域Cd胁迫下,土壤微生物与植物根际微域相互作用关系,将有助于我们更全面系统地了解Cd对植物的毒害效应。

