土壤镉污染的人体健康风险评价研究:生物有效性与毒性效应
马娇阳,保欣晨,王坤,王成尘,崔道雷,张梦妍,向萍,*
1. 西南林业大学生态与环境学院/环境修复与健康研究院,昆明 650224 2. 西南林业大学环境污染与食品安全及人体健康云南省创新团队,昆明 650224
镉(cadmium, Cd)是广泛存在于自然环境中的一种有毒金属元素,国际癌症研究机构将Cd列为Ⅰ类致癌物。2014年,在我国环境保护部和国土资源部联合发布的中国土壤污染现状报告中显示,我国约7%的土壤Cd含量超出了规定限值,点位超标率位居所有金属和类金属首位[1]。在我国,超过11个省份存在土壤Cd含量超标的现象,其中湖南省株洲市表层土壤Cd含量高达6 mg·kg-1[2],已远超出《土壤环境质量 农用地土壤污染风险管控标准》(GB 15618—2018)[3]所规定的限值(0.3 mg·kg-1)。偶然摄入污染土壤是人们(尤其是幼童)接触Cd的主要途径之一,而经口摄入是导致偶然摄入土壤的主要原因,人体暴露Cd后会诱发胃肠道以及肝脏肾脏等一系列疾病[4-5]。近年来,Cd污染土壤对人群经口暴露诱发的人体健康危害受到了社会各界的广泛关注[6-7]。但大量实验表明并非土壤中所有Cd都能被肠道吸收并对人体内部器官产生毒性效应[8]。因此,基于土壤中的总Cd含量进行的健康风险评估可能会高估其真实风险[9-10]。人们经口摄入重金属的生物有效性(bioavailability)是指穿过肠道上皮细胞并到达人体血液循环系统的量与总量的比值[11],包括绝对生物有效性(absolute bioavailability, ABA)和相对生物有效性(relative bioavailability, RBA)。重金属ABA是指通过经口摄入途径实际被吸收并进入人体循环系统的部分所占的百分比,但因其分析过程复杂,故在健康风险评价中RBA得到广泛使用,即土壤与毒性研究中参照物质(重金属可溶盐)暴露后血液或组织所积累的重金属含量的比值[12]。小鼠、兔子、狗、猪、牛和灵长类动物已被用于土壤无机污染物RBA的研究中[13],但是,动物模型存在成本高、周期长、不易操作以及伦理道德等问题,很难推广应用。近年来,研究者尝试建立体外模型来测定重金属的生物可给性,即通过消化液从土壤基质释放到胃肠液中的污染物量与土壤污染物总量的比值,表示了人体肠道吸收污染物的最大量,以期建立与体内动物实验的相关性[14]。目前,体外胃肠模拟方法得到发展和应用,主要包括SBRC(solubility bioavailability research consortium)、IVG(invitrogastrointestinal)、DIN(Deutsches Institut für Normung e.V.)、PBET(physiologically based extraction test)和UBM(unified BARGE method)等[15]。但是体外胃肠模拟方法缺少人体消化系统细胞组分,很难在体外再现胃肠的生理功能和动态过程[16]。为此,借鉴药理学的研究策略,人体肠道上皮细胞模型(如Caco-2、Caco-2/HT29-MTX和Caco-2/HT29-MTX/Raji B等二维或三维模型)被广泛用于污染物人体生物有效性的研究[17]。因此,生物有效态Cd是否一定对人体产生毒害效应以及诱发什么健康危害,近年来成为大家关注的前沿热点[18]。然而在土壤Cd生物有效性以及其所诱发的人体健康的研究中,利用体外细胞模型仍然鲜见报道。鉴于此,理清土壤Cd总含量-生物有效性Cd含量-生物有效态Cd毒性效应之间的剂量效应关系,建立基于Cd生物有效性和毒性效应为基础的人体健康风险评估模型,将更为准确地评估其健康风险。
此外,多种体内外模型被用于土壤Cd生物有效性的研究,其生物有效性影响因素也千差万别,如土壤理化性质(pH、氧化还原电位和有机质)、动物物种差异及细胞模型功能化程度和食物组分等[19]。针对该问题,应弄清不同模型下的影响因素,探明主控因子,为后面针对性调控潜在健康风险提供更为有效的策略[20]。鉴于此,笔者广泛查阅文献,系统分析比较测定土壤Cd生物有效性的体内外方法优缺点,探讨了影响其生物有效性的因素和主控因子,并分析了生物有效态Cd与毒性效应的关系,结果将为准确评估Cd污染土壤人体健康风险和有效调控提供重要参考。
1 我国土壤镉污染现状(Current situation of soil cadmium pollution in China)
由于各种地质作用和人为活动,以及重金属在土壤中难以自然降解的特性,近年来,土壤重金属污染问题尤为突出。土壤中Cd的来源分为自然来源和人为来源,前者来源于含Cd的矿物或岩石风化释放到土壤中,构成土壤中Cd的背景值[21]。人为来源,即由于化工、采矿、制造业和电子厂等工业的快速发展,以及污水、大气沉降和化肥的不合理运用等造成Cd排放[22]。因此,源于我国土壤Cd背景值以及人为干扰,使土壤Cd含量超标,因此存在潜在的人体健康风险。Duan等[23]分析了我国不同地区土壤Cd含量,发现土壤Cd污染程度具有明显的地域差异,不同行政区土壤Cd浓度在0.19~27.98 mg·kg-1之间,分布不均匀;其中,海南省和山西省土壤Cd浓度分别为0.19 mg·kg-1和0.28 mg·kg-1,未超出土壤污染风险管控值(0.3 mg·kg-1)[3],而云南省、广西省和辽宁省污染较为严重,土壤Cd浓度分别为27.98、17.48和12.06 mg·kg-1,超出土壤限值的93倍、58倍和40倍,因此我国Cd污染土壤主要分布在矿区和人口密集的行政区。此外,经口摄入土壤重金属Cd可通过公式(1)进行摄入暴露剂量评估,依据暴露剂量,非致癌风险可通过公式(2)计算危害熵(hazard quotient, HQ)来表征[24]。健康风险评估参数[24-26]以及各地区的风险表征如表1所示,且呈现出西南地区>华南地区>华中地区>东北地区>华东地区>西北地区>华北地区的趋势。然而,包括HQ模型在内的现有健康风险评估模型均基于污染物总量和预估的人均摄入量进行数学计算,而该模型易受个体差异特征影响[27],因此,越来越多研究者指出,建立基于生物模型的土壤Cd人体生物有效性的评估方式才能较为准确评价其健康风险[15]。如何准确评估Cd污染土壤的人体健康风险成为民众关注的热点和各国研究人员重点开展的前沿研究。
(1)
(2)
2 基于土壤生物有效态镉的健康风险评价模型(Health risk assessment model based on bioavailable cadmium in soil)
2.1 体内模型
为了评估土壤中Cd的人体健康风险,各国相继制定了评价标准和重金属的限量指标,然而限量值多基于土壤中重金属总含量。随着研究的不断深入,越来越多的研究发现,以土壤Cd总含量作为评价标准往往高估其人体健康风险[9-10]。鉴于此,多国科学家指出,以人体实际摄入量(生物有效性部分, bioavailable fraction)作为评价指标更为科学合理[15]。体内实验,即在完整且存活的生物体内(通常包括动物等)进行的实验研究,因此,为了准确评估土壤重金属的人体生物有效性,多种动物模型被广泛应用[28],如猪和小鼠已被成功用于土壤中Cd的RBA测定,猪模型在胃肠道、骨骼发育、生理年龄、体质量和矿物质代谢等生理、形态方面与人类相似,被认为是目前最理想的动物模型[29-30],因此猪模型已被广泛用于矿区、冶炼厂和危险废弃物等污染场地土壤Cd生物有效性的测定[31-32],然而猪在实验室不易操作,并且饲养条件苛刻、实验成本高,使得一般的实验室难以承受。与猪模型相比,小鼠体型小、易于操作,更加适用于大样本的研究[29],另外,小鼠肠道在组织结构、形态及生理功能上也与人类肠道相似[33]。除猪和小鼠模型外,灵长类动物也被应用于土壤污染物生物有效性的研究,如Roberts等[34]采用食蟹猴研究污染土壤中砷的人体生物有效性,并证实使用灵长类动物得到的结果更具有可信性。但由于该模型的花费高且涉及伦理问题,很难广泛应用。综上,小鼠仍然是目前使用最多的动物模型。此外,在已有的研究中可以发现,不同动物的土壤暴露方式多样,目前主要有以下4种:单次灌胃、重复灌胃、日常重复喂养和自由获取食物[29],前3种方式是为了测定动物禁食状态下的RBA。体内研究中给出的剂量主要是模拟人体(尤为幼童)日常和偶然摄入含Cd污染土壤的剂量[35]。基于目前研究土壤Cd的生物有效性文献报道可知,研究利用自由获取方式较多,旨在模拟人体日常摄入土壤的状况[10,28,36-37]。
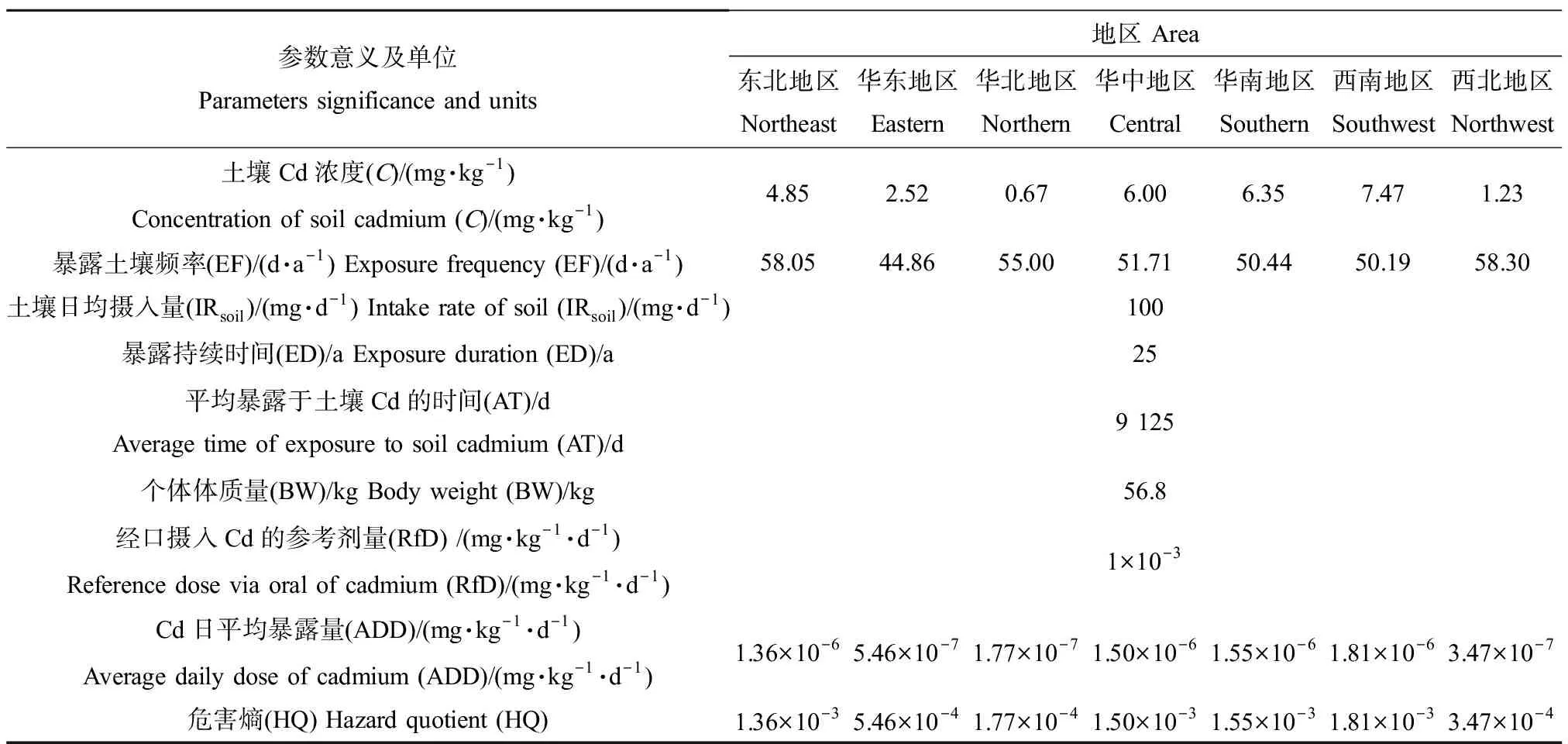
表1 健康风险评估参数及不同地区风险表征Table 1 Parameters for health risk assessment and risk characterization in different areas
土壤Cd体内生物有效性测试终点的选择也有较大差异,目前研究中,测定终点主要有以下3种:组织器官、尿液和血液[29],研究土壤Cd生物有效性报道[10,28,36],以肾脏和肝脏作为靶器官的较多,针对不同类型土壤,小鼠肾脏(图1(a))、肝脏(图1(b))、肾脏+肝脏(图1(c))所测定的Cd生物有效性如图1所示,以单一靶器官为测定终点时,小鼠肾脏的Cd生物有效性相对较高,且不同的类型土壤呈现矿区>农业>冶炼厂>住宅区的趋势。而由于生物体内的金属硫蛋白表达不一致性,影响到肾脏或肝脏Cd的积累量,采用肾脏+肝脏测定RBA会减弱金属硫蛋白诱导性带来的影响[36]。因此,人体Cd生物有效性会受不同类型土壤以及不同靶器官的影响。此外,包括肾脏(图1(d))、肝脏(图1(e))、肾脏+肝脏(图1(f))等不同小鼠靶器官的土壤Cd的RBA随Cd总含量呈现先降低后升高的趋势,同样,汇集目前所有土壤Cd的RBA研究也发现此趋势(图1(g))。此外,研究表明,血液是测定Cd含量最有效的靶组织[38],并且可在不处死实验动物的条件下,随人体不同暴露时间进行多次血样分析测定。然而血液中Cd生物有效性的报道较少,在今后的研究中可关注该方面的研究,以寻找出更加适合测定土壤Cd生物有效性的靶组织/器官。可见,尽管不同污染场地或不同动物模型下土壤Cd的生物有效性差别较大(图1(g)),但可以明确看出,Cd很难全部进入体内,传统以土壤中Cd总含量进行的健康风险评估会远远高估其毒性风险,但总体来说,目前利用动物模型评价土壤Cd对人体生物有效性的报道较少,因此需进一步利用不同动物模型来研究不同污染土壤重金属生物有效性,以建立更为科学合理的评估模型或方法。

图1 利用小鼠模型测定不同土壤类型Cd生物有效性及与总量关系图注:(a)、(d) 测定终点为肾脏;(b)、(e) 测定终点为肝脏;(c)、(f) 测定终点为肾脏+肝脏;(g) 测定终点为所有研究土壤Cd样点。Fig. 1 The relationship between total and bioavailable Cd in different types of soils using mice modelsNote: The endpoints of (a) and (d) are kidney; (b) and (e) are liver; (c) and (f) are kidney+liver; (g) refers to all Cd sample sites in the studied soils.
2.2 体外模型2.2.1 胃肠模拟法
利用动物模型测定土壤中Cd的RBA,可以外推用于人体的土壤Cd暴露风险评估,因此,越来越多研究者尝试建立与体内生物有效性呈相关性的体外胃肠模拟法来测定Cd生物可给性,从而建立基于体外方法的土壤重金属健康风险评估模型。常见的体外胃肠模拟方法的提取参数和成分各不相同(表2),表2中前4种方法包括胃相和肠相重金属含量测定,UBM除上述2种提取相外,还包括口腔模拟,不同方法的相位提取参数也有所差异。目前主要将体外胃肠模拟检测Cd生物可给性的方法分为2类,一类为基于人体胃肠道生化条件而浸出Cd,包括IVG、DIN、PBET和UBM;另一类是利用化学品浸出Cd,包括SBRC(胃提取阶段)[35]。其中,PBET方法是Ruby等[39]建立起来的模型,在胃液中加入各种有机酸,从而影响胃肠道中金属的溶解和沉淀。而DIN方法是德国测定土壤污染物生物可给性的标准方法[40],与SBRC、PBET方法不同的是,它在胃肠模拟液中加入了无机盐。与其他方法相比,UBM方法的模拟液极其复杂(表2),并且还包括了口腔唾液的测定。体外胃肠模拟方法的提取参数各不相同,所以利用不同的方式测定的土壤Cd生物可给性也有所差异。在大多数研究中,胃阶段的Cd生物可给性比肠阶段低,这是因为胃相pH较肠相低,而重金属在酸性条件下易溶解,从而胃相的生物可给性较高[41]。
为了验证体外胃肠模拟法的准确性,需要建立胃肠模拟方法与体内动物模型的体内-体外相关性分析。然而,不同的污染类型土壤所建立的相关性具有差异[10,31,36],基于对矿区(图2(a)和2(b))、冶炼厂(图2(c)和2(d))和农业(图2(e)和2(f))土壤Cd胃肠阶段的生物可给性与体内动物模型的生物有效性的相关性如图2所示。在矿区和农业土壤中,利用IVG所测定的生物可给性与体内模型具有较好的相关性,胃肠阶段相关性系数(r2)分别可达到0.97、0.99和0.82、0.66;而冶炼厂场地土壤,SBRC和PBET胃肠模拟法具有较好的相关性(r2=0.98、0.97和0.97、0.99)。可见,不同胃肠模拟方法的提取参数都会影响Cd的生物可给性,并且与体内所测定的RBA相关性也不同,这也说明体内-体外相关性的建立与体内动物模型的差异也有很大关系。此外,考虑到所研究的土壤样本相对较少,因此未来需进一步验证体内-体外所建立的相关性,以寻找出最适合于不同污染土壤类型的测定模型。
2.2.2 人体肠道细胞模型
尽管体外胃肠模拟法和基于动物实验的体内生物有效性分析方法得到了广泛应用,但是胃肠模拟缺少人体胃肠道细胞组分,无法模拟细胞间相互作用对污染物摄入的影响,往往也会引起研究结果不准确[43],如肠道上皮细胞中二价重金属转运蛋白(divalent metal transporter 1, DMT-1)可转运多种类型二价重金属进入肠道细胞,但是对不同类型重金属具有不同的亲和性和转运效率,肠道细胞分泌的黏液等成分也会显著降低重金属的生物有效性[44]。因此,开发基于人体胃肠道细胞的体外方法对于准确测定重金属人体生物有效性具有重要意义。近年来,研究者提出,建立基于体外胃肠模拟结合人体肠道细胞(Caco-2)模型的体外方法来准确分析重金属的生物可给性和生物有效性,从而准确评估其健康风险[45]。
Caco-2细胞来源于人结肠,可体外培养分化形成紧密连接的单层肠道上皮结构,且具有多种小肠的功能特征,因而在药物、营养元素的肠道吸收、转运和生物有效性研究中广泛应用[46],因此,Caco-2细胞吸收模型是一个较好的评估Cd肠道吸收的模型。在研究实践中,利用Transwell小室培养构建Caco-2细胞单层,用于模拟人体上皮细胞对土壤Cd的吸收和转运机制,与体内动物实验相比,Caco-2模型具有重复性好、操作简单、省时和经济等优点。Boim等[47]将Caco-2细胞暴露于土壤肠相提取液后,细胞所吸收的Cd浓度最高只达到胃肠液中的44%。且Caco-2细胞也广泛应用于其他无机污染物和有机污染物的测定,Pan等[48]的研究表明十溴联苯醚(decabromodiphenylether, BDE-209)在2~3 h内被Caco-2细胞迅速吸收并且到达稳态,稳态时细胞内的BDE-209含量占总量的42%。基于以上研究,Caco-2细胞在肠道吸收研究中,作为经典的模型已广泛应用于有机和无机污染物的生物有效性测定中,与基于动物实验的生物有效性研究相比成本较低,并且更接近人体肠道生理状态和功能,可以更为准确预测其健康风险。

表2 常见5种体外胃肠模拟方法测定金属可给性的提取参数Table 2 Parameters for determining metal bioaccessibility by five in vitro gastrointestinal simulation methods

图2 不同污染场地土壤Cd生物可给性与生物有效性相关性注:(a)、(b)为矿区土壤,(c)、(d)为冶炼厂土壤,(e)、(f)为农业土壤;G表示胃相,I表示肠相。Fig. 2 The correlation between bioaccessibility and bioavailability of soil Cd in different contaminated sitesNote: (a) and (b) are mine soils; (c) and (d) are smelter soils; (e) and (f) are agricultural soils; G is stomach phase and I is intestine phase.
然而,肠道上皮细胞组织结构复杂并且存在多种细胞类群之间的相互作用[49],而单一Caco-2细胞(图3(a))很难完全模拟小肠生理以及结构功能,因此,研究者尝试将Caco-2细胞与其他种类肠道细胞共培养来优化研究模型。Calatayud等[44]采用Caco-2细胞与人杯状细胞(HT29-MTX)共培养的方式研究砷的肠道吸收,发现Caco-2/HT29-MTX细胞共培养体系中形成了完整的黏膜层(图3(b)),测得的As(Ⅴ)表观渗透率值要显著高于单一Caco-2细胞模型。然而在人体肠道中,M淋巴细胞散布于肠道黏膜与肠道上皮细胞间,在调控肠道细胞免疫、分化和生理功能方面具有重要作用。Mahler等[50]在NatureNanotechnology上发文称其利用Caco-2/HT29-MTX/M细胞(Raji B)3种细胞共培养技术(图3(c))构建了三维肠道模型,用于研究纳米颗粒对铁肠道吸收和生物有效性的影响,证实Raji B细胞的引入使得Caco-2/HT29-MTX模型的功能进一步增强,体系更接近人体肠道真实环境。

图3 人体肠道细胞吸收模型Fig. 3 The absorption model for human intestinal cell
然而基于多种肠道细胞的共培养模型测定土壤中Cd生物有效性的研究较少,有研究利用Caco-2/HT-29共培养模型检测分析了食品中Cd的生物有效性,并证实了复合培养模型的优越性。如Lv等[51]利用Caco-2/HT-29共培养模型测定煮熟大米中Cd的吸收速率(25.08%),比利用体外消化方法的单一Caco-2细胞模型测定的吸收率(1.77%~8.62%)更准确[45]。可见,多种细胞共培养时能够更加准确模拟人体肠道结构,能更为精确评估污染物对人体产生的健康风险。
3 生物有效态镉诱发动物或肠道细胞模型毒性效应(Bioavailable cadmium induces toxic effects in animal or intestinal cell models)
目前的研究多集中在利用不同模型分析环境介质中污染物的生物有效性,然而土壤生物有效态Cd诱发健康危害的报道仍然较少。Aziz等[18]利用体外胃肠模拟法结合Caco-2细胞模型研究了大米中Cd的人体生物有效性,发现其人体生物有效性为4.04%~8.62%,同时分析了跨过肠道细胞的生物有效态Cd对人体肝细胞的毒性效应,发现当大米中Cd含量为6 mg·kg-1时,生物有效态Cd立即会诱发肝细胞氧化损伤。此外,Aziz等[52]研究不同Cd污染土壤(黄壤和钙质土)中种植的蔬菜内Cd的人体生物有效性和毒性效应,发现黄壤蔬菜Cd的人体生物有效性为5.27%~14.66%,高于钙质土蔬菜的1.12%~9.64%,当生物有效态Cd含量超过0.74 μg时,会抑制肝细胞抗氧化酶活力,从而诱发氧化损伤。在体内动物实验研究中,Breton等[53]以小鼠暴露于100 mg·L-1的Cd,其十二指肠Cd浓度达到6 mg·kg-1后,Cd所诱导的金属硫蛋白表达与Cd浓度均呈剂量依赖性,并且氧化应激相关基因也有变化。此外,Cd暴露可改变小鼠肠道形态和破坏肠道屏障以紊乱消化系统,并显著降低紧密连接基因occludin、ZO-1和claudin-1的mRNA的表达,从而导致肠道通透性增加[54-55]。同样的,Ba等[56]建立早期低剂量Cd暴露的小鼠模型,通过16S rDNA测序、微生物生态分析以及粪便微生物移植对肠道菌群进行测定,发现Cd可改变肠道菌群的稳态,并且加快肝脏脂质的代谢。研究显示,以5.0 mg·kg-1(以单位体质量计)的Cd口服剂量染毒小鼠肝脏,其细胞在10~30 d发生显著凋亡,并且Cd可激活NLRP3炎症小体,使得促炎细胞因子和抗炎细胞因子mRNA表达均显著上调,进而导致肝脏功能受损[57]。
综上可见,并非所有Cd含量能引起毒性效应,因此建立土壤Cd污染水平-生物有效态Cd含量-毒性效应之间的剂量效应关系将为准确评估健康风险提供重要依据,也将成为今后的重要研究热点和亟待解决的科学问题。
4 影响土壤镉人体生物有效性的因素(Factors affecting human bioavailability of cadmium in soil)
在测定土壤Cd生物有效性时,不同污染场地土壤理化性质、体外胃肠模拟法提取参数以及人体细胞模型的功能化程度,都会影响测定结果。
4.1 土壤理化性质
土壤污染物的生物有效性受土壤的理化性质(pH、有机质和氧化还原电位)影响。pH可改变土壤中重金属的溶解度以及迁移性[58],土壤胶体一般带负电荷,而Cd以Cd2+、CdCl+等阳离子的形式存在,因此随着pH的降低,土壤对其吸附能力减弱而导致生物有效性增加[59]。有机质可以吸附易迁移的可交换态重金属,其容易与Cd形成络合物,从而使生物有效性降低[60]。此外,氧化还原电位可以改变金属形态,从而影响金属的溶解、吸附和沉淀过程,因而对土壤中Cd生物有效性产生影响[61]。Tian等[62]利用PBET法测定的土壤Cd生物可给性(43.7%~81.5%)与有机质含量正相关,而与pH呈负相关。
复合金属污染土壤中不同金属之间的相互作用也会影响Cd生物有效性,Ollson等[63]利用小鼠模型测定Cd的RBA时,证实暴露体系中砷、镉和铅共存条件下Cd的RBA明显降低。另外,Cd与钙、铁和锌等二价金属元素在肠道吸收的化学机制类似[64],这些元素的存在也会影响Cd的吸收,从而影响土壤Cd生物有效性。Zhu等[28]利用小鼠模型测定矿区土壤Cd生物有效性时,发现随着总铁含量的增加Cd生物有效性明显降低,这可能是由于Cd2+和Fe2+共同竞争结合DMT1,从而降低Cd的吸收,相反,生物体内缺铁会促进Cd的吸收和转运[65]。在重金属复合污染的土壤中,较高浓度的砷和铅都可能会降低Cd的生物有效性[37]。可见,与Cd共存的营养元素和金属都可能改变机体对Cd的吸收,从而影响Cd的生物有效性。因此,在研究土壤Cd生物有效性时,需要综合考虑多种元素共同暴露的作用,且不同污染场地土壤Cd含量具有差异,将土壤本身理化性质考虑在内以减少测定结果的不确定性。
4.2 胃肠模拟法消化条件
体外胃肠模拟方法多样,其提取参数也各不相同,如pH、固液比、提取时间以及胃肠液组成成分等都会影响Cd生物可给性。其中,提取pH是较为敏感的因素,生物可给性会随着pH的增加而降低,Li等[10]利用不同方法提取土壤中具有生物可给性的Cd时,胃阶段的pH从1.5增加到2.5,生物可给性从86.5%降到68.9%。相似地,Juhasz等[36]所测定结果也呈现出此规律,因此随着pH的增加,可能会降低Cd的生物可给性。在模拟胃肠液提取土壤Cd的不同方法中,固液比为1∶37.5~1∶150不等[10,36],当消化液体较多时,从土壤基质中释放到胃肠液的Cd量相对较高,也就是说可溶解在人体中的Cd相对较多。然而,Hamel等[66]测定Cd生物可给性时,固液比从1∶100降低至1∶5 000,在1∶200时生物可给性达到了最大,再随消化液体的增加,可给性呈现出下降趋势。因此,当土壤中的物质未完全释放时,消化液的体积与生物可给性呈正相关,而当物质完全释放后达到饱和,可给性与固液比可能呈负相关或无相关性[67]。此外,土壤在胃肠液所停留的时间以及胃肠液的组成成分也会影响Cd的生物可给性,与猪胆汁相比,鸡胆汁可以明显提高土壤中Cd的生物可给性[68]。因此,体外消化条件都会影响人体胃肠道溶解土壤中的Cd,也由此说明个体消化系统差异会导致生物可给性的不同。
4.3 动物物种差异及细胞模型功能化程度
不同的体内外评价方法及其实验参数也会导致土壤Cd生物有效性结果的差异。体内模型中,主要是由动物种内和种间的差异造成,种内差异包括年龄、喂养方式和肠道吸收速率等;种间差异包括不同动物模型的消化系统差异[35]。在人体肠道细胞吸收模型中,肠道细胞功能化程度也会显著影响土壤Cd的人体生物有效性。Sun等[69]发现,与人体肠道上皮组织(十二指肠)相比,Caco-2细胞中有超过70个转运通道蛋白和重要的代谢酶的基因表达水平存在显著差异。此外,在药物吸收转运的研究中,Caco-2肠道细胞吸收模型更是引起较多的假阳性结果[70]。可见,肠道细胞的功能化程度会显著影响其生理功能,最终也很难准确分析重金属的人体生物有效性。
4.4 食物组分
最近研究发现,食品中脂肪、蛋白质、纤维素和碳水化合物等进入人体后也会影响土壤重金属的生物有效性。Sun等[71]的研究表明,添加膳食成分能够明显降低Cd的生物可给性以及小鼠肝脏和肾脏Cd的RBA,并且与土壤一同进食的食品中的营养元素也会降低肠道细胞吸收污染物的能力[20]。只考虑禁食状态下对土壤Cd的吸收,可能会高估对土壤的健康风险,因此,膳食成分也是影响污染物生物有效性的一个因素。
5 展望(Prospect)
对土壤重金属的健康风险评价,目前研究大多基于土壤重金属总量,而这种评价方法会高估其风险,因此基于体内外方法测定人体生物有效性能够更加真实评价污染土壤对人体健康风险。本综述从我国土壤Cd污染现状、土壤生物有效态Cd的健康风险评价模型及其所诱导的毒性机制和影响因素等方面展开讨论,为我国土壤Cd健康风险评估提供参考。由目前研究文献可得出,在体内模型测定中,利用小鼠肝脏+肾脏为测定终点的较多,这可以减少由于种内金属硫蛋白所带来的差异。与体内模型相比,体外模型则是一种经济、快速和有效的手段。体外胃肠模拟法中,基于建立体内-体外相关性模型,不同污染场地土壤所利用的方法不同,矿区和农业土壤Cd的RBA与IVG法测定的生物可给性相关性较好,而冶炼厂土壤则用SBRC法和PBET法更好。此外,土壤本身理化性质、消化条件以及动物细胞模型的建立都会影响土壤Cd的生物有效性,因此,准确评估人体经口摄入土壤Cd生物有效性仍是一个挑战,对未来有关土壤风险评价研究提出几点建议:
(1)对于体内模型,需进一步对不同动物、不同靶器官测定Cd生物有效性,以选择最适用于Cd的RBA模型。
(2)对于体外模型,可建立三维小肠研究模型反映肠道吸收机制,在三维环境中细胞能够承受更多的形态和生理变化,以与人体的肠道生理功能更加接近;此外,在一定条件下,干细胞是可无限自我更新与增殖分化的一类细胞,将此在体外分化成肠道组织,由此产生的三维肠道“类器官”作为新型肠道模型,以测定人体肠道对土壤Cd的吸收及其产生的毒性效应将具有重要意义。
(3)通过测定土壤Cd生物有效性,进而研究生物有效态Cd可诱发的动物或肠道细胞模型毒性效应,并从分子层面深入探究生物毒性效应和人体肠道吸收转运过程与机制,基于土壤Cd含量-生物有效量-毒性机制的关系,准确评估土壤Cd对人体的毒性机制,以对健康风险防控提供科学依据。

