一种利用甘氨酸氧化酶生产乙醛酸的方法
王玉成, 宋 伟, 艾连中, 吴 静
(1.江南大学 药学院,江苏 无锡 214122;2.上海理工大学 医疗器械与食品学院,上海 200093)
乙醛酸(glyoxylic acid)是一种重要的化工原料,广泛应用于生产口服青霉素[1]、香兰素[2]、乙基香兰素和尿囊素等重要化学品。同时,乙醛酸能与苯酚缩合生成4-羟基扁桃酸,与氨反应生成羟基苯甘氨酸,是药物阿莫西林的重要前体[3]。
乙醛酸工业生产方法主要包括草酸电解法(草酸水溶液经电解还原,生成乙醛酸稀溶液)和乙二醛氧化法(乙二醛经贵金属催化生成乙醛酸)[4]。但是上述生产方法面临工艺复杂、能耗高、产品纯化困难等问题。另一方面,化学生产会造成环境污染。
生物技术法具有绿色节能、可持续性及副产物少等特点[5],如乙醇酸经乙醇酸氧化酶生成乙醛酸,也有以木糖为底物采用微生物发酵生产乙醛酸[6]。然而,生物法生产乙醛酸面临产量低、反应时间长等缺点,限制了其工业化应用,如图1 所示,在KEGG 数据库中甘氨酸能经甘氨酸氧化酶(glycine oxidase, ThiO, EC 1.4.3.19)的催化,生产乙醛酸[7]。这一反应表明,若能以廉价易得的甘氨酸作为底物,生物催化生产乙醛酸,不仅能有效地缩减乙醛酸工业化固定资产,还能有效地消耗甘氨酸过剩的产能,带来良好的经济效益和产业价值。但是,目前尚无利用ThiO 催化生产乙醛酸的研究报道[8-9],其产业瓶颈在于ThiO 的表达是以包涵体的形式存在[10]。

图1 甘氨酸氧化酶催化甘氨酸生成乙醛酸Fig.1 Glycine oxidase catalyzes glycine to glyoxylic acid
针对上述问题,本研究以实现ThiO 的可溶性表达[11-12]为目标,使用不同表达宿主和表达载体[13-15],构建表达ThiO 的重组菌株。检测了重组菌体作为生物全细胞催化剂制备乙醛酸的潜力。并探究全细胞催化剂的最优反应条件及外源物添加对转化反应的影响,通过放大转化体系考察其应用性。为全细胞法催化甘氨酸生产乙醛酸的工业化提供理论依据和应用基础。
1 材料与方法
1.1 菌株、质粒与引物
ThiO 基因来源菌株为Bacillus subtilis168,GenBank 中基因信息(NCBI 基因ID:939377;NCBI蛋白ID:NP_389049)。克隆宿主E.coliJM109、表达宿主E.coliBL2l(DE3)和Bacillus subtilis168 购买自中国普通微生物菌种保藏中心CGMCC 和中国农业微生物菌种保藏中心ACCC。E.coli表达载体pET-28a(+)(T7 启动子,Kanar)、pGEX-6P-1(含有N-GST 标签,Tac 启动子,Ampr)、pCOLDI(CSPA冷启动子,Ampr)和Bacillus subtilis168 表达载体pP43NMK(P43 启动子,Kanar)为本实验室保藏。同源引物合成及基因序列测序工作均委托苏州金唯智生物工程有限公司。本研究使用引物见表1。

表1 本研究所用引物Tab.1 Primers used in this study
1.2 试剂与培养基
Ex Taq DNA 聚合酶、限制内切酶、连接酶和过氧化氢酶购自Takara(大连)有限公司;细菌基因组提取试剂盒、胶回收试剂盒和质粒提取试剂盒购自生工生物工程(上海)有限公司;甘氨酸、乙醛酸、通透剂CTAB、曲拉通(X-100)和吐温-80 购自美国Sigma-Aldrich 公司。
LB(Luria-Bertani)培养基成分:酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L。固体培养基另加2%的琼脂粉。TB 培养基成分:酵母粉24 g/L,胰蛋白胨12 g/L,甘油4 g/L,KH2PO42.31 g/L,K2HPO412.54 g/L。
1.3 重组质粒的构建
按照细菌基因组提取试剂盒的操作步骤从Bacillus subtilis168 菌体中提取基因组。以基因组为模板,使用设计的不同载体对应的同源引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增和胶回收。按照质粒提取试剂盒提取质粒。pET-28a(+)质粒选择SalI 和XhoI 位点酶切;pGEX-6P-1 质粒选择EcoRI 和XhoI 位点酶切;pCOLDI 质粒选择XhoI 和EcoRI 位点酶切;pP43NMK 质粒选择KpnI 和SmaI 位点酶切。酶切过后的质粒片段与扩增片段使用连接酶进行连接,连接产物导入E.coliJM109 感受态细胞后涂布平板。通过抗性筛选、挑取阳性克隆子菌落PCR验证及基因序列测序完成验证。
1.4 发酵产酶
以E.coliBL2l(DE3)为表达宿主、pET-28a(+)为表达载体的重组菌发酵产酶过程为:先在LB 固体平板上划线,37 ℃过夜培养;然后挑取平板上单菌落接种于含有卡那抗性的LB 液体培养基(终浓度为0.4 mmol/L)中,在37 ℃、200 rpm 恒温摇床上震荡培养12 h;再将上述种子菌液按照2%接种量接种于卡那抗性的TB 培养基中,在37 ℃、200 rpm 恒温摇床上震荡培养2 h 左右,待菌液OD600达到0.6,再添加诱导剂IPTG 置于25 ℃、200 rpm 恒温摇床上诱导12 h。
以E.coliBL2l(DE3)为表达宿主、pGEX-6P-1为表达载体的重组菌发酵产酶操作与pET-28a(+)为表达载体的重组菌基本相同,但使用的选择抗性为Amp 抗性。
以E.coliBL2l(DE3)为表达宿主、pCOLDI 为表达载体的重组菌发酵产酶过程:种子活化至诱导前操作与pGEX-6P-1 为表达载体的重组菌相同,pCOLDI 表达载体的启动子为CSPA 冷启动子,低温15 ℃诱导,不需添加诱导剂IPTG。
以Bacillus subtilis168 为表达宿主、pP43NMK为表达载体的重组菌发酵产酶过程:载体启动子为组成型P43 启动子,不需要其他因子的诱导即可稳定地表达,待发酵培养基中菌体生长至稳定期即可停止发酵。
1.5 分析方法
1.5.1 ThiO 可溶性表达的鉴定
对发酵诱导的菌液12 000 r/min 离心20 min,保留沉淀弃上清,使用pH 值8.0 的20 mmol/L 磷酸盐缓冲液洗涤1 次,离心弃上清。再加入磷酸缓冲液重悬,对悬浮液进行超声破碎,离心后分离上清与沉淀,沉淀用等量磷酸缓冲液重悬。重悬过后的沉淀悬浮液与分离上清分别与SDS 缓冲液进行混合,沸水浴10 min 进行蛋白变性处理。通过SDS-PAGE 电泳检测上清样品与沉淀样品中蛋白的可溶性表达情况。
1.5.2 乙醛酸含量的测定
采用高效液相色谱法(HPLC)来检测反应液中产物乙醛酸的含量。本研究使用Waters 高效液相色谱仪,Bio-Rad Aminex HPX-87H 色谱柱(300 mm×7.8 mm,9 μm),流动相是超声脱气过膜处理后的50 mmol/L 稀硫酸。全细胞转化反应液经过12 000 r/min 离心5 min 后保留上清液,使用0.22 μm孔径的滤头过滤,得到滤液为待测样品。检测条件设置为:进样量10 μL,流速0.6 mL/min,柱温35 ℃,紫外检测波长为210 nm,样品的进样时间设置为25 min。
1.5.3 温度对全细胞催化活性及稳定性的影响
全细胞催化反应分别在pH 值8.0、温度15,20,25,30,35,40,45 ℃的条件下进行,以本次实验所有样品中最高活性作为相对酶活100%,比较得到全细胞催化的最适反应温度;菌体分别在25,30,35,40,45 ℃下保温8 h,每隔1 h 取样,在25 ℃、pH 值8.0 条件下测定残余活性,其中定义全细胞催化原始活力为最高相对酶活100%。
1.5.4 pH 值对全细胞催化活性及稳定性的影响
全细胞催化反应分别在温度25 ℃、pH 值6.0, 6.5, 7.0, 7.5, 7.8, 8.0, 8.3, 8.5, 9.0,9.5 的10 个不同缓冲液中进行。pH 值6.0~8.0 范围内使用50 mmol/L 磷酸缓冲液;pH 值8.0~9.5 范围内使用50 mmol/L Tris-HCl 缓冲液。以本次实验所有样品中最高活性作为相对酶活100%,比较得到全细胞催化的最适反应pH 值。菌体分别在pH 值7.0,7.5,8.3,8.5,9.0 下保温8 h,每隔1 h 取样,在25 ℃、pH 值8.0 条件下测定残余活性,其中定义全细胞催化原始活力为最高相对酶活100%。
2 结果与讨论
2.1 ThiO 表达菌株的构建及转化生产乙醛酸
提取经过ThiO 基因片段扩增、酶切连接和筛选验证等分子操作构建成功的重组质粒。将重组质粒pET-28a(+)-ThiO 转化入E.coliBL2l(DE3)感受态细胞,经卡那霉素LB 平板筛选;将重组质粒pGEX-6P-1-ThiO、pCOLDI-ThiO 转化入E.coliBL2l(DE3)感受态细胞,经氨苄霉素LB 平板筛选;将重组质粒pP43NMK-ThiO 转化入Bacillus subtilis168 感受态细胞,经卡那霉素LB 平板筛选,见表2。挑取阳性克隆子,经过菌落PCR 验证获得包含ThiO 基因的4 株表达菌株:E.coliBL2l(pET-28a(+)-ThiO)、E.coliBL2l(pGEX-6P-1-ThiO) 、E.coliBL2l( pCOLDI-ThiO) 及Bacillus subtilis168(pP43NMK-ThiO)。

表2 表达菌株的构建Tab.2 Construction of expression strains
对菌株E.coliBL2l(pET-28a(+)-ThiO)、E.coliBL2l(pGEX-6P-1-ThiO)进行发酵培养,菌液OD600达到0.6 时,添加终浓度1%的诱导剂IPTG ,在25 ℃条件下进行诱导表达;对E.coliBL2l(pCOLDIThiO)进行发酵培养,在低温15 ℃条件下进行诱导表达;对菌株Bacillus subtilis168(pP43NMK-ThiO)进行发酵培养。将上述4 株重组菌株菌液进行离心处理,并收集菌体,用PBS 缓冲液洗涤两次后,保存起来作为全细胞催化剂。在pH 值8.0 的50 mmol/L 磷酸缓冲液中(20 mL 总体系)添加10 g/L 的底物甘氨酸以及20 g/L 的全细胞催化剂,在25 ℃、200 rpm 条件下反应12 h,检测4 株菌株全细胞转化生产乙醛酸的效果,结果见图2。发现菌株E.coliBL2l(pET-28a(+)-ThiO)、E.coliBL2l(pGEX-6P-1-ThiO)、E.coliBL2l(pCOLDI-ThiO)、Bacillus subtilis168(pP43NMK-ThiO)的乙醛酸产量分别为0.15±0.02,0.18±0.03,0.16 g±0.02,1.50±0.03 g/L,产量1.50±0.03 g/L 是目前生物法生产乙醛酸最高产量的2 倍[6]。

图2 4 株表达菌株全细胞转化生成乙醛酸的产量Fig.2 Production of glyoxylic acid by whole cell transformation of four expression strains
进一步分析,以E.coliBL2l 为表达宿主的3 株表达菌株转化生产乙醛酸的产量较低,其原因是ThiO 的表达以包涵体的形式存在。带有N-GST 促溶标签[16]的菌株E.coliBL2l(pGEX-6P-1-ThiO)、带有低温诱导促进蛋白正确折叠的CSPA 冷启动子的菌株E.coliBL2l(pCOLDI-ThiO)相比于带有T7 启动子的菌株E.coliBL2l(pET-28a(+)-ThiO)并没有取得促进ThiO 的可溶性表达的效果;而菌株Bacillus subtilis168(pP43NMK-ThiO)则是可溶性表达。因此,菌株 Bacillus subtilis 168(pP43NMK-ThiO)转化生产乙醛酸的效率较高,Bacillussubtilis168更适合作为ThiO 的表达宿主,用于后续研究。
2.2 菌株Bacillus subtilis 168(pP43NMK-ThiO)的可溶性表达
全细胞裂解液SDS-PAGE 电泳检测如图3 所示。其中:M代表蛋白质分子量标准;1 代表菌体破碎上清;2 代表菌体破碎沉淀。SDS-PAGE 电泳显示,菌株Bacillus subtilis168(pP43NMK-ThiO)菌体破碎上清液中,分子量44 kDa 大小附近有明显的蛋白亮条带(图3 中的条带1),与文献[7]中报道的ThiO 分子量大小一致;菌体破碎沉淀样品中没有蛋白亮条带(图3 中的条带2),表明ThiO在菌株Bacillus subtilis168(pP43NMK-ThiO)中成功实现了胞内可溶性表达。菌株Bacillus subtilis168(pP43NMK-ThiO)的菌体可作为转化甘氨酸生产乙醛酸的全细胞催化剂。
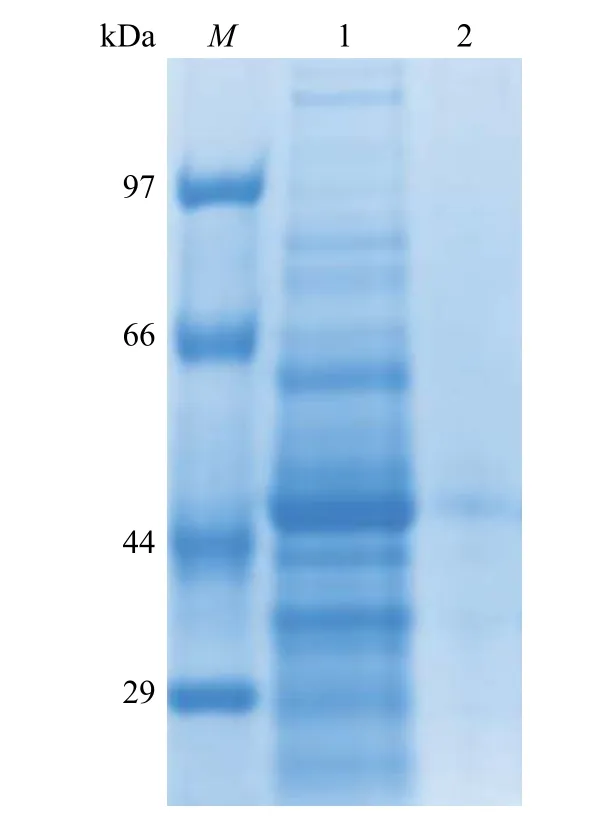
图3 SDS-PAGE 电泳检测全细胞裂解液Fig.3 SDS-PAGE analysis of whole cell lysates
2.3 菌株Bacillus subtilis 168(pP43NMK-ThiO)的最优转化条件
温度(15~45 ℃)对ThiO 酶活的影响如图4(a)所示。随着温度从15 ℃增加至30 ℃,ThiO 酶活逐渐上升达到最高值100%;继续增加温度(≥30 ℃),酶活则逐渐降低;45 ℃时酶活为40%。不同温度对全细胞催化剂热稳定性的影响如图4(b)所示,在25 ℃和30 ℃下保温8 h,全细胞催化剂基本不损失活性;而温度增加至35,40,45 ℃,保温8 h后,酶活仅为90%,75%,30%。这一结果表明,全细胞催化剂在35 ℃内能保持较高的酶活和热稳定性,与ThiO 纯化分离后温度相关的活性研究相吻合[7],适合工业化长时间催化。因此,Bacillus subtilis168(pP43NMK-ThiO)全细胞催化剂的最佳转化为温度30 ℃。

图4 Bacillus subtilis 168(pP43NMK-ThiO)全细胞催化剂最适反应条件及稳定性Fig.4 Optimal reaction conditions and stability for whole cell catalyst of Bacillus subtilis 168(pP43NMK-ThiO)
反应体系中pH 值直接影响与底物的结合,所以最适pH 值是全细胞催化剂重要的生物特性之一[18-20]。实验探究了Bacillus subtilis168(pP43NMK-ThiO)全细胞催化剂在pH 值6.0~9.5范围内的酶活变化,如图4(c)所示。在pH 值为6.0~6.5 时,全细胞催化剂残留20%活性,基本丧失转化能力;在pH 值为7.0~9.0 时,酶活先上升、后下降,保持60%以上活性;在pH 值为8.0~8.5 时,保持90%以上高活性;在pH 值为8.3 时,达到100%最高活性。本实验同时在pH 值7.0~9.0 范围内考察了全细胞催化剂8 h 内pH 值的稳定性,得到随时间变化的活性曲线,如图4(d)所示。在pH 值8.3 的最佳条件下,1 h 后活性下降至75%;1 h~5 h 间活性迅速下降,残留25%的活性;5 h 后活性随时间缓慢下降至完全丧失。从整体分析,Bacillus subtilis168(pP43NMKThiO)全细胞催化剂的pH 值稳定性不佳,在缓冲体系中会逐渐失活,最终完全丧失转化能力。关于ThiO 的pH 值稳定性研究中也存在3 h 后酶活仅残留30%的报道[15]。相对而言,pH 值8.3 时全细胞催化剂的稳定性最好,为最佳转化pH 值。
2.4 外源物质添加对乙醛酸转化的影响
外源物(通透剂和过氧化氢酶)添加对乙醛酸转化的影响结果如图5 所示。其中:1 指优化条件下空白对照组;2 指添加CTAB 组;3 指添加X-100 组;4 指添加吐温-80 组;5 指添加过氧化氢酶组。在温度为30 ℃、pH 值为8.3 的最佳转化条件下,反应初始时添加1%的CTAB,X-100 和吐温-80 时,乙醛酸产量为1.52±0.03,1.45±0.02,1.51±0.03 g/L,均低于对照组(1.82±0.01 g/L)。而添加1%过氧化氢酶,则使乙醛酸产量提高到1.95±0.03 g/L,达到当前生物法生产乙醛酸最高产量的2.6 倍。其原因在于副产物过氧化氢对细胞有毒害作用,而添加过氧化氢酶消除了部分过氧化氢,使得乙醛酸的产量得到提高。

图5 外源物添加对乙醛酸产量的影响Fig.5 Effect of additives on glyoxylic acid production
2.5 乙醛酸的规模化制备
将全细胞转化放大至3 L 发酵罐上进行乙醛酸的规模化制备。转化体系设置为50 g/L 的甘氨酸、20 g/L 的全细胞催化剂,控制反应条件在温度为30 ℃、pH 值8.3、通气1 vvm、搅拌转速500 rpm,反应12 h。转化过程曲线如图6 所示。3 h 以内,乙醛酸产量迅速积累至7 g/L;当转化进行到11 h时,乙醛酸产量达到最大值9.75±0.13 g/L,转化率为19.5%,转化效率与摇瓶转化结果一致,且到达最大产量的时间相比摇瓶减少了3 h,其原因是由于发酵罐具有良好的搅拌和溶氧性能;转化进行到12 h 时,乙醛酸的产量总体保持稳定。这有利于今后乙醛酸的工业化生产。

图6 乙醛酸放大体系转化生产过程Fig.6 Production process of glyoxylic acid conversion system
3 结 论
从表达宿主和表达载体角度出发,构建了4 株甘氨酸氧化酶重组菌株。实验转化结果显示Bacillus subtilis168 更适合作为ThiO 的表达宿主。菌株Bacillus subtilis168(pP43NMK-ThiO)实现了甘氨酸氧化酶胞内可溶性表达。并首次报道利用菌体全细胞转化甘氨酸制备乙醛酸,产量超越了当前生物法生产乙醛酸的最高产量。通过对反应条件优化及向反应体系中添加过氧化氢酶,使得产量进一步提升。在3 L 罐上进行了放大体系实验,显示出稳定的转化效果,为全细胞法制备乙醛酸的工业化奠定了基础。

