参芪扶正注射液对肝缺血-再灌注损伤后氧化应激的影响研究
张沥元,葛 优,王 轩
(南京中医药大学附属八一医院肿瘤外科,江苏南京210002)
目前肝癌的治疗仍以外科方式为主,手术切除是肝癌病人获得长期生存最重要的手段[1]。尽管外科水平和麻醉技术不断进步,但术中出血的危险仍不可避免。研究表明,术中大量出血可以引起一系列病理生理反应,增加围手术期死亡率,影响患者预后,甚至增加HCC 术后复发的风险[2-4],因此肝切除过程中有效控制出血是非常重要的。为了保障手术安全,减少术中出血,肝切除手术过程中一般采取入肝血流阻断法,但可能其造成的肝缺血-再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)不可避免。因此,如何减轻HIRI 一直是临床研究的热点。研究发现HIRI 的发生机制主要和无氧代谢、氧化应激、钙离子超载、线粒体结构功能异常、库普细胞和中性粒细胞激活、炎症因子释放、细胞凋亡、微循环障碍等相关[5],其中氧化应激是重要机制之一。参芪扶正注射液主要由党参和黄芪组成,具有明显的抗缺氧、抗氧化、抗炎活性[6],目前该药临床广泛应用于各类肿瘤患者化疗时的辅助治疗,用以提高免疫功能,改善生活质量,但在肝切除术后应用的相关研究较少。因此提出参芪扶正注射液对肝缺血-再灌注损伤后氧化应激的影响的研究。
1 资料与方法
1.1 一般资料
收集2019 年1~8 月在中国人民解放军第八一医院肿瘤外科行手术治疗的肝癌患者,共40 例,随机分为对照组和治疗组(参芪扶正注射液),每组各20 例。根据腹腔探查结果,对照组中1 例术中改行局部射频治疗,1 例术中改予门脉右支阻断,按剔除标准予以剔除,平均年龄(57.80±16.14)岁,肿瘤直径(4.60±1.34)cm,吲 哚 菁 绿15 min 残 留 率(ICG15)(4.56±0.97)% ,手 术 时 间(129.00±46.15)min,第一肝门阻断时间(15.20±0.44)min,术中出血量(400.00±372.49)mL,术中补液量(1 200.00±273.86)mL。治 疗 组 平 均 年 龄(57.12±7.98)岁,肿瘤直径(5.08±2.83)cm,ICG15(5.57±2.82)%,手术时间(145.00±33.70)min,第一肝门阻断时间(19.50±16.72)min,术中出血量(756.25±1 328.65)mL,术中补液量(981.25±75.29)mL。
所有入组患者术前签署知情同意书。两组术前Child-Pugh 评分均为A 级,无组间差异。两组年龄、肿瘤直径、(ICG15)、手术时间、第一肝门阻断时间及术中出血量相关指标比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准、排除标准及剔除标准
纳入标准:(1)术前诊断考虑原发性肝癌,且符合原发性肝癌诊疗规范中肝癌手术切除的适应征[7];(2)术中拟予Pringle 法行入肝血流阻断者;(3)心肺肾功能一般情况尚可,无明显手术禁忌证。
排除标准:(1)不符合肝癌切除手术适应证者;(2)合并其他重要脏器功能不全不能适应手术者;(3)对本品或含有党参、黄芪制剂等成分过敏或有严重不良反应者;(4)术前已使用过本药,或益气活血类的中药、中成药,或保肝类药,或抗氧化剂者;(5)术前长期口服他汀类药物者[8]。
剔除标准:(1)术中探查后更换治疗方式,改行射频等局部治疗;(2)术中未行入肝血流阻断、或予其他方式行入肝血流阻断;(3)术后因过敏或其他情况不宜继续使用本品者。
1.3 治疗方案
根据腹腔探查结果,38 例患者均行开腹肝癌切除术,术中均予Pringle 法行入肝血流阻断。两组患者术后均给予抗感染、保肝、补液等常规处理;治疗组在对照组治疗的基础上于术后当日加用参芪扶正 注 射 液( 丽 珠 集 团 利 民 制 药 厂 、86900454000970),250 mL 静脉滴注,每日一次,共使用5 d。
1.4 观察指标
分别于术前、术后第1 天、术后第3 天、术后第5天于病人空腹时自外周静脉抽取血5 mL,检测患者的肝功能指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH);以及超氧化物歧化酶(SOD)和丙二醛(MDA)水平(取部分标本血,离心机3 500 r/min 离心10 min,取上层血清待用,采用WST-1 法检测SOD,用TBA 法检测MDA。SOD和MDA 试剂盒均购买自南京建成生物有限公司,按照试剂盒说明书进行测定步骤)。
1.5 统计学处理
所有数据录入电脑,应用SPSS21.0 统计软件进行统计学分析。连续性变量用(±s)表示,两组之间比较采用t 检验,分类资料间计较采取x2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组围手术期氧化应激指标水平变化
两组术前SOD、MDA 水平无明显统计学差异;术后第1 天两组SOD 水平明显升高,至第3 天、第5天,逐渐呈下降趋势,但治疗组水平仍高于对照组,差异具有统计学意义(P<0.05);术后第1 天患者MDA 水平较术前明显升高,至术后第5 天均较术后第1 天明显下降,且治疗组低于对照组,差异均具有统计学差异(P<0.05)。见表1。
表1 两组围手术期氧化应激指标水平变化(±s)Tab 1 Changes of oxidative stress indexes during the perioperative period(±s)
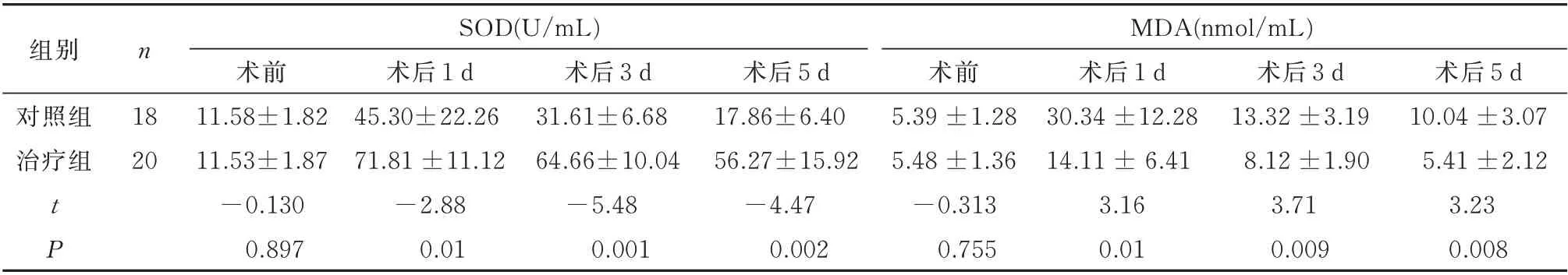
表1 两组围手术期氧化应激指标水平变化(±s)Tab 1 Changes of oxidative stress indexes during the perioperative period(±s)
组别n SOD(U/mL)MDA(nmol/mL)术后1 d 45.30±22.26 1.8771.81 ±11.1264.66±10.0456.27±15.05.39 ±1.2830.34 ±12.2813.32 ±3.1910.04 ±3.07 925.48 ±1.3614.11 ± 6.418.12 ±1.905.41 ±2.12 30−2.88−5.48−4.47−0.3133.163.713.23 0.01对照组治疗组18 20 t P术前11.58±1.82 11.53±−0.1 0.897术后3 d 31.61±6.68 0.001术后5 d 17.86±6.4 0.002术前0.755术后1 d 0.01术后3 d 0.009术后5 d 0.008
2.2 两组围手术期肝功能水平变化
两组术前ALT、AST 水平比较,差异无统计学意义(P>0.05);术后第1 天ALT、AST 水平较术前均明显升高,达到高峰,后呈下降趋势,至术后第5天仍高于正常水平。在对照组、治疗组间比较,两组ALT、AST 水平变化趋势一致,差异无统计学意义(P>0.05)。两组术前LDH 水平无差异;术后第1 天LDH 水平较术前均明显升高,达到高峰,后呈下降趋势。两组LDH 水平变化趋势一致,两组在术前、术后第1 天、术后第3 天比较,差异无统计学意义(P>0.05);两组术后第5 天比较,差异具有统计学意义(P<0.05)。见表2。
表2 两组围手术期肝功能水平变化(U/L,±s)Tab 2 Changes in liver function indicator levels during the perioperative period(U/L,±s)

表2 两组围手术期肝功能水平变化(U/L,±s)Tab 2 Changes in liver function indicator levels during the perioperative period(U/L,±s)
组别n ALT术前术后1 d 术后3 d 术后5 d AST术前术后1 d 术后3 d 术后5 d LDH术前术后1 d 术后3 d 术后5 d对照组18 26.6±3.7 578.6±373.2 338.4±173.4 149.8±76.5 30.4±4.3 621.2±488.2 104.8±173.4 29.2±76.5 226.2±52.48 719.4±503.8 262.2±47.1 208.4±14.9治疗组20 33.8±9.8 234.6±136.3 182.2±127.1 94.8±60.0 41.2±16.2 248.0±136.3 86.4±127.1 35.4±60.1 191.4±39.13 771.0±639.7 313.8±42.1 247.6±17.8 t P−1.381 0.205 1.732 0.122 1.453 0.184 1.131 0.291−1.288 0.234 1.486 0.176 0.583 0.576−0.695 0.507 1.189 0.269−0.142 0.891−1.170 0.276−3.370 0.010
2.3 术后并发症及住院时间
对照组术后均未见明显手术并发症,治疗组术后出现1 例肺不张(术后4 d)、1 例胆漏(术后6 d),予相关对症处理后症状均缓解;所有患者经治疗后好转出院。对照组住院时间(10.80±0.44)d、治疗组住院时间(11.62±1.84)d,两组患者的住院时间比较,差异无统计学意义(P>0.05)。
2.4 不良反应发生率
治疗组患者均顺利完成实验,所有患者在使用参芪扶正注射液过程中均未见明显皮疹、瘙痒、发热、烦躁、嗜睡、恶心、呕吐、静脉炎等并发症,无不良事件发生,此药使用安全可靠。
3 讨论
我国原发性肝癌患者大多合并肝炎及肝硬化,目前精准肝切除术为最常用的临床手术方式,既能彻底切除病灶,又能最大保护肝脏,但肝门阻断技术仍不可避免。尽管半入肝血流阻断法(hemihe⁃patic inflow occlusion HHO 法)对肝缺血损伤程度小于Pringle 法,但其操作复杂,分离过程中反而可能会造成额外的出血[9],因此Pringle 法仍是目前广为使用的有效控制术中出血的方法用[10]。此法既能减少出血量,又能保障肝切除手术的安全性,而其对肝组织产生IRI 不可避免,因此围手术期如何减轻HIRI 至关重要。
HIRI 发生的基本机制,多和氧自由基过度生成、钙离子超载和白细胞激活相关,其中氧自由基大量产生和剩余以及其进一步诱发的氧化应激是造成HIRI 的重要原因之一[11]。肝脏在缺血缺氧的过程中经多途径产生的活性氧会损害肝脏及细胞生物膜,引起一系列有害的细胞反应[12]。生理情况下,机体内存在的抗氧化物质可以及时清除氧自由基,使氧自由基的生成和降解处在动态平衡,对机体无毒害作用;但是在病理情况下,由于氧自由基或ROS 产生过多,或抗氧化酶类活性下降,可引发氧化应激反应,损伤细胞,甚至引起细胞死亡。SOD 作为一种抗氧化物酶,其水平降低会引起机体清除氧自由基能力出现一定程度的下降,造成其代谢产物堆积,加重机体损伤;围手术期大量产生的氧自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物,如MDA。MDA 破坏细胞器膜,造成机体清除氧自由基的能力进一步下降,降低体内SOD 活性,加重细胞的损伤[13]。因此,MDA 和SOD 是评估机体氧自由基产生和清除能力的重要指标[14]。此次研究结果显示,两组患者术后外周血中SOD 和MDA 水平均较术前显著升高,术后第1 天达到峰值后呈逐渐下降趋势,但仍较正常水平偏高,可见两组患者术后均出现不同程度的氧化应激反应;两组术后SOD和MDA 水平均呈下降趋势但明显高于术前水平,其中治疗组术后各个时间段SOD 水平更高,MDA水平更低,与对照组患者水平有统计学差异。由此,笔者认为参芪扶正注射液能提高机体抗氧化酶活性,减少脂质过氧化物的产生,抑制氧化应激反应,从而降低围手术期HIRI。
患者血清ALT 及AST 水平与肝细胞损伤程度成正比,可以作为肝损伤的诊断指标。在围手术期,各种原因均可导致肝功能损伤,患者术前存在肝功能不全、麻醉刺激和手术创伤均可诱发或加重肝功能障碍[15]。本研究结果发现,两组患者术前ALT 和AST 水平均较正常值轻度升高,可见肝癌患者术前已出现肝功能异常;术后第1 天,两组ALT、AST 水平均较术前明显升高,且达到最高峰,后逐渐呈下降趋势,直至术后第5 天时两组转氨酶水平仍高于正常范围,但治疗组术后转氨酶水平低于对照组,结果表示,两组术后均出现不同程度的肝损伤,且这种损伤至术后第5 天仍存在,但治疗组肝损伤程度较对照组明显偏低。两组患者围术期转氨酶水平变化趋势一致,各时间段均未见明显统计学差异。之前有关参芪扶正注射液能降低转氨酶、改善肝功能的报道[16,17],其人群多为行TACE 治疗的中晚期肝癌患者,这些患者多伴有慢性肝损害,但此次实验患者以术后急性肝损伤为主。也有可能和本次实验样本量过少以及参芪扶正注射液未足疗程使用相关,不能完全体现出参芪扶正注射液的保肝作用。笔者认为虽然两组转氨酶水平之间无统计学差异,但治疗组术后的临床转氨酶水平低于对照组,其相关机制还待进一步探寻及研究。本实验结果发现两组LDH 水平在术前、术后第1天、术后第3 天均未见明显统计学差异,在术后第5天两组水平变化出现统计学差异(P<0.05),关于此次存在的统计学差异是否是因为样本量过少引起的假意义仍待更多的样本量进一步明确。
中医方面,蒋益兰教授认为肝癌发病以脾肾两虚为正虚之本,肝郁、毒聚、痰湿、血瘀为标,虚实夹杂[18]。肝切除术为大型创伤性手术,术中失血失液,脏腑缺失都会造成机体损害,影响气血津液的运行。所以对于肝癌患者来说,手术前患者证候多以血瘀证、实热证的邪实表现为主;手术后,患者证候血瘀证减少,气虚证增多,虚实夹杂[19]。因此行肝切除手术患者术后还应治以补益气血、养阴、健脾和胃等原则,以恢复机体免疫功能,巩固疗效,防治复发转移[20]。研究表明“益气活血法”既能有效减轻肝微循环障碍、减轻肝组织损伤,又能降低细胞外钙离子、抑制氧自由基的产生,从而减轻缺血再灌注造成的损伤[21]。参性甘、平,力较和缓,养血而不偏滋腻,善鼓舞清阳、振动中气,而无刚燥之弊;黄芪性甘、微温,可以“温分肉,肥腠理,使阳气和利,充满流行,自然生津生血”,是行气、活血、扶正、益气的要药,两者在中医治病中作为补气活血类中药被广泛使用,二者相辅相成,共助气血生长,扶助正气。本次研究结果表明使用参芪扶正注射液的患者氧化应激反应程度及转氨酶水平更低,再灌注损伤引起的肝损害程度低,更加有利于术后早期康复的恢复。但本研究样本量少,结果可能存在偏差,还有待多中心、大样本的研究证实。
综上所述,对于在肝切除术中予第一肝门血流阻断的患者,术后使用参芪扶正注射液可以提高体内抗氧化酶活性,减少脂质过氧化物的产生,抑制HIRI 过程中的氧化应激反应,从而起到保护肝脏的作用,加速术后康复。且本品使用安全可靠,可临床推广使用。

