高糖通过P27 途径诱导胰岛β 细胞凋亡及细胞周期阻滞的作用及机制研究
乔予希,丁小明,王 颖,丁晨光,郑 瑾,项和立,薛武军,李 杨
(西安交通大学第一附属医院肾移植科,陕西 西安 710061)
2 型糖尿病是我国常见的内分泌代谢性疾病,以胰岛素抵抗及胰岛素分泌相对不足为基本特征。随着2 型糖尿病病程的延长,患者会出现胰岛β 细胞数目减少,引起胰岛功能减退[1]。胰岛β 细胞数目的减少与细胞凋亡激活、细胞周期停滞等引起的细胞损伤密切相关,多项关于胰岛β 细胞损伤的研究认为,持续存在的高糖环境能够引起胰岛β 细胞凋亡及细胞周期停滞[2-4],但具体的分子机制仍不十分明确。
P27 是靶向调节细胞凋亡及细胞周期的分子,能够靶向抑制细胞周期蛋白D1(cyclinD1)与激酶的结合并引起细胞周期停滞,也能激活含半胱氨酸的天冬氨酸蛋白水解酶8(cysteinyl aspartate specif⁃ic proteinase-8,caspase-8)并促进细胞凋亡。多项糖尿病相关的研究表明,高糖能够使神经、肾脏等组织中P27 表达增加并引起神经及肾脏损害[5,6];也有胰岛β 细胞相关的研究表明,P27 参与细胞凋亡及细胞周期的调控[7]。但P27 在高糖引起胰岛β 细胞损伤中的作用尚不明确。为此,本实验将以胰岛INS-1 细胞为对象,具体分析高糖通过P27 途径诱导胰岛β 细胞凋亡及细胞周期阻滞的作用及机制。
1 材料与方法
1.1 细胞
胰岛INS-1 细胞购自ATCC 公司。
1.2 试剂
P27 siRNA 及阴性对照(negative control,NC)siRNA 购自上海吉玛公司,转染试剂Lipo⁃fectamine2000 购 自Invitrogen 公 司,MTS 细 胞 活 力检测试剂盒购自MTS 公司,TUNEL 细胞凋亡检测试剂盒购自上海碧云天公司,RIPA 裂解液、BCA 蛋白定量试剂盒购自北京索莱宝公司,P27、caspase-3、cyclinD1 的一抗购自Abcam 公司。
1.3 仪器
细胞培养箱购自Thermo 公司,显微镜购自Nikon 公司,流式细胞仪购自BD 公司,酶标仪、凝胶成像仪购自Bio-rad 公司。
1.4 方法
1.4.1 细胞培养及分组 INS-1 细胞用含有10%胎牛血清的完全培养基进行贴壁培养,0.25%胰蛋白酶消化后按照1∶3 比例传代,传代后的细胞分为对照组、高糖组、高糖+si-NC 组、高糖+si-P27 组。处理方法如下:(1)对照组用普通培养基处理;(2)高糖组用含有25 mmol/L 葡萄糖的培养基处理;(3)高糖+si-NC 组用含有25 mmol/L 葡萄糖的培养基处理并转染NC siRNA;(4)高糖+si-P27 组用含有25 mmol/L 葡萄糖的培养基处理并转染P27 siR⁃NA。均采用Lipofectamine2000 进行转染,按照试剂说明书进行转染操作。每个条件设置5 个复孔、连续处理24 h。
1.4.2 细胞活力检测 用于分组的INS-1 细胞接种在96 孔培养板内,分组处理24 h 后用MTS 试剂盒检测细胞活力,按照试剂盒说明性进行染色及孵育后,在酶标仪上检测490 nm 波长的吸光值A490。
1.4.3 细胞凋亡检测 用于分组的INS-1 细胞接种在24 孔培养板内,分组处理24 h 后用TUNEL 试剂盒检测细胞凋亡,按照试剂盒说明性进行染色后,在显微镜下观察TUNEL 阳性染色和DAPI 阳性染色的细胞并计数,计算TUNEL 阳性染色细胞数与DAPI 阳性染色细胞数的比值,即为凋亡率。
1.4.4 细胞周期检测 用于分组的INS-1 细胞接种在培养皿内,分组处理24 h 后用0.25%胰蛋白酶消化收集细胞,−20℃预冷的70%乙醇在−20℃冰箱内固定24 h,离心收集细胞,PI 避光染色20 min,在流式细胞仪上检测细胞周期G0/G1 期、S 期、G2/M期的分布情况。
1.4.5 蛋白表达检测 用于分组的INS-1 细胞接种在12 孔培养板内,分组处理24 h 后用RIPA 裂解液提取细胞内的蛋白、用BCA 试剂盒检测蛋白含量,取含有30 μg 蛋白的样本与上样缓冲液混合,煮沸变性后进行western blot 实验。电泳分离蛋白,电转至PVDF 膜,5%脱脂牛奶室温封闭PVDF 膜1 h,1∶1 000 稀释的P27、caspase-3、cyclinD1 一抗或1∶5 000 稀释的β-actin 一抗4℃孵育过夜;次日,1∶2 000稀释的二抗室温孵育1 h,最后在凝胶成像仪中显影得到蛋白条带,根据条带的灰度值、以β-actin 为内参计算蛋白表达水平。
1.5 统计学处理
2 结果
2.1 高糖对INS-1 细胞中P27 表达的影响及转染P27 siRNA 敲 低P27 表 达 的 效 果
与对照组比较,高糖组INS-1 细胞中P27 的表达水平明显增加(P<0.05);与高糖组比较,高糖+si-NC 组INS-1 细胞中P27 的表达无明显变化(P>0.05);与高糖组、高糖+si-NC 组比较,高糖+si-P27 组INS-1 细胞中P27 的表达水平明显降低(P<0.05)。见图1、表1。
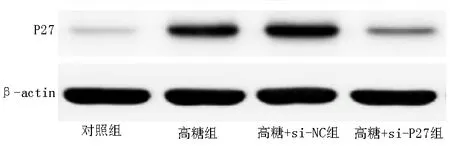
图1 各组细胞中P27 的蛋白条带Fig 1 Protein bands of P27 in cells
2.2 敲低P27对高糖条件下INS-1细胞活力的影响
与对照组比较,高糖组INS-1 细胞活力A490明显降低(P<0.05);与高糖组比较,高糖+si-NC 组INS-1 细胞活力A490无明显变化(P>0.05);与高糖组、高 糖+si-NC 组 比 较,高 糖+si-P27 组INS-1 细胞活力A490明显增加(P<0.05)。见表2。
2.3 敲低P27 对高糖条件下INS-1 细胞凋亡率及凋亡基因表达的影响
与对照组比较,高糖组INS-1 细胞的凋亡率及caspase-8 表达水平均明显增加(P<0.05);与高糖组比较,高糖+si-NC 组INS-1 细胞的凋亡率及cas⁃pase-8 表达水平无明显变化(P>0.05);与高糖组、高糖+si-NC 组比较,高糖+si-P27 组INS-1 细胞的凋亡率及caspase-8 表达水平均明显降低(P<0.05)。见图2、3 及表3。
表1 各组细胞中P27 蛋白水平的比较(±s)Tab 1 Comparison of P27 protein expression in cells(±s)

表1 各组细胞中P27 蛋白水平的比较(±s)Tab 1 Comparison of P27 protein expression in cells(±s)
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+si-NC 组比较,&P<0.05。
P27 0.25±0.08 0.89±0.15*0.95±0.17 0.45±0.08#&36.002 0.000组别对照组高糖组高 糖+si⁃NC 组高 糖+si⁃P27 组n 5 5 5 5 FP
表2 四组细胞活力的比较(±s)Tab 2 Comparison of cell viability(±s)

表2 四组细胞活力的比较(±s)Tab 2 Comparison of cell viability(±s)
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+si-NC 组比较,&P<0.05。
组别对照组高糖组高 糖+si⁃NC 组高糖+si⁃P27 组n 5 5 5 5 A490 1.02±0.22 0.42±0.09*0.45±0.08 0.93±0.17#&23.181 0.000 FP
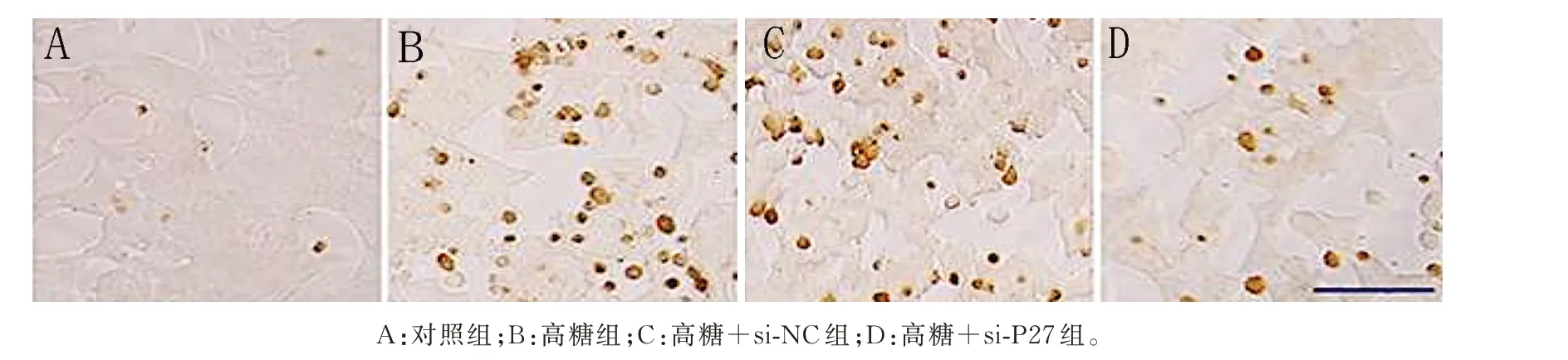
图2 4 组细胞TUNEL 染色图Fig 2 TUNEL staining image
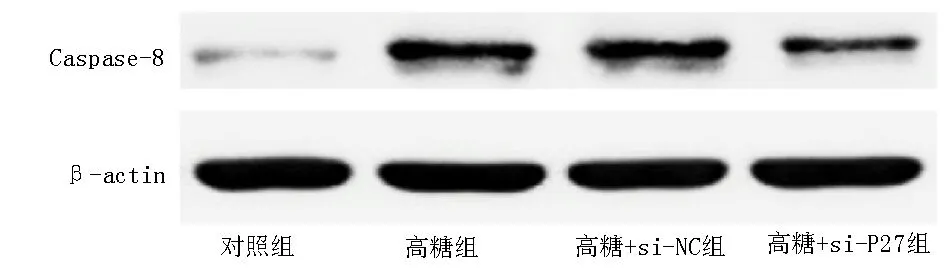
图3 4 组细胞中caspase-8 的蛋白条带Fig 3 Protein bands of caspase-8 in cells
2.4 敲低P27 对高糖条件下INS-1 细胞周期分布及细胞周期蛋白表达的影响
与对照组比较,高糖组INS-1 细胞中G0/G1 期比例明显增加,S 期、G2/M 期比例及cyclinD1 表达水平明显降低(P<0.05);与高糖组比较,高糖+si-NC 组INS-1 细胞的细胞周期及cyclinD1 表达水平无明显变化(P>0.05);与高糖组、高糖+si-NC 组比较,高糖+si-P27 组INS-1 细胞中G0/G1 期比例明显降低,S 期、G2/M 期比例及cyclinD1 表达水平明显增加(P<0.05)。见图4、表4。
表3 各组细胞凋亡率及caspase-8蛋白水平的比较(n=5,±s)Tab 3 Comparison of apoptosis rate and caspase-8 protein expression in cells(n=5,±s)
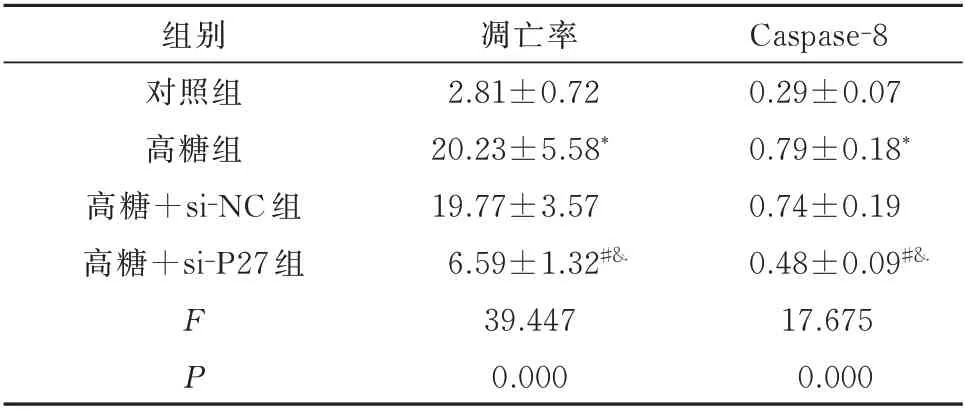
表3 各组细胞凋亡率及caspase-8蛋白水平的比较(n=5,±s)Tab 3 Comparison of apoptosis rate and caspase-8 protein expression in cells(n=5,±s)
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+si-NC 组比较,&P<0.05。
Caspase⁃8 0.29±0.07 0.79±0.18*0.74±0.19 0.48±0.09#&17.675 0.000组别对照组高糖组高糖+si⁃NC 组高糖+si⁃P27 组FP凋亡率2.81±0.72 20.23±5.58*19.77±3.57 6.59±1.32#&39.447 0.000

图4 4 组细胞中cyclinD1 的蛋白条带Fig 4 Protein bands of cyclinD1 in cells
表4 四组细胞周期及cyclinD1 蛋白水平的比较(n=5,±s)Tab 4 Comparison of cell cycle and cyclinD1 protein expression(n=5,±s)
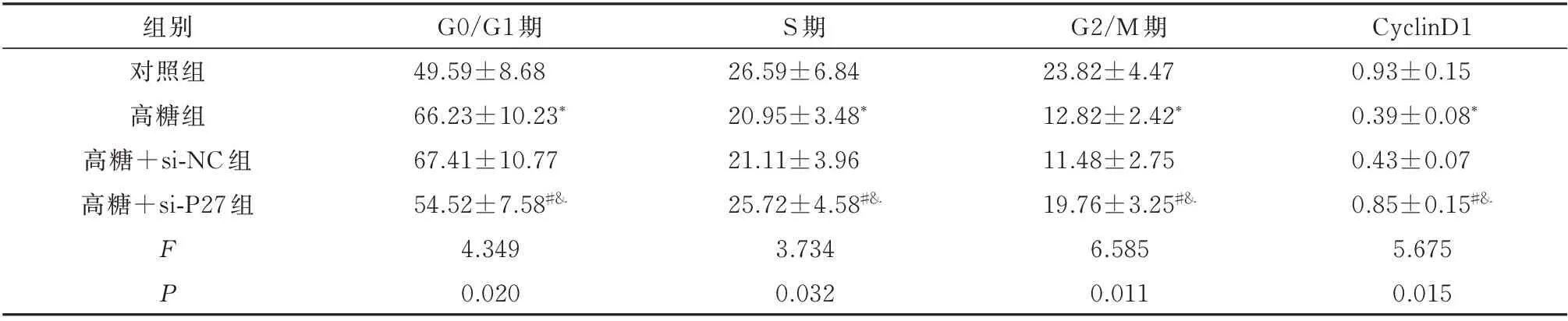
表4 四组细胞周期及cyclinD1 蛋白水平的比较(n=5,±s)Tab 4 Comparison of cell cycle and cyclinD1 protein expression(n=5,±s)
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+si-NC 组比较,&P<0.05。
CyclinD1 0.93±0.15 0.39±0.08*0.43±0.07 0.85±0.15#&5.675 0.015组别对照组高糖组高糖+si-NC 组高糖+si-P27 组FP G0/G1 期49.59±8.68 66.23±10.23*67.41±10.77 54.52±7.58#&4.349 0.020 S 期26.59±6.84 20.95±3.48*21.11±3.96 25.72±4.58#&3.734 0.032 G2/M 期23.82±4.47 12.82±2.42*11.48±2.75 19.76±3.25#&6.585 0.011
3 讨论
2 型糖尿病的特征是胰岛素抵抗及胰岛素分泌相对不足。在胰岛素抵抗的状态下,胰岛素代偿性分泌增多,随着病情延长,会出现胰岛β 细胞损伤、胰岛功能减退[8,9]。有研究报道,持续高糖刺激是造成胰岛β 细胞损伤的重要原因之一,相关的基础实验发现,高糖培养基处理能够引起胰岛β 细胞增殖活力下降[10-12]。本实验以胰岛INS-1 细胞为实验对象,用高糖培养基处理后同样观察到增殖活力A490下降,与既往其他学者发现高糖引起β 细胞增殖活力下降的结果一致,表明高糖能够引起胰岛β 细胞损伤,但具体的机制尚未阐明。
P27 是参与细胞增殖、细胞凋亡、细胞周期调控的基因,糖尿病的相关研究表明,糖尿病神经病变大鼠的背根神经节中以及糖尿病肾病大鼠肾脏中P27 的表达均明显增加[5-6],提示高糖可能通过上调P27 的表达来引起背根神经节细胞、肾小球细胞发生损伤,进而引起糖尿病神经病变及肾脏病变。本实验在用高糖培养基处理胰岛INS-1 细胞后发现细胞中P27 的表达增加,与高糖在其他组织中增加P27 表达的报道一致,提示上调P27 可能是高糖引起β 细胞损伤的分子机制。为了进一步验证这一机制,本实验通过转染siRNA 的方式敲低P27 的表达,在高糖培养基处理的同时转染P27 的siRNA、敲低P27 的表达后,INS-1 细胞的增殖活力A490增加,表明敲低P27 能够减轻高糖引起的胰岛β 细胞损伤,高糖可能通过激活P27 引起胰岛β 细胞损伤。
P27 相关生物学功能的研究主要集中在恶性肿瘤,多项基础研究表明P27 对多种恶性肿瘤细胞的凋亡具有促进作用、也能引起恶性肿瘤细胞发生细胞周期停滞[13-18]。在高糖引起胰岛β 细胞损伤的过程中,细胞凋亡的激活、细胞周期的阻滞起重要作用,本实验观察到:高糖培养基处理INS-1 细胞后凋亡率及G0/G1 期比例增加、而S 期及G2/M 期比例降低,表明高糖引起了胰岛β 细胞凋亡并使细胞周期停滞在G0/G1 期;在高糖处理的同时敲低P27 的表达后,细胞凋亡率及G0/G1 期比例降低,S 期及G2/M 期比例增加,表明敲低P27 能够减轻高糖引起的胰岛β 细胞凋亡及细胞周期停滞、高糖可能通过激活P27 参与胰岛β 细胞凋亡及细胞周期停滞。
Caspase-8 及cyclinD1 是P27 下游调控细胞凋亡及细胞周期的重要基因,P27 增加caspase-8 的表达后促进细胞凋亡,抑制cyclinD1 的表达后引起细胞周期停滞[19,20]。本实验在观察到高糖通过P27 参与胰岛β 细胞凋亡及细胞周期停滞后,进一步从基因表达的层面验证了上述变化。在高糖培养基处理INS-1 细胞后,细胞中caspase-8 的表达水平增加、cyclinD1 表达水平降低,与高糖引起细胞凋亡及细胞周期停滞的作用吻合;在敲低P27 的表达后,细胞中caspase-8 的表达水平降低、cyclinD1 表达水平增加,这一变化既符合P27 在其他细胞中的生物学功能、也与敲低P27 后细胞凋亡及细胞周期停滞的变化一致,由此进一步证实高糖可能通过激活P27途径、调节下游caspase-8 及cyclinD1 表达并参与胰岛β 细胞凋亡及细胞周期停滞。
综上所述,高糖具有诱导胰岛β 细胞凋亡及细胞周期阻滞的作用,这一作用与激活P27 途径、调节下游caspase-8 及cyclinD1 表达有关。

