PHLDB3在胃癌组织中的表达与临床价值
白琳琳
(沈阳二四二医院病理科,辽宁 沈阳 110000)
目前我国胃癌的发生率呈现出逐年上升的趋势。研究表明[1],从全球疾病发生率来看,胃癌的发生率以及病死率分别排名第5位以及第3位。虽然说最近几年我国医学技术取得了长足性进步,其在治疗胃癌方面取得了一定的进展。但因为胃癌常在中晚期才被发现,且极易复发与转移,所以胃癌患者的存活率依然较低。因而,提高人们对胃癌发生发展机制的认识显得非常重要。普列克底物蛋白同源样结构域(PHLDB3)是一种未被充分研究的蛋白质。迄今为止,学术界对PHLDB3的了解还停留在表面,未进行其生理及病理功能的深入性研究。本文全面探究PHLDB3在胃癌组织中的表达与临床分析,旨在为相关人员的研究工作提供参考依据。
1 资料与方法
1.1 一般资料 本试验所应用的胃癌组织芯片,生产厂家为上海芯超生物科技有限公司。其中男性140例,女性40例,年龄<60岁58例,>60岁122例;AJCC分期:1~2级74例,3~4级106例;远处转移:M0172例,M18例;淋巴结转移:N046例,N1~N3134例;浸润深度:T1~T222例,T3~T4158例;病理分级:Ⅰ~Ⅱ48例,Ⅲ~Ⅳ132例。
1.2 试剂 实验所应用的试剂有:二甲苯、无水乙醇/低度乙醇、枸橼酸盐缓冲液、磷酸盐缓冲盐水(PBS)、生物-链霉卵白素免疫组化检测试剂盒、二氨基联苯胺(DAB)显色试剂盒(20×)、中性树胶、PHLDB3兔多克隆抗体(Sigma公司所提供)。
1.3 免疫组织化学处理方式
1.3.1 脱水脱蜡 将芯片组织置于烤片机之中。在60 ℃温度环境下处理0.5 h。在此之后把切片按照先后顺序放入到下述溶液内:二甲苯1、二甲苯2、无水乙醇、浓度为95%乙醇、浓度为85%乙醇、浓度为75%乙醇。各处理10 min。在此之后利用1×PBS洗,处理时间为5 min,次数为3次。
1.3.2 抗原修复 把经过处理的组织芯片放到内含抗原的修复液容器之内。煮沸后静置2 min。冷却到室温利用1×PBS洗,时间为3 min,次数为3遍。
1.3.3 利用浓度为3%的过氧化氢封闭10~30 min。在此之后应用1×PBS洗,时间为3 min,次数为3遍。
1.3.4 实施血清封闭、一抗封闭以及二抗封闭。
1.3.5 利用辣根酶有效标记链霉卵白素工作液。并在室温环境下孵育处理0.5~1.0 h。1×PBS洗,时间为3 min,次数为3遍。
1.3.6 实施DAB染色、衬染、梯度乙醇脱水二甲苯透明。完成上述所有工作以后,自然晾干组织芯片。后使用中性树胶完成复片工作,利用扫片设备开展扫片处理。
1.4 免疫组化评分 邀请2位资深病理学家独立性行免疫组织化学评分工作。具体的评分标准共计2个,即:染色程度以及染色范围。染色程度:75%~100%染色、25%~75%染色、0%~25%染色、无染色。染色具体程度包括以下几个方面:褐色代表强、黄褐色代表适中、淡黄色代表弱、无染色。将以上标准分别赋值3分、2分、1分以及0分。最后评分为以上两项评分相乘,具体范围0~9分。为了方便实施统计工作,将最终评分分为4个级别:强阳性(+++):6~9分。阳性(++):3~5分。弱阳性(+):2分。阴性(-):0~1分。此外,将弱阳性以及阴性视为低表达,阳性以及强阳性视为高表达。
1.5 统计学处理 本试验利用SPSS 20.0统计学软件,对数据内的计数资料开展χ2检验分析,若P<0.05证实相关数据存在统计学差异。
2 结果
2.1 PHLDB3表达情况和胃癌患者病理参数间关联性 胃癌组织内的PHLDB3表达情况和AJCC分期、癌瘤浸润深度以及病理分级存在显著相关性,P<0.05;与癌细胞远处转移、淋巴结转移、年龄以及性别无相关性,P>0.05。见表1。
2.2 PHLDB3在癌旁组织以及胃癌组织内表达分析 相较于癌旁组织,PHLDB3在胃癌组织内表达阳性率明显高于癌旁组织,P<0.05。见表2。

表1 PHLDB3表达情况与胃癌患者病理参数的关系分析(n,%)
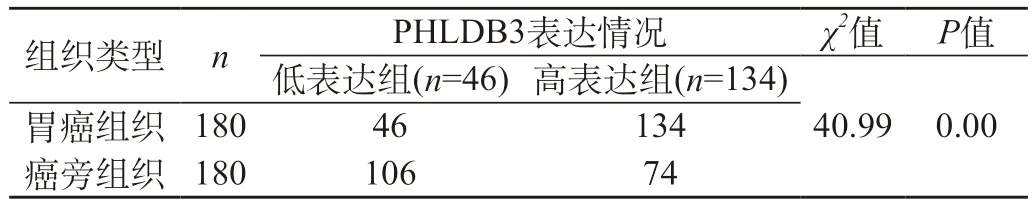
表2 PHLDB3在癌旁组织以及胃癌组织内表达分析
3 讨论
胃癌为一类临床常见病与多发病,很多胃癌患者常在中晚期被诊断。针对这些受试者而言,建议为其开展化疗[2]。目前虽然有诸多化疗药物已广泛应用于临床,但因耐药性通常会导致患者的化疗失败,尤其是多药耐药。多药耐药机制包括:细胞内积累药物再分配、药物靶点更改、DNA修复活性增强以及凋亡失活,但出现多药耐药现象的关键因素仍不明确。
PHLDB3属于LL5蛋白家族的成员之一。其和该家族的另外2个成员于pH结构域以及螺旋结构异常均有一定相似性。PHLDB3功能以往未进行深入研究[3]。但现如今诸多文献报道了对PHLDB2以及PHLDB1细胞功能的研究。如PHLDB2属于一种微管锚定因子,可有效结合CLASP参与到远端胃管末端和细胞皮质间产生相互效应[4]。PHLDB2以及PHLDB1作用在上皮细胞基底皮质,体现出层粘连蛋白-依赖微管锚定效应。值得说明的是,于细胞脂肪之内,PHLDB1能够经过其pH结构域以及PI(3、4、5)P3相互结合,且能够被视为由胰岛素引发的Akt激活正向调控因子发挥出相关效用[5]。最近临床研究证实[6],PHLDB1单核酸多态性与发生神经胶质瘤发生率之间存在一定关联度。这也代表了PHLDB1可能参与该疾病的发生发展有着至关重要的效用。另有研究表明[7],PHLDB2和食管癌以及结肠癌的发生发展存在相关性。
通过翻阅文献能够看出[8]:当前研究表明PHLDB3能够经过负反馈的方式令P53失去活性,继而加速肿瘤生长度,其可以被视为人类多类恶性肿瘤隐匿性治疗靶点。
有文献证实[9],利用一定方式下调PHLDB3表达可强化胃癌耐药细胞SGC7901/ADR针对于药物的敏感度。这也代表了PHLDB3可能参加到该疾病的多药耐药发生发展之中。在日后的研究中,可进一步探究PHLDB3参加到胃癌多药耐药隐匿性机制,以供胃癌的靶向治疗提供根本性依据。
在本次试验内,经过免疫组化法测定了PHLDB3可在癌旁组织以及胃癌组织内呈现出表达势态。本组试验研究结果表明:相较于癌旁组织,胃癌组织内PHLDB3阳性表达量明显增高,P<0.05。也验证了相关文献中所提示的PHLDB3高度表达和胃癌发生发展存在关联度[10]。另外,本组织研究表明:PHLDB3高度阳性表达和受试者的AJCC分期3期以及4期、癌瘤浸润深度水平T4以及T3与病理分级Ⅲ级、Ⅳ级呈正相关性。证实PHLDB3可能参加到了胃癌疾病的发生发展之中。可见,在日后的研究工作中有必要深入性探究其针对于胃部恶性肿瘤生物表学影响情况,同时也要有效了解PHLDB3参与到胃部恶性肿瘤发生发展的隐匿性分子机制。

