通络清脑注射粉针对脑缺血-再灌注损伤大鼠的脑保护作用及神经元自噬相关蛋白表达的影响研究
陈琰琰,张业昊,徐立,姚明江,王光蕊,宋文婷*
脑卒中是一类急性脑血管疾病,俗称“中风”,又称脑血管意外,多由脑部血管突然破裂出血或闭塞而导致血液不能有效灌注脑组织造成,可分为出血性脑卒中和缺血性脑卒中,其中缺血性脑卒中占87%[1]。缺血性脑卒中具有发病率高、致残率高、病死率高等特点,会给患者、患者家庭及社会带来沉重负担。脑缺血-再灌注损伤指脑缺血后缺血部位脑组织结构及功能遭受不同程度破坏,但再灌注后部分恢复血流供应的脑组织反而出现更严重的功能损伤,并可导致脑组织损伤加重、神经元凋亡增多[2]。
通络清脑注射粉针由三七总皂苷、黄芩苷、栀子苷组成,其中三七总皂苷的主要功效为活血止血、化瘀通络,黄芩苷和栀子苷的主要功效为清热燥湿、泻火解毒,由于三者配伍能有效清除淤堵在脑络中的“热毒”,因此通络清脑注射粉针治疗缺血性脑卒中符合中医采用清热解毒通络法治疗脑缺血的原则。既往研究表明,通络清脑注射粉针治疗脑缺血损伤的疗效确切[3],并可有效减轻星形胶质细胞肿胀[4],抑制氨基酸的过量释放[5]及肿瘤坏死因子α(TNF-α)、白介素6(IL-6)的释放,进而减轻脑缺血-再灌注损伤大鼠脑水肿症状[6],但通络清脑注射粉针的脑保护作用是否与调控神经元自噬相关,目前尚未见相关研究报道。本研究旨在探讨通络清脑注射粉针对脑缺血-再灌注损伤大鼠的脑保护作用及神经元自噬相关蛋白表达的影响,以期从神经元自噬角度阐释通络清脑注射粉针可能的脑保护作用机制。
本研究背景:
中医辨证理论认为,“中风”(缺血性脑卒中)以气虚血瘀型、毒损脑络型多见,其中毒损脑络型主要采用清热解毒通络疗法。笔者所在课题组前期研究证实,通络清脑注射粉针治疗大鼠脑缺血具有良好疗效,提示清热解毒通络疗法在只辨病、不辨证的情况下亦能取得良好疗效;鉴于细胞自噬所致神经元凋亡是脑缺血后神经损伤的重要环节,因此推测通络清脑注射粉针发挥脑保护作用的机制很可能与抑制细胞自噬有关。
本研究创新点及价值:
本研究以神经元自噬为切入点,通过分析通络清脑注射粉针对脑缺血-再灌注损伤大鼠的脑保护作用及神经元自噬相关蛋白表达的影响发现,其发挥脑保护作用的机制可能与抑制神经元过度自噬有关,这不仅为缺血性脑卒中的临床治疗提供了新的理论依据与可行思路,也在一定程度上丰富了中医药治疗缺血性脑卒中的科学内涵。
1 材料与方法
1.1 实验动物 本实验于2019年1月—2020年3月实施,共选取SPF级、体质量为200~220 g的成年雄性SD大鼠36只,均由维通利华(北京)实验动物技术有限公司提供,动物合格证号:SCXK(京)2012-0001。
1.2 药物与试剂 通络清脑注射粉针(生产厂家:河北神威药业,生产批号:111100,规格:375 mg/支);抗Beclin1抗体(Ab210498)购自美国ABCAM公司;抗自噬微管相关蛋白1轻链3A/3B(LC3A/LC3B)抗体(12741S)、抗磷酸化核因子-κB(p-NF-κB)抗体(3033S)、抗核因子-κB(NF-κB)抗体(8242S)均购自美国CST公司;抗β-actin抗体(AF7012)、电泳缓冲液(HX1896)、转膜液(HX1895)、羊抗兔二抗(HX2040)、羊抗鼠二抗(HX2032)、蛋白酶抑制剂(HX1863)、蛋白磷酸酶抑制剂(HX1864)、强效放射性免疫沉淀法分析(RIPA)裂解液(HX1862)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)非还原性蛋白上样缓冲液(HXN1891)、牛血清白蛋白(Albumin Bovine V)(HX3304)购自华兴博创基因技术有限公司;预染蛋白(Thermo26620)、电化学发光法(ECL)超敏发光液(Thermo34095)购自美国赛默飞公司。
1.3 仪器与设备 奥豪斯AR2130型电子天平,感量:1 mg;尼龙栓线(2432-A1)(北京西浓科技有限公司);Synergy 4型酶标仪;多媒体彩色病理图文分析系统(MPIAS-500);IEC低温冷冻离心机(美国Thermo公司);电子显微镜H-7500(日本日立家电有限公司);转移电泳槽(Mini Trans-Blot Transfer Cell,BIO-RAD公司);垂直板电泳槽(Mini-PROTEAN3 cell,BIO-RAD公司);DYY-10型电泳仪(北京六一仪器厂);TS-1型脱色摇床(江苏海门市麒麟医用仪器厂);Bio-Rad凝胶成像仪(BIO-RAD公司);Bio-Rad Image LabTM XRS+凝胶图像分析管理系统(BIO-RAD公司);Image J图像分析软件(美国国立卫生研究院)。
1.4 动物分组与造模方法 将36只SD大鼠编号后采用随机数字表法分为假手术组、模型组、通络清脑组,每组12只。采用线栓法制备大鼠脑缺血-再灌注损伤模型(假手术组大鼠只进行血管分离、不进行其他操作):(1)采用4.0%水合氯醛(100 mg/kg)经腹腔注射进行麻醉,麻醉满意后使大鼠取仰卧位并固定于恒温电热毯上,温度维持在37 ℃左右;(2)分离右侧颈总动脉、颈内动脉及颈外动脉并采用丝线打活结以结扎颈外动脉、颈总动脉,使之暂时阻断,并采用动脉夹夹闭颈内动脉远心端;(3)于颈外动脉做 “V”形切口,插入直径约为0.24 mm、一端为光滑球形的尼龙线栓,直至有明显阻力(表明尼龙线栓已到达大脑中动脉起始部),一般插入深度为(20.0±0.5)mm,可造成大鼠大脑中动脉阻塞性缺血;(4)采用0.9%氯化钠溶液将通络清脑注射粉针配制成浓度为18.75 mg/ml的溶液,通络清脑组大鼠经尾静脉缓慢推注该通络清脑溶液3.2 ml/kg,假手术组和模型组大鼠经尾静脉缓慢推注等体积0.9%氯化钠溶液;(5)1.5 h后向外轻拉尼龙线栓,至略有阻力后停止提拉以实现再灌注。
1.5 观察指标
1.5.1 神经功能学评分 采用单盲法、ZeaLonga评分标准评估三组大鼠建模24 h后神经功能:无神经损伤症状计0分;不能完全伸展脑缺血对侧前肢计1分;出现向脑缺血对侧转圈行为计2分;行走向脑缺血对侧倾倒计3分;不能自发行走、处于昏迷状态计4分。剔除神经功能学评分为0、4分(除外假手术组)及死亡大鼠,并在后续实验中选择同批次购买的体质量接近的大鼠补足实验动物数量,维持每组大鼠数量为12只。
1.5.2 脑梗死体积占比 完成ZeaLonga评分后从每组各选取4只大鼠,麻醉后经腹主动脉取血、安乐死后断头取脑,采用0.9%氯化钠溶液涮去表面血污、置于冰上并将其平均切成5个脑片;将脑片置于2,3,5-氯化三苯基四氮唑(TTC)染液中进行染色,37 ℃条件下避光孵育15 min后采用磷酸盐缓冲液(PBS)终止孵育;将染色(TTC可与活细胞线粒体中的琥珀酸脱氢酶反应而将非缺血区染成玫瑰红色,缺血区则为苍白色)后的脑片置于4%甲醛溶液中进行固定,采用多媒体彩色病理图文分析系统进行拍照、记录,采用Image J图像分析软件进行分析并计算脑梗死体积占比。
1.5.3 海马区神经元损伤情况 再灌注24 h后从每组各选取4只大鼠并采用HE染色法观察海马区神经元损伤情况。HE染色法:经腹腔注射4%水合氯醛麻醉大鼠,安乐死后断头取脑并置入固定液中固定24 h以使细胞蛋白质变性;固定完成后对脑组织进行修剪并将修剪后的脑组织置于包埋盒内,先采用蒸馏水进行冲洗以去除脑组织中的固定液,再依次行脱水、透明、石蜡包埋、切片;切片先采用二甲苯脱蜡,再采用梯度浓度乙醇复水、蒸馏水冲洗、苏木素染液染色15 min;采用自来水洗去切片上的苏木素染液后以1%盐酸乙醇分化15 s并置于自来水中浸泡10 min,之后取出切片并置入伊红染液中染色3 min,再之后采用蒸馏水冲洗3 s并置入梯度浓度乙醇内脱水,最后采用二甲苯透明及中性树胶封片。
1.5.4 海马区和皮质区自噬体形成情况、海马区神经元自噬相关蛋白表达情况 再灌注24 h后从每组各选取4只大鼠并进行安乐死、断头取脑,于海马区和皮质区距缺血中心外侧缘1 mm处取一米粒大小脑组织并置于2.5%戊二醛溶液中固定2 h,采用PBS终止固定后再采用1%锇酸溶液固定1 h、PBS终止固定;将固定好的脑组织小块进行丙酮梯度脱水及环氧树脂梯度渗透、包埋,并进行超薄切片;采用醋酸双氧铀和柠檬酸铅对切片进行染色并由不知晓实验设计的研究人员在透射显微镜下观察细胞超微结构及视野中完整的自噬体。
同时称取三组大鼠海马区脑组织(100±5)mg,采用免疫印迹法(Western-bloting)检测海马区神经元自噬相关蛋白表达情况,具体操作如下:(1)将称取的海马区脑组织分别先置于编有序号的Eppendorf微量离心管(EP)管内并加入强效RIPA裂解液1 ml、蛋白酶抑制剂20 μl、蛋白磷酸酶抑制剂10 μl,再置于冰上并进行超声裂解;(2)裂解充分后置于IEC低温冷冻离心机并在4 ℃条件下以12 000 r/min(离心半径84 mm)的速率离心5 min,取上清液;(3)采用bradford法进行蛋白定量,即将蛋白加入5×上样缓冲液并斡旋混匀、100 ℃水浴加热3 min使蛋白变性,之后置于-80 ℃冰箱保存或直接进行实验操作;(4)采用聚丙烯酰胺凝胶将蛋白样品进行电泳分离并转膜至聚偏二氟乙烯(PVDF)膜上;(5)采用5% Albumin Bovine V封闭液封闭1 h,加入采用5% Albumin Bovine V配置的一抗、β-actin抗体(1∶5 000)、Beclin1抗体(1∶2 000)、LC3A/LC3B抗体(1∶2 000)、p-NF-κB抗体(1∶1 000)、NF-κB抗体(1∶2 000),之后置于摇床并在4 ℃条件下孵育过夜,采用含有0.05%吐温20的磷酸盐缓冲液(PBST)漂洗5次(5 min/次)并加入二抗、山羊抗兔辣根过氧化物酶免疫球蛋白IgG-HRP(1∶10 000)、山羊抗鼠 IgG-HRP(1∶10 000),再置于摇床并在室温条件下孵育1.5 h,最后采用PBST漂洗5次(5 min/次);(6)采用ECL超敏发光液、Bio-Pro凝胶成像仪进行显色成像,并采用Bio-Rad Image LabTM XRS+凝胶图像分析管理系统分析蛋白条带灰度值,计算各组大鼠目的蛋白p-NF-κB、Beclin1、LC3相对表达量,即p-NF-κB灰度值与NF-κB灰度值比值、Beclin1灰度值与内参β-actin灰度值比值、LC3灰度值与LC3B灰度值比值。上述操作每组重复4次(每只大鼠操作1次)取平均值。
1.6 统计学方法 采用SPSS 16.0统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能学评分 建模24 h后假手术组、模型组、通络清脑组大鼠神经功能学评分分别为0、(2.3±0.8)、(1.6±0.5)分;三组大鼠建模24 h后神经功能学评分比较,差异有统计学意义(F=5.34,P=0.010),提示脑缺血-再灌注损伤模型制备成功。模型组、通络清脑组大鼠建模24 h后神经功能学评分高于假手术组(q值分别为0.30、0.50,P值分别为0.001、0.001),而通络清脑组大鼠建模24 h后神经功能学评分低于模型组(q=0.50,P=0.020),差异有统计学意义。
2.2 脑梗死体积 建模24 h后假手术组大鼠脑组织呈均匀玫瑰红色,未见苍白缺血区;模型组大鼠脑组织可见苍白缺血区,通络清脑组大鼠脑组织苍白缺血区明显减少(见图1)。建模24 h后假手术组、模型组、通络清脑组大鼠脑梗死体积占比分别为0、(25.17±6.12)%、(15.62±4.83)%。三组大鼠建模24 h后脑梗死体积占比比较,差异有统计学意义(F=4.26,P<0.05);模型组、通络清脑组大鼠建模24 h后脑梗死体积占比高于假手术组(q值分别为0.26、0.35,P值分别为0.001、0.001),而通络清脑组大鼠建模24 h后脑梗死体积占比低于模型组(q=0.40,P=0.040),差异有统计学意义。

图1 三组大鼠脑组织TTC染色结果Figure 1 TTC staining results of cerebral tissues among the three groups of rats
2.3 海马区神经元损伤情况 再灌注24 h后假手术组大鼠海马区神经元排列紧密、数量丰富、形态正常,胞质淡染,胞核大而圆,未见明显坏死;模型组大鼠海马区缺血区神经元结构破坏严重,大量神经元丢失,胞质嗜伊红浓染,胞核固缩;与模型组相比,通络清脑组大鼠海马区缺血区神经元坏死范围缩小,神经元增多,细胞结构相对完整,胞核固缩减少,神经元损伤明显缓解(见图2~3)。

图2 三组大鼠再灌注24 h后海马区神经元损伤情况(HE染色,×100)Figure 2 Neuron injury in hippocampus among the three groups of rats 24 hours after reperfusion

图3 三组大鼠再灌注24 h后海马区神经元损伤情况(HE染色,×200)Figure 3 Neuron injury in hippocampus among the three groups of rats 24 hours after reperfusion
2.4 海马区和皮质区自噬体形成情况 再灌注24 h后假手术组大鼠海马区和皮质区均偶见自噬体,胞质内有少量空泡;模型组大鼠海马区和皮质区均可见双层膜结构自噬体,胞质内有大量空泡且胞质稀疏;通络清脑组海马区和皮质区自噬体数量均减少,胞质内有少量空泡且胞质稀疏(见图4~5)。

图4 三组大鼠再灌注24 h后海马区自噬体形成情况Figure 4 Autophagy bodies in hippocampus(indicated by the arrowhead)among the three groups of rats 24 hours after reperfusion

图5 三组大鼠再灌注24 h后皮质区自噬体形成情况(箭头所指处)Figure 5 Autophagy bodies in cortex(indicated by the arrowhead)among the three groups of rats 24 hours after reperfusion
2.5 海马区神经元自噬相关蛋白表达情况 再灌注24 h后三组大鼠海马区p-NF-κB、Beclin1、LC3相对表达量比较,差异有统计学意义(P<0.001);再灌注24 h后模型组、通络清脑组大鼠海马区p-NF-κB(q值分别为29.29、9.01)、LC3相对表达量(q值分别为29.56、11.89)及模型组Beclin1相对表达量(q=12.38)高于假手术组,差异有统计学意义(P<0.01),而通络清脑组与假手术组大鼠海马区Beclin1相对表达量比较,差异无统计学意义(q=2.85,P>0.05);再灌注24 h后通络清脑组大鼠海马区p-NF-κB(q=20.28)、Beclin1(q=9.53)、LC3(q=17.67)相对表达量低于模型组,差异有统计学意义(P<0.01,见表1、图6)。

图6 三组大鼠海马区自噬相关蛋白电泳图Figure 6 Electrophoretogram for autophagy related proteins in hippocampus among three groups of rats
表1 三组大鼠再灌注24 h后海马区神经元自噬相关蛋白相对表达量比较(±s)Table 1 Comparison of expressions of neuronic autophagy-related proteins in hippocampus among three groups of rats 24 hours after reperfusion
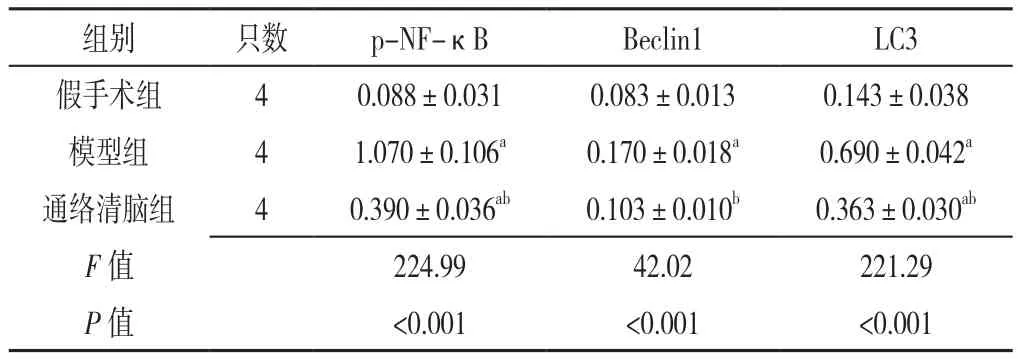
表1 三组大鼠再灌注24 h后海马区神经元自噬相关蛋白相对表达量比较(±s)Table 1 Comparison of expressions of neuronic autophagy-related proteins in hippocampus among three groups of rats 24 hours after reperfusion
注:p-NF-κB=磷酸化核因子-κB,LC3=自噬微管相关蛋白1轻链3;与假手术组比较,aP<0.01;与模型组比较,bP<0.05
组别 只数 p-NF-κB Beclin1 LC3假手术组 4 0.088±0.031 0.083±0.013 0.143±0.038模型组 4 1.070±0.106a 0.170±0.018a 0.690±0.042a通络清脑组 4 0.390±0.036ab 0.103±0.010b 0.363±0.030ab F值 224.99 42.02 221.29 P值 <0.001 <0.001 <0.001
3 讨论
中医学理论认为,缺血性脑卒中属“中风”范畴,主要由“痰瘀”而引发[7]:“痰”“淤”相互转化、消长,津液凝滞则生浊痰,浊痰久积入脉则生淤血,痰淤内阻脉络而生郁热,津血过热则浊,浊而凝滞又生痰;痰闭神窍、脉络阻塞、气血上冲于脑而引发“中风”。因此,“中风”的治疗应以活血化瘀为主,以通畅血脉、消散瘀滞;辅以清热利湿之药,以清泄体内郁热、通调水道,祛除湿热痰邪。三七具有活血化瘀、养血定痛功效,黄芩具有清热燥湿、凉血解毒功效,栀子具有清热利湿、泻火除烦功效,三者配伍可用于消除“中风”患者痰、淤、郁热等;通络清脑注射粉针主要有效成分三七总皂苷、黄芩苷、栀子苷即分别来自三七、黄芩、栀子。现代药理学表明,通络清脑注射粉针具有改善血液循环、抑制血栓形成、减轻神经元损伤等作用,其中三七总皂苷不仅可改善血瘀大鼠血液流变学指标[8]、减轻Ca2+超载[9],还可修复阿尔茨海默病大鼠受损神经元[10];黄芩苷可抑制脑缺血-再灌注损伤大鼠神经元凋亡,减轻氧化应激反应所致损伤[11],清除自由基[12];栀子苷可抑制血小板聚集[13]。
及时恢复缺血脑组织血液供应是目前临床治疗缺血性脑卒中的主要方法,但缺血半暗带血流供应恢复反而会使缺血脑组织神经元损伤加重、凋亡增多,造成脑缺血-再灌注损伤。脑缺血-再灌注损伤是缺血性脑卒中患者重要的病理生理过程,也是影响缺血性脑卒中患者预后的不可忽略的问题之一[14]。本研究结果显示,建模24 h后假手术组大鼠脑组织未见苍白缺血区且再灌注24 h后海马区神经元未见明显坏死,而建模24 h后模型组大鼠脑组织可见苍白缺血区且再灌注24 h后海马区缺血区神经元结构破坏严重、大量神经元丢失,但建模24 h后通络清脑组大鼠脑组织苍白缺血区明显减少且再灌注24 h后海马区缺血区神经元坏死范围明显缩小、神经元损伤明显缓解;同时,模型组、通络清脑组大鼠建模24 h后神经功能学评分、脑梗死体积占比均高于假手术组,而通络清脑组大鼠建模24 h后神经功能学评分、脑梗死体积占比均低于模型组,提示通络清脑注射粉针可有效改善脑缺血-再灌注损伤大鼠神经功能,减轻脑梗死程度、神经元损伤,减少自噬体形成及神经元凋亡,具有一定脑保护作用。
细胞自噬指自噬溶酶体对胞内异物、受损或衰老的细胞器进行吞噬、降解的过程,对维持细胞稳态具有重要作用。正常情况下细胞自噬处于较低水平,在缺血缺氧、营养缺乏及氧化应激等情况下细胞自噬水平明显升高以清除自由基、受损细胞器及未折叠蛋白,但细胞自噬的过度激活会启动神经元凋亡,即由半胱天冬酶介导的程序性细胞死亡[15]。近年研究表明,细胞自噬参与了脑缺血的病理生理过程[16]。本研究结果显示,再灌注24 h后假手术组大鼠海马区和皮质区均偶见自噬体,而模型组大鼠海马区和皮质区均可见双层膜结构自噬体,但通络清脑组大鼠海马区和皮质区自噬体数量均较模型组减少,提示正常大鼠脑组织存在细胞自噬,脑缺血-再灌注损伤会激活大鼠神经元自噬并促使其神经元凋亡,而通络清脑注射粉针可抑制脑缺血-再灌注损伤大鼠神经元自噬的过度激活,减少神经元凋亡。
自噬相关蛋白是在自噬相关基因(ATG)调控下转录、合成的一组参与自噬体形成至降解全过程的蛋白质,其主要作用是调控细胞自噬过程。ATG最早于酵母菌中被发现,目前为止已在哺乳动物细胞中发现11种ATG同源基因,其中ATG6被命名为Beclin1,而ATG8被命名为LC3[17]。Beclin1是首个被发现的参与哺乳动物细胞自噬的关键因子,后发现其也参与了自噬体膜的形成、对细胞自噬具有正向调控作用;有研究表明,脑缺血-再灌注损伤大鼠神经元内Beclin1表达量明显上调并可激活细胞自噬,诱导细胞凋亡[18]。LC3主要以LC3A和LC3B两种形式存在,正常情况下细胞内LC3以胞质不溶性LC3A的形式存在,细胞自噬时LC3A与磷脂酰乙醇胺结合成为LC3B并参与自噬体膜形成,且LC3B含量与自噬体数量呈正比,因此,LC3B含量可在一定程度上反映细胞自噬程度[19]。既往研究表明,脑缺血-再灌注损伤大鼠神经元自噬增强,缺血区脑组织LC3B表达明显上调,并会于缺血再灌注24 h时达到峰值[20-21]。现阶段,Beclin1、LC3B被认为是细胞自噬的特异性标志物[22],且其表达量可反映细胞自噬水平。NF-κB是一类能通过与细胞内特异性核苷酸序列结合而启动基因转录、表达的蛋白质,缺血、缺氧刺激均会促使游离NF-κB进入胞核并参与调控细胞自噬,进而使Beclin1、LC3表达上调并诱导细胞自噬[23]。
有研究表明,缺血预处理及脑缺血早期诱导神经元自噬有利于消除积累在神经元内的受损蛋白,提高神经元存活率,有利于减轻脑缺血-再灌注损伤[24],但细胞自噬是把“双刃剑”,其对脑缺血-再灌注损伤的影响还会受造模时间、缺血阶段、观察部位、给药剂量等的影响;另有研究表明,抑制脑缺血后的过度神经元自噬是具有保护作用的,而清热类药物可通过抑制神经元自噬而发挥脑保护作用,犀角地黄汤、葛根可通过下调Beclin1、LC3的表达而抑制神经元自噬、减轻脑缺血再灌注所致神经元损伤[25-26]。本研究结果显示,模型组、通络清脑组大鼠海马区p-NF-κB、LC3相对表达量及模型组Beclin1相对表达量高于假手术组,通络清脑组大鼠海马区p-NF-κB、Beclin1、LC3相对表达量低于模型组,提示脑缺血-再灌注损伤大鼠神经元自噬水平升高,而通络清脑注射粉针可有效抑制脑缺血-再灌注损伤大鼠神经元的过度自噬,缓解脑缺血-再灌注损伤,这可能是通络清脑注射粉针发挥脑保护作用的重要机制。
综上所述,通络清脑注射粉针可有效改善脑缺血-再灌注损伤大鼠神经功能,减轻脑梗死程度、神经元损伤,减少自噬体形成及神经元凋亡,抑制神经元自噬相关蛋白p-NF-κB、Beclin1、LC3的表达,其发挥脑保护作用的机制可能与抑制神经元过度自噬有关,但本研究未设置阳性对照组(自噬抑制剂组),今后的实验中可增设阳性对照组以进一步阐明通络清脑注射粉针脑保护作用与抑制神经元过度自噬的相关性。
作者贡献:陈琰琰进行文章的构思与设计,文献资料收集与整理,撰写论文;张业昊、徐立、姚明江、王光蕊提供实验技术支持;宋文婷负责实验的可行性分析、文章质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

