2型糖尿病患者心脏代谢指数与非酒精性脂肪性肝病的关系研究
李彦彦,赵丽,邓霞,朱转转,郭畅,夏虹,戴梅清,于凡,尹卫,王东,杨玲,袁国跃
近年来,随着人们生活水平的不断提高,2型糖尿病(T2DM)及非酒精性脂肪性肝病(NAFLD)等代谢性疾病的发生率逐年攀升,既往研究显示,已诊断的T2DM患者NAFLD发生率为57%~80%[1]。最近一项Meta分析纳入来自20个国家近5万例T2DM患者,结果显示全球T2DM患者NAFLD发病率约为55.5%,欧洲地区则高达68.0%[2]。T2DM与NAFLD的共存不仅促进了肝脏疾病的进展,更加重了T2DM患者肝脏和外周胰岛素抵抗程度并加剧致动脉粥样硬化性血脂异常,增加了T2DM患者心血管事件及肾脏病变等发生风险[3-4]。因此,临床应充分重视T2DM合并NAFLD的及时筛查以便后续开展干预和治疗[3]。近年来有研究提出心脏代谢指数(CMI)在糖尿病预测方面具有良好价值[5],后续研究也指出CMI与动脉粥样硬化、缺血性脑卒中、高血压、左心室及肾功能异常等相关[6-7],证明其在代谢性疾病筛查中具有一定意义。然而,目前尚无研究探讨CMI与NAFLD的关联,为此,本研究拟在T2DM患者中初步探讨CMI和NAFLD的关系,以期为临床工作者特别是基层医务工作者快速筛查T2DM患者中的NAFLD高危者或进行风险评估提供参考依据。
1 对象与方法
1.1 研究对象 选取2018年5月—2020年3月于江苏大学附属医院就诊的T2DM患者501例,其中男276例(55.1%),女225例(44.9%)。T2DM患者均符合1999年世界卫生组织(WHO)颁布的糖尿病诊断标准[8]。依据超声检查结果将患者分为NAFLD组以及非NAFLD组(non-NAFLD组)。排除标准:(1)存在病毒性肝炎、药物性肝病、肝豆状核变性、自身免疫性肝病、血吸虫性肝病及肝硬化等;(2)过度饮酒(饮酒量:男性>40 g/d、女性>20 g/d持续5年,或>80 g/d超过2周);(3)存在糖尿病急性并发症;(4)口服降脂药和糖皮质激素等;(5)存在急性感染、恶性肿瘤、甲状腺功能亢进症;(6)资料收集不全。本研究通过江苏大学附属医院伦理委员会批准,受试者均知情同意。
1.2 方法 由专业人员收集研究对象的性别、年龄、T2DM病程、高血压病史、吸烟史(既往或目前吸烟均记为吸烟),测量身高、体质量、舒张压(DBP)、收缩压(SBP)等,并计算体质指数(BMI)、腰高比(WHtR),采用欧姆龙内脏脂肪检测装置HDS-2000进行内脏脂肪面积(VFA)及皮下脂肪面积(SFA)测量,并计算内脏与皮下脂肪面积比值(VSR)。隔夜禁食8~10 h后,次日早晨采集空腹血,采用酶法检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平,并计算CMI;采用γ-谷酰胺-3-羧基-4-硝基苯胺法检测谷氨酰转肽酶(GGT),使用全自动生化仪检测血清尿酸(UA),使用高效液相层析法检测糖化血红蛋白(HbA1c)、葡萄糖氧化酶法检测空腹血糖(FPG)、化学发光法检测空腹C肽(FC-P)及空腹胰岛素(FINS),并计算稳态模型评估胰岛素抵抗指数(HOMA-IR)。
1.3 指标计算方法 BMI(kg/m2)=体质量(kg)/身高2(m2);WHtR=腰围(cm)/身高(cm);CMI=TG(mmol/L)/HDL-C(mmol/L)×WHtR;VSR=VFA(cm2)/SFA(cm2);HOMA-IR=FPG(mmol/L)×FINS(μU/ml)/22.5。
1.4 观察指标 比较NAFLD组和non-NAFLD组患者临床资料。按照CMI三分位数法将患者分为T1组(CMI<0.765)、T2 组(CMI 0.765~1.375)、T3 组(CMI>1.375),每组167例;比较三组患者NAFLD发生率。分析CMI与其余临床指标的相关性,探究T2DM患者发生NAFLD的影响因素及CMI对T2DM患者发生NAFLD的预测价值。
1.5 统计学方法 采用SPSS 22.0统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann WhitneyU检验;计数资料以相对数表示,组间比较采用χ2检验。相关性分析采用Pearson相关分析或Spearman秩相关分析。运用二分类Logistic回归分析探究T2DM患者发生NAFLD的影响因素,使用受试者工作特征(ROC)曲线分析CMI、CMI联合BMI对T2DM患者发生NAFLD的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料的比较 501例患者中NAFLD组336例,non-NAFLD组165例,NAFLD发生率为67.1%。两组患者性别、有吸烟史者所占比例、SBP、LDL-C、HbA1c、FPG比较,差异无统计学意义(P>0.05);NAFLD组患者年龄低于non-NAFLD组,T2DM病程短于non-NAFLD组,有高血压病史者所占比例、DBP、BMI、VFA、SFA、VSR、ALT、AST、TG、TC、GGT、UA、FC-P、FINS、HOMA-IR、CMI高于non-NAFLD组,HDL-C低于non-NAFLD组,差异有统计学意义(P<0.05,见表1)。
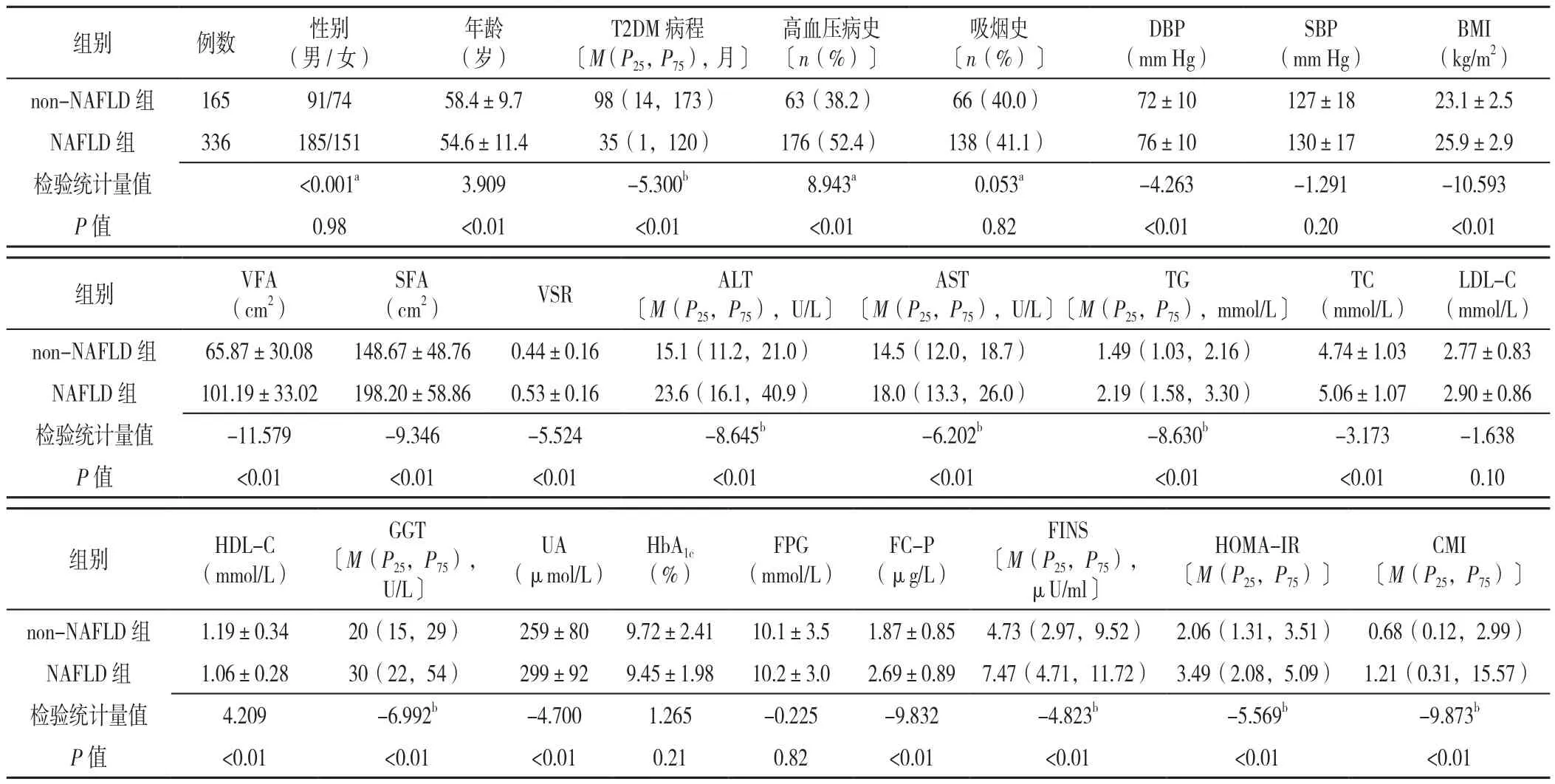
表1 两组临床资料比较Table 1 Comparison of clinical characteristics between T2DM patients with and without NAFLD
2.2 T1组、T2组、T3组患者NAFLD发生率比较 T1组、T2组、T3组患者NAFLD发生率分别为46.1%(77/167)、70.1%(117/167)、85.0%(142/167);三组患者NAFLD发生率比较,差异有统计学意义(χ2=58.287,P<0.01);其中T2组、T3组患者NAFLD发生率高于T1组,差异有统计学意义(χ2值分别为19.676、56.031,P值均<0.01);T3组患者NAFLD发生率高于T2组,差异有统计学意义(χ2=10.746,P=0.001)。
2.3 CMI与其余临床指标的相关性分析 CMI与DBP、BMI、VFA、SFA、VSR、ALT、AST、TC、GGT、UA、FPG、FC-P、FINS、HOMA-IR呈正相关(P<0.05),与年龄、T2DM病程呈负相关(P<0.05,见表2)。
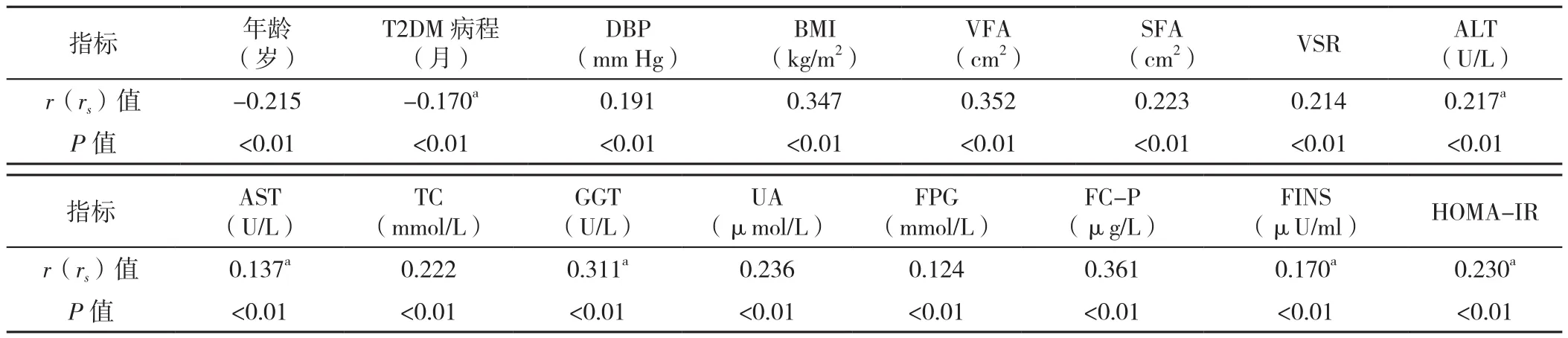
表2 T2DM患者CMI与其余临床指标的相关性分析Table 2 Correlation analysis of CMI and clinical variables in T2DM patients
2.4 T2DM患者发生NAFLD影响因素的二分类Logistic回归分析 以T2DM患者是否发生NAFLD为因变量,以表1中差异有统计学意义且临床常见的危险因素为自变量(赋值见表3),进行二分类Logistic回归分析,结果显示,T2DM病程、BMI、FC-P、CMI是T2DM患者发生NAFLD的影响因素(P<0.05,见表4)。

表3 T2DM患者发生NAFLD影响因素的二分类Logistic回归分析赋值Table 3 Assignment of factors potentially associated with NAFLD risk in T2DM patients included in binary Logistic regression analysis
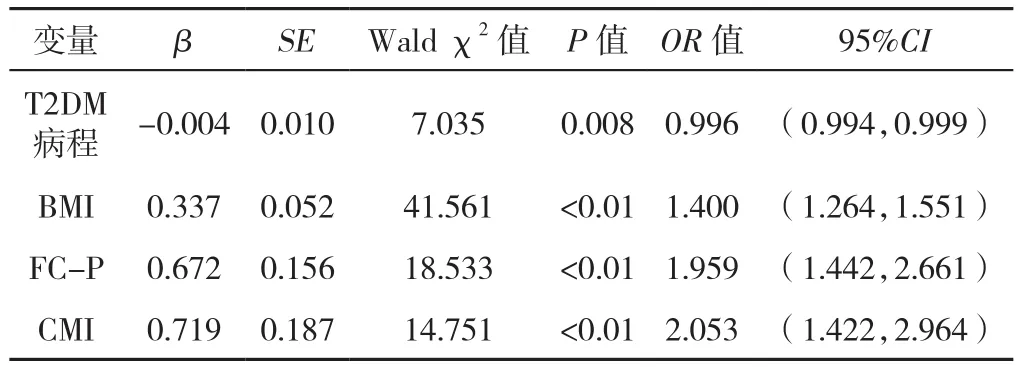
表4 T2DM患者发生NAFLD影响因素的二分类Logistic回归分析Table 4 Binary Logistic regression analysis of factors potentially associated with NAFLD risk in T2DM patients
2.5 CMI、CMI联合BMI对T2DM 患者发生 NAFLD的预测价值 绘制CMI预测T2DM患者发生NAFLD的ROC曲线,结果显示,CMI预测T2DM患者发生NAFLD的ROC曲线下面积为0.738〔95%CI(0.691,0.784),P<0.01〕,最佳截断值为0.692,灵敏度、特异度分别为83.6%、51.5%(见图1)。
参考相关文献[9-10],采用CMI联合BMI对T2DM患者发生NAFLD进行预测,以T2DM患者发生NAFLD为因变量,以CMI、BMI为自变量,采用二分类Logistic回归分析构建回归方程,拟合方程Log(P)=-9.103+0.938×CMI+0.358×BMI,并绘制CMI联合BMI预测T2DM患者发生NAFLD的ROC曲线,结果显示,CMI联合BMI预测T2DM患者发生NAFLD的ROC曲线下面积为 0.816〔95%CI(0.776,0.856),P<0.01〕,灵敏度、特异度分别为84.2%、64.8%(见图1)。
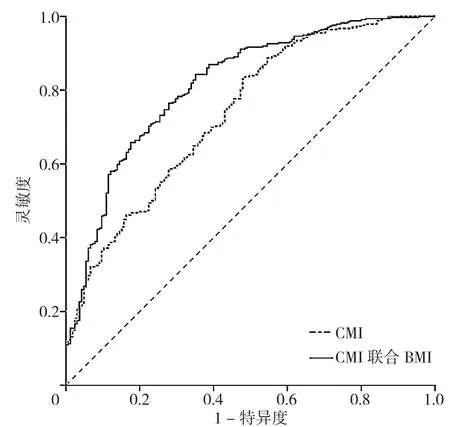
图1 CMI及CMI联合BMI预测T2DM患者发生NAFLD的ROC曲线Figure 1 ROC curve analysis of the predictive value of CMI and CMI combined with BMI for NAFLD in patients with T2DM
3 讨论
本研究初步探讨了CMI对T2DM患者NAFLD发生风险的评估及预测价值。本研究中T2DM患者NAFLD发生率为67.1%,与现有流行病学调查结果所示57%~80%相符[1-2]。本研究显示,NAFLD组较non-NAFLD组患者糖脂代谢紊乱更为明显;随着CMI的增加,T2DM患者NAFLD的发生率增高。
有研究显示,NAFLD及T2DM与血脂异常、腹型肥胖、胰岛素抵抗(IR)密切相关[11]。CMI是2015年WAKABAYASHI等[5]提出的一种新型指数,其由临床易于获得的WHtR及TG/HDL-C计算而得,依据CMI计算公式可知该指标各组分均属于代谢综合征(MS),且兼顾了血脂及腹型肥胖指标。本研究结果显示,CMI与VFA、SFA以及FPG、HOMA-IR等糖脂代谢指标存在相关性;二分类Logistic回归分析结果显示,CMI是T2DM患者NAFLD的影响因素,同时ROC曲线分析结果提示CMI预测T2DM患者发生NAFLD具有较好的价值。NAFLD与T2DM密切相关且常并存,目前IR被认为是NAFLD与T2DM共同的重要发病机制[2]。尽管CMI与NAFLD之间的联系尚不清楚,根据现有研究结果,考虑可能主要是IR介导两者间的联系。既往研究已证实腹部脂肪、TG/HDL-C与IR密切相关[12],腹型肥胖患者的葡萄糖及脂质氧化水平较高,游离脂肪酸(FFA)释放量明显增高[13],当FFA超过外周脂肪储存库的缓冲能力即可造成肝脏脂肪蓄积[14],导致IR及NAFLD的发生发展。另有研究结果显示,IR可以促进极低密度脂蛋白及TG的大量分泌[15],降低HDL-C的水平。此外,有研究表明IR可通过诱导脂肪组织TG的分解和肝内TG从头合成来促进NAFLD的发生[16]。以上结果提示CMI是T2DM患者合并NAFLD发生风险的良好评估指标。此外,本研究结果还显示BMI是T2DM患者发生NAFLD的影响因素,考虑BMI计算简便,且参考相关文献[9-10],故本研究联合CMI与BMI对NAFLD进行预测,结果显示,CMI联合BMI预测T2DM患者发生NAFLD的ROC曲线下面积为0.816,提示CMI联合BMI对T2DM患者发生NAFLD具有良好的预测价值。
本研究结果显示,FC-P是T2DM患者发生NAFLD的影响因素。近年来有研究指出C肽与NAFLD密切相关[17],考虑可能与IR及C肽本身生物功能有关[18]。有研究结果显示C肽可调节PPAR-γ的表达,从而导致脂质蓄积[19];同时C肽可剂量依赖性地促进一氧化氮(NO)的释放,过量的NO则通过与超氧阴离子结合产生硝基酪氨酸,从而影响脂代谢[20];此外,还有研究表明C肽可能通过磷脂酰肌醇激酶-3或蛋白激酶B途径参与调节瘦素和内脏脂肪素的分泌,从而影响机体能量代谢[21]。本研究结果显示,T2DM病程是T2DM患者发生NAFLD的影响因素,即长病程T2DM患者发生NAFLD发生率较低。结合本研究中受试人群特点考虑,老年患者脂肪组织储存脂肪能力差[22-23]、肝脏纤维化比例升高[24]、常接受更长久的T2DM干预与治疗及高死亡率造成的选择差异[22]均可能对结果造成一定影响。
本研究尚存在一定的局限性:首先,本研究为横断面研究和小样本设计,无法明确因果关系,需要进行大规模、前瞻性研究;其次,研究中NAFLD的诊断并非是肝脏穿刺病理活检结果,所以无法区分单纯性NAFLD及非酒精性脂肪性肝炎(NASH),可能对研究结果造成一定影响;最后,受试者药物使用情况无详细登记,且受试者主要来自住院患者,存在选择偏倚。
综上所述,CMI是T2DM患者发生NAFLD的影响因素,且CMI联合BMI对NAFLD具有良好的预测价值,提示对于T2DM患者,可使用上述简便易得的指标初步判断患者NAFLD的发生风险,但仍有待在更大样本人群及前瞻性研究中进一步研究CMI对于NAFLD的预测价值。
作者贡献:李彦彦、袁国跃提出研究构思;王东、杨玲、袁国跃进行可行性分析、研究指导;李彦彦、朱转转、郭畅、夏虹、戴梅清、于凡、尹卫参与数据采集、整理;李彦彦负责统计分析及撰写论文;赵丽、邓霞、袁国跃进行写作指导及论文修订。
本文无利益冲突。

