围术期应用肠内营养制剂对消化道肿瘤患者术后营养及恢复的影响
陈垂丽 翁少文 符致明 赵居云 吴嫚
肠内营养(enteral nutrition,EN)是指通过口服或管饲管方式经肠道提供代谢需要的热量及营养物质,它是可以不经过消化而直接吸收的高营养饮食,即使在没有消化液的情况下,也能由小肠完全吸收,其特点是:营养价值高,营养成分均衡全面,成分明确,无渣滓,含纤维素,排便少携带方便,易保存,肠内营养以利于维护肠黏膜完整性,并发症少,技术要求低,价格低廉等[1]。营养的重要性及必要性早为人们所熟知,营养对于疾病的治疗和预后起着相当大的作用,无论在传统医学或现代医学中都强调着营养。肠内营养和肠外营养被认为是营养支持的两大支柱。肠外营养曾一度被人们认为是万能的营养良方。但随着营养支持的理论和实践的不断完善,人们对胃肠道功能认识的不断加深,肠内营养的优势逐渐显现出来。由于其具有价廉、安全、有效、合乎生理、操作简便、易于推广且能改善肠黏膜的屏障功能、等优点,已成为外科临床营养支持的首选途径[2]。研究证实肠内营养不但有供给营养的作用,且能改善肠黏膜的屏障功能。于是,肠外营养逐渐转向为肠内营养多于肠外营养。营养治疗对于肿瘤患者尤为重要,消化道恶性肿瘤是我国最常见的恶性肿瘤之一,2015年胃癌和结直肠癌在我国恶性肿瘤发病率分别是第二和第三位,死亡率分别达到21.16% 和13.61%[3]。成为影响中国人民身体健康的常见恶性肿瘤。消化道恶性肿瘤患者常伴有营养不良,不同部位肿瘤营养不良的发生率分别为:结肠癌75.81% 、食管癌63.24% 、胃癌62.40% 、直肠癌60.27%[4]。如果患者术后营养不良将对临床结果有直接的影响,延长住院时间,增加住院费用,出现相关的并发症,如吻合口瘘的危险性增加,并降低手术耐受性,最终影响患者的生存时间和生活质量[5]。本研究旨在通过回顾性研究进行探讨围术期的营养管理,应用肠内营养制剂对消化道恶性肿瘤患者术后营养评价指标及术后恢复发展情况的影响。
1 资料与方法
1.1 一般资料
回顾性调查2019年1-12月在海南省人民医院胃肠外科的消化道恶性肿瘤患者60例作为本次研究对象。纳入标准:(1)术前病理诊断之前,癌细胞并没有接受手术和新辅助化疗;(2)预估其生存期限>6个月。排除标准:术前梗阻不能经口进食。按照营养方式分为对照组和试验组,各30例。对照组男16例,女14例;年龄33~75岁,平均(58.34±13.10)岁。试验组男17例,女13例;年龄33~80岁,平均(57.76±14.38)岁。两组年龄、性别对比差异无统计学意义(P=0.866),有可比性。患者均自愿参与本研究。
1.2 方法
1.2.1 评估工具 采用营养风险筛查NRS-2002评估表,从疾病、营养和年龄三方面筛查患者是否存在营养风险及程度。所有癌症患者在入院24 h内常规进行营养筛查。总分<3分,则表示暂无营养管理风险,可以定时1周再次进行营养风险筛查。若总分≥3分,表示患者长期处于一种营养风险中,需要临床进行合理营养干预治疗,制定营养支持计划。
1.2.2 动态营养风险筛查及评估 评估时机:营养风险筛查提示有营养风险的患者,由营养护士进行营养评估。采用主观整体营养状况评量表PG-SGA,0~1分:无营养不良,不需进行营养干预,1个疗程后应常规营养评估;2~3分:可疑或轻度营养不良,由营养师、医师对患者及其家属进行营养指导,并根据实验室结果进行药物干预;4~8分:中度营养不良,需及时营养干预及对症治疗;≥9分:重度营养不良,迫切需要改善症状的治疗和营养干预。
1.2.3 营养支持方法 对照组采用常规肠内营养方案,根据患者胃肠道功能状况选择营养摄入途径,首选EN,EN补充剂选择安素肠内营养粉剂,若EN不能达到总热量的60% 3~5 d,可选择管饲(ETF),对于使用EN方案的患者,告知患者及家属患者每日营养需要量,肠内营养操作时,配制浓度要准确,教会患者及家属安素摄入量表的使用,口服一餐,在安素摄入量表上画一横线,医生开具医嘱每日营养制剂摄入量达到多少千卡,起到医患共同参与的作用。对照组患者术前给予正常饮食。试验组参照文献[6]营养五阶梯疗法,术前7~10 d常规给予无渣整蛋白肠内营养制剂:安素(美国雅培公司,400 g/罐,生产批号18078NR)口服,先每天小剂量(4~6次,每次用 50~100 ml温水配 1.5~3.0勺安素营养粉)加上饮食和营养教育让患者及家属认识到营养支持对疾病的重要性和必要性,制定饮食计划。等到患者肠道可以耐受之后,再逐渐增加营养制剂的用量(5~6次/d,每次200 ml温水配6勺安素营养粉),术前每日能量摄入需达到20~25 kcal/(kg·d)。两组术后均给予常规静脉营养支持,并根据胃肠功能恢复情况肛门自主排气、肠鸣音恢复后逐渐转为流质饮食。
1.3 观察指标
1.3.1 血清学营养指标 术前及术后第3~5天,检测患者空腹外周血的白蛋白、前白蛋白水平,记录下降值。
1.3.2 术后恢复情况 肛门排气时间、排便时间、术后平均住院天数。
1.4 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(% )表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组术后白蛋白、前白蛋白水平比较
试验组术后白蛋白、前白蛋白下降值明显低于对照组,差异有统计学意义(P=0.026、0.015),见表1。
表1 两组术后白蛋白、前白蛋白水平下降值比较 (±s)
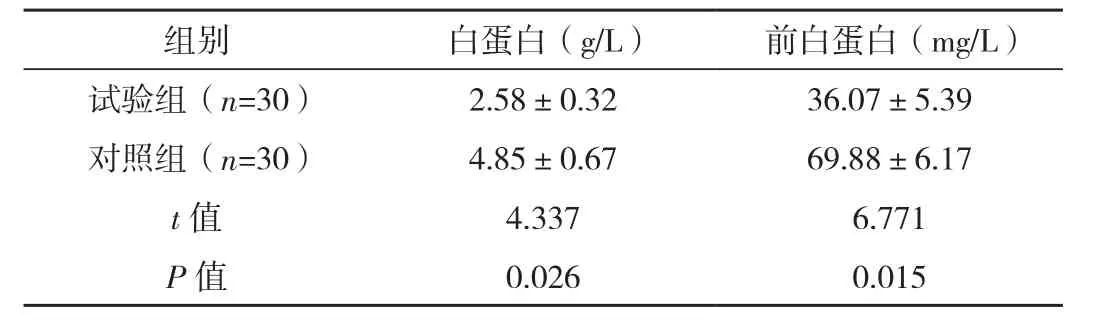
表1 两组术后白蛋白、前白蛋白水平下降值比较 (±s)
组别 白蛋白(g/L) 前白蛋白(mg/L)试验组(n=30) 2.58±0.32 36.07±5.39对照组(n=30) 4.85±0.67 69.88±6.17 t值 4.337 6.771 P值 0.026 0.015
2.2 两组术后恢复情况比较两组术后恢复情况比较
术后,试验组肛门排气时间、排便时间、术后住院天数均优于对照组,差异有统计学意义(P=0.025、0.021、0.010),见表2。
表2 两组术后恢复情况比较 [d,(±s)]
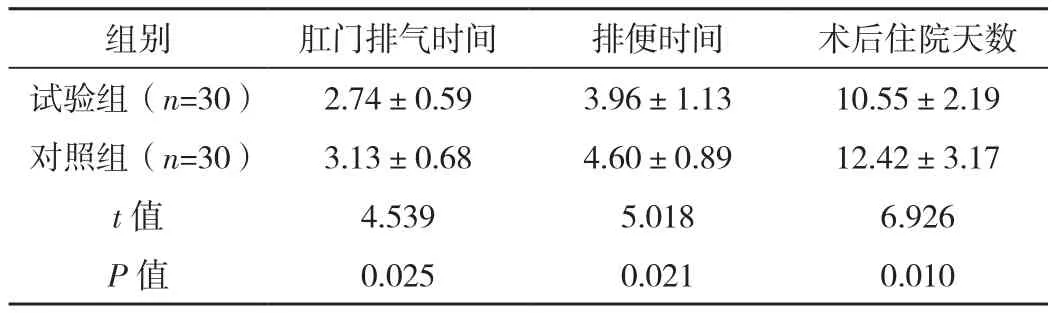
表2 两组术后恢复情况比较 [d,(±s)]
组别 肛门排气时间 排便时间 术后住院天数试验组(n=30) 2.74±0.59 3.96±1.13 10.55±2.19对照组(n=30) 3.13±0.68 4.60±0.89 12.42±3.17 t值 4.539 5.018 6.926 P值 0.025 0.021 0.010
3 讨论
消化道恶性肿瘤患者处于慢性消耗状态,常伴有不同程度的营养不良,围手术期营养不良往往直接影响患者的预后,延长术后平均住院时间,增加了住院费用和并发症,影响术后的放化疗,导致了总生存率和患者的生活质量,因此,对于营养不良的患者在术前评估如有营养不良应及时介入干预治疗[6-7]。胃肠恶性肿瘤手术治疗后给予营养支持治疗,对于术后患者的康复进展及预后质量,显得至关重要。文献[8]表明,胃肠术后,尤其吻合口手术,通常需要一段时间来逐渐恢复胃肠功能消化道恶性肿瘤合并营养不良患者,若术前评估无明显肠梗阻、胃肠道无活动行出血、严重肠道炎症、腹泻且胃肠有一定功能的患者,均应予以EN进行营养支持,而口服肠内营养制剂作为EN的一种方法,已被ESPEN推荐为围术期EN的主要方式[9]。EN相较于PN在围术期,尤其是对于术前评估患者的营养可以改善中,拥有其明显的优势:食物在消化道内可刺激通过消化道出现蠕动及消化腺产生分泌,进而能够维持正常的消化道功能及影响肠道内菌群的平衡[10]。即使在EN,口服肠内营养制剂更符合营养物质吸收的解剖生理、相对安全、给药方便、充分利用胃肠道的免疫防御功能维持肠黏膜细胞正常结构,且无严重并发症。肠内营养既可以作为正常饮食完全替代,还可以补充正常饮食,可根据患者的具体情况和个人习惯进行科学合理的灵活调整[11-12]。
本研究回顾性研究了既往消化道恶性肿瘤合并营养不良的患者,且能够接受术前口服肠内营养制剂。分析其与术后患者血清学营养指标、术后恢复发展情况之间的关系,根据这些患者术前是否接受口服肠内营养制剂将患者主要分为试验组与对照组,结果分析提示试验组术后白蛋白、前白蛋白水平下降程度明显小于对照组。且试验组肛门排气排便,术后住院时间均较对照组短,提示可提高营养储备,改善患者术后营养情况,加速患者术后康复。
随着医学的不断进步,如何在临床合理、有效地应用肠内营养制剂,进一步提高护理质量,完善护理体系,并且更准确、更深入地推动肠内营养在家庭、社区的治疗及发展,以使有限的卫生资源能够发挥最大的社会卫生效益,将成为未来最重要的营养课题。

