预镀镍层对一种C-Mn-Si 高强钢 选择性氧化行为的影响
蒋光锐,王海全,刘广会,周建,滕华湘
(1.首钢集团有限公司技术研究院,北京 100043;2.绿色可循环钢铁流程北京市重点实验室, 北京 100043;3.首钢京唐联合钢铁有限责任公司,河北 唐山 063200)
降低车身质量可减少燃油和电力的消耗,故汽车企业普遍采用先进高强钢来制造汽车车身。为了获得强度和塑性的组合,先进高强钢通常需要含有较多合金元素,如碳、锰、硅。然而,在传统的连续退火生产线上,先进高强钢中的硅和锰元素倾向于优先与气氛中的氧反应,在表面形成氧化物[1-2]。这种表面氧化物难与锌液反应,降低了高强钢在连续热浸镀时与锌液的浸润性[3-4],阻碍了Fe-Al 抑制层的形成[5],造成先进高强钢可镀性降低,形成镀层表面漏镀等缺陷。
目前,改善先进高强钢可镀性的方法有四种。第一种是采用“加热阶段氧化-均热阶段还原”的退火技术[6-7],在加热阶段形成铁的氧化物,阻碍其他合金元素发生表面选择性氧化,然后在均热阶段将铁的氧化物还原为海绵铁。这种技术要求对铁的氧化物厚度做到精确控制,确保还原阶段能够将铁的氧化物完全还原。第二种方法是提高露点温度[8-9],将表面选择性氧化转化为次表层选择性氧化,但这种方法并不适用于所有钢种[10]。第三种方法是在先进高强钢中添加微量表面偏聚元素,如Sn[11]、Sb[12]、Bi[13]等,改变表面合金元素氧化物的形态,提高高强钢的可镀性。但是,添加微量元素可能对先进高强钢力学性能产生影响,有一定局限性。第四种方法是退火前在先进高强钢表面预先镀上一层金属,如Cu[14-15]、Fe[14,16]、Ni[17-18]等,抑制退火过程中合金元素在表面选择性氧化。Kim 等[17]在一种孪晶诱发塑性钢(TWIP 钢)表面预镀了一层50 nm 厚的Ni,然后进行常规退火,发现预镀镍层能够减小表面氧化层的厚度,提高其在锌液中的浸润性。但是,该研究使用的镀镍方法为电子束蒸镀,难以在连续退火生产线上实现,并且钢中含有17%Mn,与常见的C-Mn-Si 先进高强钢的成分体系差异较大。Zhong 等[18]使用电镀工艺在0.11%C- 1.9%Mn-0.27%Si 高强钢表面预镀一层Ni,研究了镀镍样品在-20 ℃露点温度下退火后的表面选择性氧化行为,认为镀镍层能够显著抑制该钢种的选择性氧化。但是该研究使用的镀镍层厚度为5~12 μm,没有研究极薄镀镍层的影响规律。
本研究以0.15%C-1.1%Mn-0.4%Si 成分的先进高强钢为研究对象。在退火前,采用电沉积方法在材料表面沉积一层镍镀层,镍层厚度大约为100 nm,然后进行退火模拟。研究了退火后材料表面氧化物形貌及深度分布,并与未镀镍样品进行比较。
1 试验材料和方法
选择化学成分为0.15%C-1.1%Mn-0.4%Si 的先进高强钢为试验对象,经过熔炼、热轧和冷轧,获得厚度为0.8 mm 的冷硬板。将冷硬板切割为200 mm× 120 mm 尺寸的试验样品,用乙醇和丙酮除去油污,然后用砂纸将表面抛光,使得表面粗糙度Ra 达到0.15±0.1 μm。退火前,在样品表面预先电镀一层镍。电镀镍所用的阳极为镍板,满足GB/T 5235 要求,纯度不小于99.98%。电镀所用的镀液组成为:200 g/L六水硫酸镍,10 g/L 氯化钠,35 g/L 硼酸,60 g/L 无水硫酸钠,0.1 g/L 十二烷基硫酸钠。电镀试验时,用硫酸将镀液的pH 值控制在5.0~5.5 之间,镀液温度为20~25 ℃,电流密度为0.4 A/dm2,通过控制电镀时间,获得厚度约为100 nm 的电镀层。作为对比,部分样品表面不镀镍。
在一台镀锌模拟器中进行模拟退火处理,退火的保温温度为800 ℃,此时,该钢种中的铁素体和奥氏体的体积分数相等。将试验样品放入镀锌模拟器中,以5 K/s 的速度加热到800 ℃,保温10 s 和50 s,然后在氮气中快速冷却到室温,冷却速度为10 K/s。在加热和保温过程中,样品处于氢气和氮气混合气体气氛中,氮气和氢气的纯度均为99.99%,氢气体积分数为3%,混合气体的露点温度为-50 ℃。
使用场发射扫描电镜(JSM7001F)观察样品表面形貌,加速电压为15 kV,通过其附带的X 射线能谱仪分析样品表面化学元素。进一步使用辉光放电光谱(LECO GDS850A)分析样品表层的合金元素深度分布。
使用X 射线光电子能谱仪(ESCALAB 250Xi)分析样品表面合金元素的结合能,使用单色Al K 射线源,样品倾斜角度为45°,分析斑点直径为650 μm。元素结合能的宽谱采用1 eV 步长扫描,再采用0.1 eV步长扫描获得每个元素的结合能。所有元素结合能均使用284.6 eV 的C 1s 峰进行校正,然后用Shirley 近似去除背景信息。
2 结果与讨论
镀镍与未镀镍样品退火保温10 s 后的表面形貌如图1 所示。镀镍样品表面覆盖一层疏松的镀镍层,在镀镍层表面有零散分布的颗粒状氧化物,而未镀镍样品表面散布着大量氧化物颗粒。氧化物呈不规则的圆形或长圆形,分布在基板的晶粒中和晶界上,尺寸不超过5 μm。退火保温50 s 后,未镀镍和镀镍样品表面氧化物数量都明显增加,如图2 所示。镀镍与未镀镍样品表面的X 射线能谱分析结果如表1 所示。从能谱分析结果也可以发现,未镀镍样品表面的O、Si、Mn 元素均比镀镍样品多。保温时间延长,会略微增加表面合金元素Si 和Mn 的含量,同时显著降低预镀镍样品表面的镍含量,这可能是由于更多的镍扩散到样品内部。

图1 样品退火保温10 s 后的表面形貌(箭头所指为氧化物) Fig.1 Surface morphology of the annealed sample soaking for 10 s (oxides are pointed by arrows): a) with prior Ni plating; b) without prior Ni plating
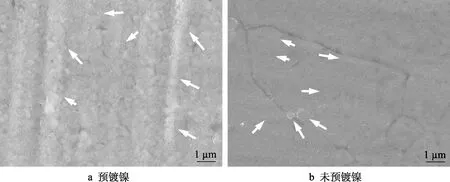
图2 样品退火保温50 s 后的表面形貌(箭头所指为氧化物) Fig.2 Surface morphology of the annealed sample soaking for 50 s (oxides are pointed by arrows): a) with prior Ni plating; b) without prior Ni plating

表1 样品表面X 射线能谱法分析结果 Tab.1 EDS results on the surface wt.%
预镀镍和未预镀镍样品退火保温10 s 后的表层元素深度分布如图3 所示。未预镀镍样品表面存在明显的Si、Mn 富集峰,其深度均为30 nm,Mn 的富集峰值约为12.1%,而Si 的富集峰值约为3.9%。预镀镍样品表面层不存在明显的Si、Mn 富集峰,表面的Mn 和Si 含量分别为5.8%和3.0%,均小于未镀镍样品。与未镀镍样品相比,预镀镍样品表面Mn 含量(以质量分数计)大约减少了52%,Si 大约减少了23%。
保温时间延长至50 s 后,两种样品的表层元素深度分布如图4 所示。未预镀镍样品表面Si、Mn 的富集峰深度增加到约 50 nm,Si 的富集峰值增加到4.8%,Mn 的富集峰值增加到15.1%。而预镀镍样品表面出现Si 和Mn 的富集峰,富集峰深度约为36 nm,Mn 和Si 的富集峰值分别为8.8%和2.8%。与未预镀镍样品相比,预镀镍样品表面Si 和Mn 的富集量均降低42%。

图3 未镀镍和镀镍样品退火保温10 s 后的表层元素深度分布 Fig.3 Depth distribution of surface elements of the annealed samples with or without prior Ni plating soaking for 10 s
以合金元素富集峰包围的面积近似作为合金元素在表层的富集量,计算结果如图5 所示。可以发现,增加保温时间和未预镀镍,都会增加表层Si、Mn 的富集量。同时,未镀镍样品表面的Mn 元素富集量大约是预镀镍样品的1.7 倍,与保温温度关系不明显,而未镀镍样品表面的Si 元素富集量大约是预镀镍样品表面的1.2~1.5 倍,保温时间越长,差异越明显。
图6 是退火保温时间对预镀镍样品表面镍元素分布的影响。可以发现,退火后,样品表面的镍元素峰深度几乎没有太大变化,都是0.1~0.11 μm,但是峰值含量明显降低。退火前,表面几乎为一层纯镍层,镍含量(以质量分数计)达到95%;而退火保温10 s后,由峰值下降至39%;退火保温50 s 后,进一步 降低到20%。这表明镍发生了向内扩散,退火10 s后,大部分镍已经扩散到铁基体中。该结果与X 射线能谱分析结果吻合。

图5 表面合金元素的富集程度 Fig.5 Alloying element enrichment on the external surface

图6 保温时间对预镀镍样品表面镍深度分布的影响 Fig.6 Influence of soaking time on surface depth profile of Ni of the prior plating samples
样品表面合金元素的结合能及化合物种类如表2所示,其中化合物种类根据NIST 光电子能谱结合能的数据库[19-20]确定。可以发现,预镀镍样品表面的金属元素结合能较低,化合物以无定型的硅氧化物以及低价态锰的氧化物为主,当保温时间为10 s 时,表面甚至能检测到金属锰。而未镀镍样品表面的金属结合能普遍高一点,当保温时间达到50 s 时,出现了锰的高价态氧化物(MnO2)以及晶态的SiO2。
根据Ellingham 图[21]可知,与Si、Mn、Fe 相比,Ni 与O 的化学亲和性更低,在试验中几乎不会发生明显的氧化。氧在镍中的扩散系数显著低于氧在铁素体中的扩散系数,与氧在奥氏体中的扩散系数相近,如图7 所示。当温度为800 ℃时,氧在镍中的扩散系数为1.76×10-8cm2/s,根据Fick 第二定律计算可知,氧扩散通过100 nm 的镍层只需要0.006 s,远小于试验的保温时间。因此,预镀镍层不能阻碍氧通过镍层向材料内部充分扩散。

表2 样品表面的元素结合能及对应的化合物种类 Tab.2 Binding energy of alloying elements and the corresponding compounds on the external surface

图7 氧在镍以及铁素体和奥氏体中的扩散系数 Fig.7 Diffusivity of oxygen in nickel, ferrite and austenite
根据Fe-Ni 二元相图[24],当温度为800 ℃时,如果镍含量(以质量分数计)超过4.5%,则铁和镍形成固溶体γ(Fe,Ni)。从辉光分析结果可知(图6 所示),预镀镍试验样品在表面以下0.5 μm 范围内,镍超过5%。因而推测,在退火过程中,预镀镍样品在表面以下0.5 μm 范围内形成了含有Si 和Mn 的γ(Fe,Ni)。比较了800 ℃下Si 和Mn 在γ-Ni、α-Fe、γ-Fe 中的扩散系数,并计算了Si 和Mn 在基体中的平均扩散系数,如表3 所示,其中平均扩散系数为α-Fe 和γ-Fe 中扩散系数的加权和。可以发现,Si 在γ-Ni 中的扩散系数明显小于在α-Fe 和γ-Fe 中的扩散系数,而Mn 在γ-Ni 中的扩散系数小于在α-Fe 中的扩散系数,与在γ-Fe 中的扩散系数基本相当。由于该试验钢种在800 ℃退火时铁素体与奥氏体体积分数相等,因而Si、Mn 在基板中的平均扩散系数显著高于在镍中的扩散系数。这也说明,由于合金元素在镍中的扩散系数显著低于在基体中的扩散系数,使得合金元素难以扩散到表面并发生氧化,从而抑制了合金元素Si、Mn 的表面选择性氧化。

表3 800 ℃下Si 和Mn 在γ-Ni、α-Fe、γ-Fe 中的扩散系数以及在基体中的平均扩散系数 Tab.3 Diffusivity of Si and Mn in γ-Ni, α-Fe, γ-Fe and the average diffusion coefficient in the matrix at 800 ℃
3 结论
以一种化学成分为0.15%C-1.1%Mn-0.4%Si 的先进高强钢为对象,研究了100 nm 厚度的预镀镍层对该高强钢在退火中选择性氧化行为的影响,得出以下结论:
1)退火后,预镀镍样品表面依然覆盖镍层,镍层表面出现了零星分布的氧化物,而未镀镍样品退火后,晶粒和晶界位置都出现大量颗粒状氧化物。
2)增加保温时间和不预镀镍,都会增加样品表面Si、Mn 的富集量。
3)未镀镍样品表面Mn 元素的富集量大约是预镀镍样品的1.7 倍,与保温温度关系不明显,而表面Si 元素的富集量大约是预镀镍样品的1.2~1.5 倍,保温时间越长,差异越明显。
4)预镀镍样品表面氧化物以无定型的硅氧化物以及低价态的锰氧化物为主,甚至有金属锰。而未镀镍样品表面出现了锰的高价态氧化物以及晶态的SiO2。
5)合金元素Si 和Mn 在Ni 中的扩散系数显著小于在Fe 中的扩散系数,主要原因是预镀镍层抑制了高强钢选择性氧化。

