ZnO 表面改性Zn-Cu 组织工程支架的研究
任浩征,潘超,许迎,孙小淏,刘德宝
(天津理工大学 材料科学与工程学院,天津 300384)
近年来,具有生物可降解特性的新一代医用金属材料的研究发展迅速,这类新型医用金属材料(Mg、Fe、Zn)巧妙地应用在人体环境中,充分利用其易发生腐蚀降解的特性,实现在体内逐渐降解直至最终消失的医学临床目的[1-7]。因此,可降解金属通过材料成分的合理设计,结合生命科学和工程学的研究思路,将会对骨组织工程学产生积极而深远的影响。
可降解镁合金材料因表现出优异的生物相容性而被广泛研究。Mg 大量参与人体的各种生理活动,在许多细胞功能中发挥着重要作用[8],且其密度与人体骨骼密度接近,同时弹性模量也与人体骨骼相近,减少了应力屏蔽[9]。Singh 等人[10]采用粉末冶金以及钛编织丝网作为空间支撑材料相结合的方法,成功地制备了一种孔隙率为60%、孔径大小约为300 μm、孔洞互连的新型Mg-10Zn-4Y 支架材料。其中,钛编织金属丝网法保证了拓扑有序多孔结构的形成;锌和钇作为添加的合金材料,通过提高整体可烧结性来增强多孔镁的强度;使用L929 细胞对支架材料的细胞相容性进行了研究,证实了其生物相容性良好。然而,Mg 的标准电极电位为-2.37 V,因此,镁在生理环境中的腐蚀速率快,并且在腐蚀过程中会产生氢气包囊[11]。应用到组织工程领域的镁基多孔支架由于具有更大的表面积,因而腐蚀降解速率会更快。可降解铁基材料有较好的生物相容性。Fe 是人体必需的金属元素,参与氧的运输与储存,与某些酶的合成和活动密切相关[12]。Carluccio 等人[13]采用选择性激光熔化(SLM)制备了孔隙率为42%的Fe-35Mn 骨支架,并对其性能进行了深入分析,结果表明,选择性激光熔化可以制备具有复杂分级结构的材料,这是传统制造方法无法实现的;支架的微观结构主要由奥氏体组成,延展性良好;电化学和浸泡测试体现出Fe-35Mn 支架降解速率比纯铁快;植入大鼠颅骨4 周后观察到新骨形成,表明该支架具有良好的生物相容性。然而,Fe的标准电极电位为-0.44 V,在体内的腐蚀降解速率较慢,铁基多孔支架如若植入到体内会有较长时间的保留。此外,铁的腐蚀产物在生理环境中趋于稳定,导致长期滞留,这可能会引起代谢并发症[14-15]。另外,铁基材料本身具有铁磁性,在植入后的医学影像检测中存在诸多不便。
锌具有良好的生物相容性,标准电极电位为-0.76 V,介于镁和铁之间,降解速率适中。Xiao 等人[16]对Zn-0.05Mg 合金进行了体内外研究。结果表明,在纯锌基础上添加镁以后,力学性能得到了改善;合金对L-929 细胞无毒性作用,且对大肠杆菌和金黄色葡萄球菌有抗菌作用;将Zn-0.05Mg 植入兔股骨后均匀降解且无炎症反应,在骨与植入体界面逐渐有新骨形成。目前,对于锌基多孔支架的研究也在不断深入[17-23]。Capek 等人[18]采用放电等离子烧结制备了孔隙率约为20%的多孔Zn。结果表明,初始Zn 粉末尺寸显著影响孔的大小和形状、机械性能以及腐蚀性能;浸泡实验证明多孔Zn 表面可以沉积Ca-P 产物,具有良好的生物活性。Xie 等人[19]采用气压渗流法制备了孔隙率为59.1%的多孔Zn-1Ag、Zn-3.5Ag 支架。结果表明,降解表面的腐蚀产物主要由ZnO、Ca3(PO4)2和Zn(OH)2组成;多孔Zn-Ag 支架的力学性能高于相同孔隙率的多孔Zn 支架,说明合金元素的添加改善了支架的力学性能;随着银含量的增加,多孔锌银支架的抗菌能力越来越高。Cockerill 等人[20]采用增材制造技术制备了孔径为900 μm 和2 mm 的锌骨支架,制备的多孔锌支架呈现出完全互连的孔结构,可促进细胞渗透和骨向内生长,且表现出良好的抗菌作用;体外细胞测试和浸泡结果,证实了支架良好的生物相容性和适中的降解速率。上述研究都证明了锌基多孔支架在骨科领域具有良好的应用前景。
为了获得综合性能优异的锌基多孔支架,对其进行合金化是很有必要的。铜是锌合金的主要合金化元素之一,也是人体必需的微量元素,可改善机械性能和生物医学功能,如增强锌基多孔支架的力学性能和抗菌效果[24-26]。Hou 等人[25]采用热压烧结来制备氯化钠模板,将熔化的金属渗流到氯化钠模板中,凝固后去除氯化钠,得到多孔纯Zn 和Zn-3Cu 支架。由于铜在锌基体中的固溶和锌铜第二相的析出,添加铜显著提高了锌支架的力学性能和腐蚀速率。Tang 等人[26]系统研究了挤压态Zn-xCu(x=1,2,3,4)合金的显微组织、力学性能、细胞毒性和抗菌性能。结果表明,Zn-Cu二元合金具有良好的强度和延展性、可接受的细胞毒性和良好的抗菌性能。此外,由于人体细胞存在于组织液中,组织液以水溶液为基础,支架材料优良的亲水性能有利于组织液浸润,也有利于促进细胞的快速粘附和快速生长[27-28]。在医用金属材料表面改性的研究中发现,在Ti 基体表面制备了Hep/ Chi 功能涂层,在Mg 基体表面制备了PDA/HA 功能涂层,改善了表面的润湿性,显著地提高了材料的生物相容性[29]。在Zn-Cu 组织工程支架表面进行ZnO 表面修饰可改善支架表面润湿性,促进亲水性,且ZnO 也具备一定的抗菌作用[30-31],对Zn-Cu 组织工程支架进行ZnO表面修饰,有望达成ZnO 与富铜相的协同抗菌作用,进一步提高Zn-Cu 组织工程支架的抑菌、抗菌性能。在合金支架表面制备ZnO 的方法有固相法、气相法和液相法。固相法在反应中会引入杂质粒子,气相法的制备过程较复杂。液相法效率高,成本较低,其中水热法制备ZnO 过程相对简单,易于控制,速度快且制备的ZnO 形貌可控均匀。所以,水热法是目前制备ZnO 最常见的方法[32]。
在本研究中,利用气压渗流铸造法制备出理论孔隙率为60%且孔径尺寸为100~500 μm 的Zn-xCu(x=0,1,2,3)合金组织工程支架。通过水热法对Zn-Cu组织工程支架进行ZnO 表面修饰,从而改善其表面润湿性。对所制备支架的宏观、微观形貌,ZnO 表面修饰后支架表面的微观形貌、相结构以及表面亲水性能进行了系统表征,并且评价了ZnO 表面修饰后的Zn-Cu 组织工程支架的抑菌、抗菌性能。本研究可以对开发新一代Zn 基组织工程支架材料提供借鉴与参考。
1 试验
1.1 材料制备方法
1.1.1 Zn-Cu 支架的制备
本研究中制备Zn-Cu 合金组织工程支架所用的材料包括高纯锌锭(纯度99.995%)、高纯铜粉(纯度99.99%)、50~100 目NaCl 颗粒。Zn-Cu 合金组织工程支架的制备采用气压渗流铸造法,其铸造模具示意图如图1 所示。具体制备步骤为:首先在坩埚中将锌锭加热至560 ℃,保温1 h,之后将配比好的铜粉加入坩埚,继续保温1 h,在此过程中通入N2作为保护气氛;将氯化钠颗粒放入模具中,一起放入电阻炉中330 ℃保温至浇铸;然后迅速将熔融好的合金撇渣后浇铸到模具中,冷却后脱模;在超声环境中清洗去除氯化钠颗粒,得到锌铜合金支架。
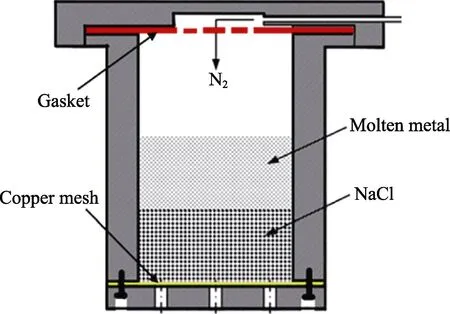
图1 铸造模具示意图 Fig.1 Schematic diagram of the casting mould
1.1.2 表面ZnO 涂层的制备
将Zn-Cu 合金组织工程支架采用线切割的方法加工成φ10 mm×3 mm 圆柱体试样,用去离子水、无水乙醇超声清洗,然后充分干燥。将干燥后的试样置于200 g/L 的氯化钠溶液中,在80 ℃下保温5 h。到预定时间后,取出试样放置到真空干燥箱中充分干燥。
1.2 显微形貌观察与物相分析方法
使用场发射扫描电子显微镜(FE-SEM, Quanta FEG 250)对φ10 mm×3 mm 的Zn-Cu 支架圆柱体试样进行显微形貌观察。使用场发射扫描电子显微镜对φ10 mm×3 mm 的表面制备有ZnO 层的圆柱体试样进行显微形貌观察。使用X 射线衍射仪(XRD,Rigaku D/max/2500PC),在扫描范围2θ 为10°~80°、扫描速度为5 (°)/min 的条件下,对表面制备有ZnO 层的圆柱体试样进行物相分析。
1.3 Zn-Cu 支架表面接触角测定方法
材料表面与水的接触角采用光学接触角测量仪进行测量。将平整的待测试样放置在实验台上,然后通过滴定针管将5 μL 去离子水滴在样品表面,用相机拍摄液滴与样品表面接触图像,最后经图像分析得到材料与水的接触角。
1.4 ZnO 表面修饰前后的Zn-3Cu 支架细胞粘附性能评价
对ZnO 表面修饰前后的Zn-3Cu 合金组织工程支架的细胞粘附性能进行评价。将MC3T3 大鼠成骨细胞置于α-MEM 培养基中,在37 ℃、5%CO2条件下的培养箱中培养6 h,将Zn-3Cu 合金组织工程支架辐照灭菌之后,每片材料接种相同数量的细胞,用磷酸盐缓冲液(PBS)冲洗掉残留的培养基,之后用Hoechst染色剂染色细胞核20 min,最后用激光扫描共聚焦显微镜(LSCM,Nikon A 1)观察细胞的粘附情况。
1.5 ZnO 表面修饰前后的Zn-3Cu 支架抗菌性能评价
评价材料抑菌、抗菌性能所用菌种为金黄色葡萄球菌与大肠杆菌。将金黄色葡萄球菌置于LB 液体培养基中培养,将培养好的细菌悬液接种于平板,充分涂抹,将ZnO 表面修饰前后的Zn-3Cu 支架小圆片贴于平板中间,16 h 后观察测定材料周边抑菌圈的大小,抑菌圈越大,材料的抑菌抗菌性能越好。
将大肠杆菌置于LB 琼脂培养基中培养,将配制好的有ZnO 表面修饰的Zn-3Cu 支架材料浸提液涂于此培养基上,干燥后将培养好的细菌悬液分别涂布与划线,16 h 后与空白试样形成对照,观察细菌数量的变化情况。细菌数量若减少,进一步证明ZnO 表面修饰后的Zn-3Cu 支架材料具有抗菌性能。
2 结果及分析
2.1 Zn-Cu 支架的微观形貌
本研究制备的Zn-3Cu 合金组织工程支架的宏观和微观形貌如图2 所示。计算分析得出支架的平均孔径尺寸为237 μm,实际孔隙率为(71.13±0.90)%。从图2a 中的宏观形貌照片可以看出,支架材料底面和侧面的孔洞均匀分布。以图2b 中的SEM 照片可看出,支架体孔洞分布均匀,孔的连通性良好,孔洞之间的孔壁相对完整。

图2 Zn-3Cu 合金组织工程支架形貌 Fig.2 Zn-3Cu alloy tissue engineering scaffolds: a) macrostructures; b) scanning electron microscope (SEM) image
2.2 ZnO 表面修饰的Zn-Cu 支架表面微观形貌及相组成
Zn-Cu 合金组织工程支架表面ZnO 层的微观形貌如图3 所示。可以看出,在同一温度、相同时间的处理条件下,在纯锌支架体表面,ZnO 多为一些絮状颗粒。 添加Cu 合金元素的Zn-xCu(x=1,2,3)支架表面均被针状或者棒状聚集的团簇均匀覆盖,并且随着Cu 添加量的增加,支架表面针状、棒状ZnO 的大小逐渐变大。图4 为带涂层支架体表面XRD 相结构分析谱图。从图4 中可以发现,支架体表面有Zn、CuZn5、ZnO 相,说明经过改性后的材料表面生成了棒状、针状的ZnO 产物。

图3 Zn-Cu 合金组织工程支架表面修饰后的微观形貌 Fig.3 Microstructures of coated Zn-Cu alloy tissue engineering scaffolds

图4 支架体表面修饰后的XRD 相结构分析图谱 Fig.4 XRD phase structure analysis of coated scaffolds surface
从图3 可以看出,相同水热反应条件下,纯锌支架体表面生成的ZnO 为颗粒状,处于生长的初级阶段,有逐渐形成与长大的趋势。而添加Cu 以后,由XRD 相结构分析可知,Zn-2Cu、Zn-3Cu 支架体表面会有金属间化合物CuZn5相的形成,并且随着Cu 添加量的增加,CuZn5相的含量也增加。基体Zn 的腐蚀电位低于第二相CuZn5相的腐蚀电位,二者之间会形成腐蚀微电池,Zn 在Zn-Cu 合金中充当阳极,发生电偶腐蚀[26],锌基体的腐蚀速率显著增加,Zn 离子释放量增加,从而使ZnO 晶体的生成与长大速率变快,因此随着合金元素Cu 含量的增加,Zn-Cu 支架材料表面生成的ZnO 晶体尺寸逐渐增加。
Zn-Cu 合金组织工程支架在80 ℃的NaCl 溶液中生成ZnO 相的反应方程式如(1)—(3)所列[33-35]。
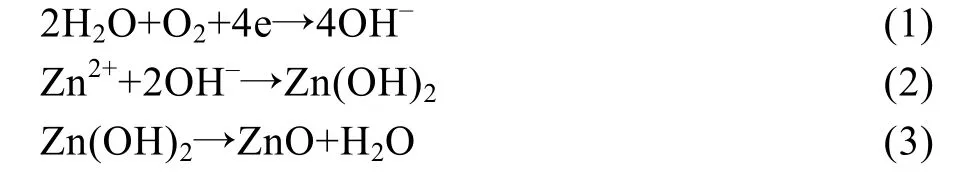
支架置于NaCl 溶液后,锌的溶解和氧的还原开始进行,Zn2+和OH-通过扩散作用相互接触,反应生 成Zn(OH)2,再进一步转化为ZnO,当ZnO 在NaCl 溶液中的浓度达到过饱和时,则会在试样表面逐渐沉积。虽然ZnO 层在Cl-的作用下会发生分解生成可溶性物质ZnCl2[36],但依据表面均被ZnO 层均匀覆盖的实验结果可以推断,ZnO 层的沉积速率大于其分解速率。其原因可能是NaCl 电解质溶液具有良好的导电性,加速了锌的溶解和氧的还原过程的进行。此外,试样附近溶液中的OH-会随着反应的进行而逐渐增多,pH 值进而大于7,溶液呈碱性,而ZnO 易于在碱性环境中稳定存在。制备的ZnO 纳米棒大多呈现六棱柱形态。六棱柱ZnO 的生长过程主要包括三个阶段[37]:
1)六方薄片的形成。Zn2+与OH-发生反应生成ZnO,为降低表面能,ZnO 聚集在一起形成六方薄片。
2)二维方向形核。在低能量的{0001}晶面族上不断形成新晶核,溶液中Zn2+与OH-数量逐渐增多,ZnO 二维形核速率也相应变快。
3)晶核侧向长大。晶核将主要沿二维方向侧向长大,以降低晶核六个侧面的高表面能。随着不断的形核与长大,ZnO 六方薄片逐层生长并最终生长为六棱柱ZnO 纳米棒。
2.3 ZnO 表面修饰对Zn-Cu 支架表面接触角的影响

图5 ZnO 表面修饰前后的Zn-Cu 合金组织工程支架接触角测定结果 Fig.5 Water contact angles of the surface of Zn-Cu alloy tissue engineering scaffolds with or without ZnO coating
Zn-Cu 合金组织工程支架和ZnO 表面改性的Zn-Cu 合金组织工程支架的接触角测试结果如图5 所示。从图5 中可以看出,表面没有制备ZnO 层的Zn-Cu支架对水的接触角均为90°~180°,即水对材料均表现为不润湿。而ZnO 表面改性的Zn-Cu 合金组织工程支架表面接触角则表现出明显差异:纯锌支架的接触角为112.21°,大于90°,表现为不润湿,即纯锌支架经5 h 的水热处理后,表面涂层并不能够改善其润湿性。这可能是因为纯锌支架为纯金属,成分单一,制备 的表面ZnO 层厚度较薄、局部覆盖,造成对水的吸引力较弱。Zn-1Cu、Zn-2Cu、Zn-3Cu 支架材料表面的接触角分别为46.44°、46.48°、0°,均小于90°,都表现为润湿。结合ZnO 的尺寸和形貌,Zn-Cu 材料表面的ZnO 多生长为针状或者棒状,且形态多为聚集的团簇,导致表面的粗糙度变大,对水的吸引力变大,接触角变小。Zn-3Cu 支架材料表面的ZnO 分布均匀且相对致密,粗糙度较大,对水的吸引力较强,润湿效果最佳,表现为完全润湿。材料表面与水的接触角大小可以显示出材料表面润湿性的差异[38-39],通过测定材料表面对水的接触角可反映支架材料表面的亲疏水性能。接触角越小,代表材料的亲水性能越好,有利于组织液的浸润,从而促进细胞快速粘附;相反,接触角越大,表示支架材料表面的润湿性越差,越不利于组织液的浸润,从而减缓细胞在支架表面粘附。
2.4 ZnO 表面修饰对Zn-Cu 支架细胞粘附性的影响

图6 Zn-3Cu 合金组织工程支架细胞粘附 Fig.6 Cell adhesion on Zn-3Cu alloy tissue engineering scaffolds: a) without ZnO coating, b) with ZnO coating
结合Zn-Cu 合金组织工程支架的接触角大小,说明了材料表面的ZnO 能够改善材料的亲水性,促进了细胞在组织工程支架表面的快速粘附,从而实现支架材料表面功能化,对于组织工程支架的临床应用十分有意义。
2.5 ZnO 表面修饰前后的Zn-3Cu 支架抗菌性能评价
图7 为未经ZnO 表面修饰和ZnO 表面修饰后的Zn-3Cu 支架与金黄色葡萄球菌接触培养16 h 后的细菌菌落铺板数码照片。从图7 中可以看出,未经ZnO表面修饰的Zn-3Cu 合金支架有效灭菌空白区域的最长距离为7.8 mm,说明其合金本身Zn-3Cu 材料存在抗菌活性,ZnO 表面修饰后的Zn-3Cu 合金支架有效灭菌空白区域的最长距离为9.8 mm,说明ZnO 表面修饰后的Zn-3Cu 合金支架的抑菌、抗菌效果优于未经ZnO 表面修饰的Zn-3Cu 合金支架。图7 中没有完整抑菌环的存在,可能是因为微观孔隙结构存在毛细现象,孔与孔之间的结构存在差异,合适的孔结构对菌落有一定的吸附作用,从而会有一部分菌落贴附于材料周围,导致抑菌环不完整。

图7 Zn-3Cu 合金组织工程支架抑菌圈照片 Fig.7 Antibacterial circle photograph of Zn-3Cu alloy tissue engineering scaffolds: a) without ZnO coating; b) with ZnO coating
图8、图9 分别为菌液划线图与涂布图。图8a与图9a 为空白菌液,图8b 与图9b 为ZnO 表面修饰后的Zn-3Cu 支架浸提液与大肠杆菌共培养后的菌液。可以看出,分别将菌液划线与涂布后,作为空白对照的菌落生长状态良好,菌落与菌落之间致密紧凑排列,稠密分布,肉眼无法分辨出菌落状态;而Zn-3Cu 支架材料浸提液处理过的菌液与空白菌液相 比,菌落数量减少,清晰可见点状细菌菌落,分布稀疏,松散排列。这进一步说明了ZnO 表面修饰后的Zn-3Cu 支架材料具有抑菌、抗菌性能。

图8 Zn-3Cu 合金组织工程支架抑菌划线照片 Fig.8 Antibacterial line photograph of Zn-3Cu alloy tissue engineering scaffolds: a) blank; b) with ZnO coating
细菌细胞壁和细胞膜会被ZnO 颗粒溶解释放的Zn2+破坏,导致细菌内容物流出,从而严重抑制其活性,最终导致细菌死亡。并且有研究发现,ZnO 中溶解的Zn2+的质量浓度约为10 μg/mL 时,细胞活性降低到50%[40]。除Zn2+的作用外,ZnO 颗粒对细胞的机械损伤也可导致其抑菌、抗菌。细菌的细胞表面存在羧基等一些带负电荷的基团,ZnO 纳米颗粒带正电荷,在静电力的作用下,细菌细胞与ZnO 颗粒相互吸引,紧密结合,针状或者棒状聚集的团簇ZnO 对细菌细胞壁和细胞膜造成破坏,从而使细菌失去活性[41]。此外,ZnO 颗粒的取向也能影响其抗菌性能,随机取向的ZnO 颗粒的抗菌效果优于规则取向的ZnO 颗粒[42]。
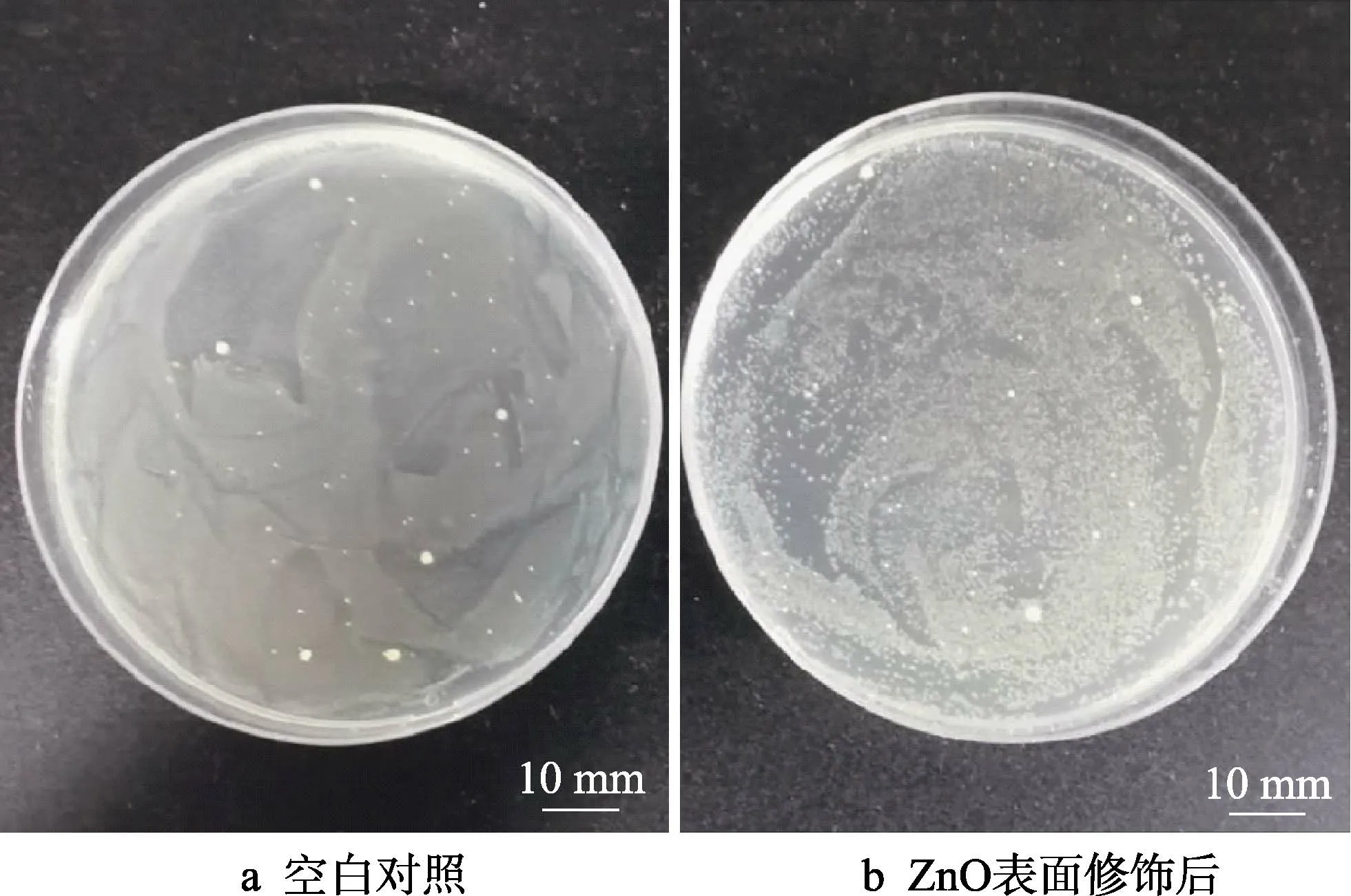
图9 Zn-3Cu 合金组织工程支架抑菌涂布照片 Fig.9 Antibacterial coated photograph of Zn-3Cu alloy tissue engineering scaffolds: a) blank; b) with ZnO coating
3 结论
1)制备的Zn-xCu(x=0,1,2,3)支架体孔洞分布均匀,连通性良好。
2)ZnO 表面修饰后的Zn-Cu 组织工程支架的表面润湿性得到改善,有利于细胞快速粘附,提高了支架材料的细胞相容性。
3)ZnO 表面修饰后的Zn-Cu 组织工程支架具有良好的抑菌、抗菌性能。

