中心静脉置管导致早产儿心包积液的临床分析
张雅慧 刘云峰 童笑梅 陆丹芳 石诗
(北京大学第三医院儿科,北京 100191)
中心静脉置管(central venous catheterization,CVC)作为一种损伤小且安全可行的置管模式,在新生儿重症监护病房(NICU)中应用广泛,可以有效降低反复穿刺伤害及外周静脉炎的发生率,被认为是早产儿中长期静脉输液的理想选择。其中以经皮外周静脉穿刺中心静脉置管(PICC)及脐静脉置管(UVC)应用最为普遍。然而在置入和维持过程中,也存在着很多并发症。在NICU中,心包积液是CVC并发症之一,严重者可进展为心包填塞。大量液体在心包内聚积可影响心脏舒张功能,继而引起严重血流动力学紊乱,如果不能及时诊断和治疗,死亡风险极高。心包穿刺术可明显改善预后,大幅度降低病死率[1]。本研究回顾性收集了近7年我院NICU病房CVC导致心包积液/心包填塞的11例患儿资料,对其临床表现、置管特征、诊疗策略及预后转归进行分析,以提高对此类疾病的识别和治疗水平。
1 资料与方法
1.1 研究对象
回顾性选取2013年1月至2020年10月我院NICU所有进行CVC的早产儿。入选标准:胎龄<37周且日龄<28 d,于CVC留置期间出现心包积液。排除标准:(1)置管前及拔除后发现的心包积液;(2)存在其他导致心包积液的因素或基础疾病,如先天性心脏病、心肌病、置管前已有的心功能不全、风湿免疫性疾病;(3)明确存在宫内感染,如TORCH、细小病毒B19感染等。
1.2 资料收集
收集患儿资料,包括患儿基本人口学信息;CVC类型,置入时间、部位、长度,管端定位方式及位置;发现心包积液时间、临床表现、处理措施、辅助检查及预后转归。
1.3 心包积液诊断
依据心脏超声诊断:经心尖四腔心、胸骨旁四腔心、大动脉短轴、左室长轴及剑下四腔心切面探查,如心包腔内可见液性暗区回声,即心包积液诊断明确[2]。于呼气末、心室舒张期末测量心包腔前后、游离壁外及心尖部液性暗区深度。
1.4 心包积液分度
基于成人心包积液进行分度,新生儿期主要参考心包积液分布情况:(1)轻度为平卧位探查时,局限于后心包腔探及液性暗区回声,不扩展到心包腔其他区域;(2)中度为心脏周围均可见液体积聚,以左心室下壁区域为主;(3)重度为包绕整个心脏,可见心脏摆动征,临床可出现心脏压塞征象[3]。
1.5 统计学分析
采用SPSS 25.0统计软件进行数据处理。正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用配对样本t检验。非正态分布计量资料以中位数和范围表示。计数资料以例数和百分率(%)表示。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
2013年1月至2020年10月我院NICU病房行CVC共计2 599例(其中UVC 1 187例,PICC 1 412例),发生置管相关心包积液共11例(UVC 4例,PICC 7例),发生率为0.42%(UVC 0.34%,PICC 0.50%)。11例患儿中,男性3例(27%),女性8例(73%);平均胎龄(30.1±2.6)周,范围28+3~32+3周;平均出生体重(1 240±234)g,范围950~1 680 g。心包积液发生于置入后10 h至9 d,发生在4 d内10例(91%)。PICC均于上肢置入,其中贵要静脉6例,腋静脉1例。见表1。
2.2 临床表现
3例患儿(27%)无明显临床症状及阳性体征,仅常规超声检查发现心包积液。另8例(73%)有心包积液临床症状,主要表现为一般情况差6例(55%),呼吸系统症状7例(64%),循环系统症状8例(73%),神经系统症状4例(36%),其他表现4例(36%)。严重者可出现休克表现,如血压下降、末梢循环灌注不良及多器官功能障碍。具体临床表现见表2。
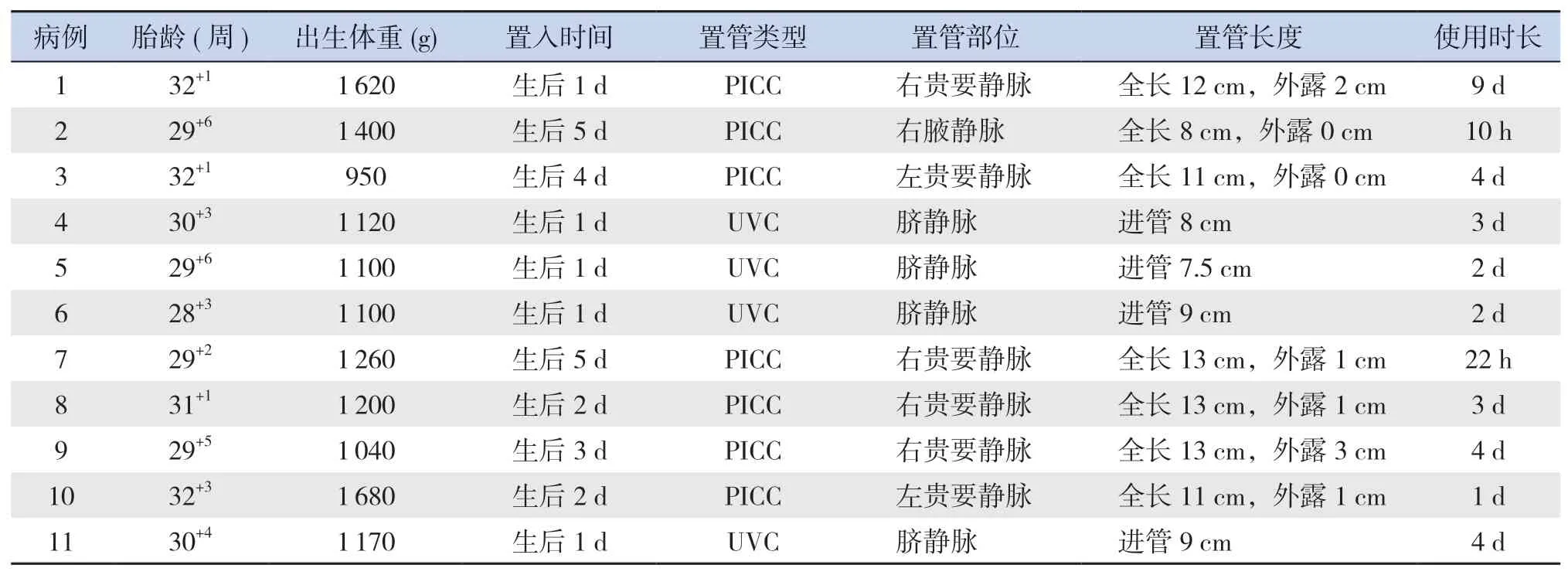
表1 心包积液患儿一般资料
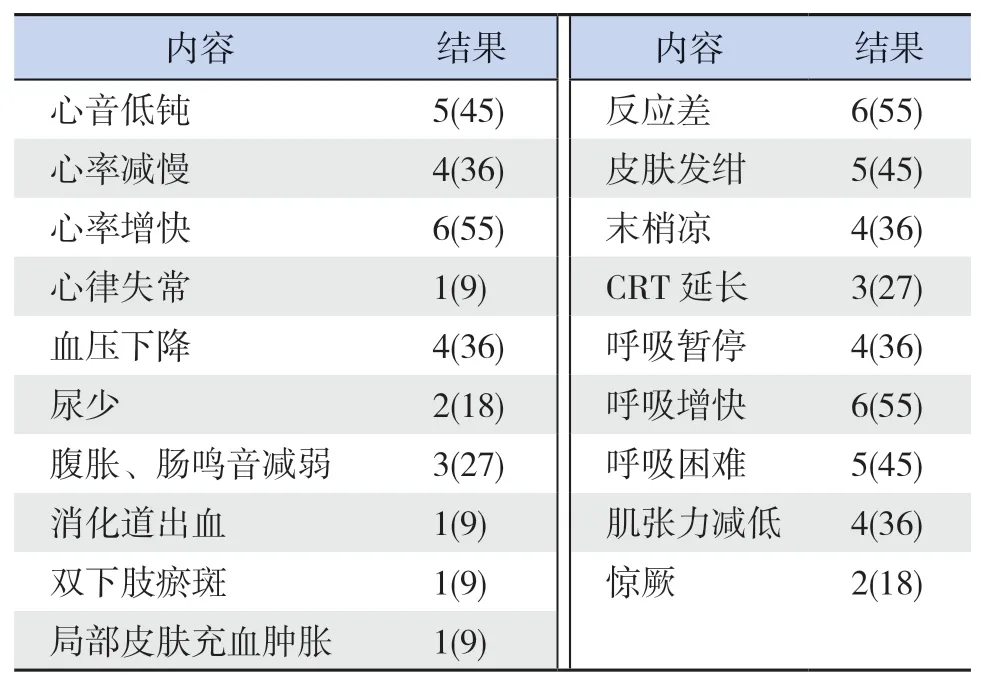
表2 11例心包积液患儿临床表现 [例(%)]
2.3 胸部X线片管端定位
心包积液前,10例(91%)患儿于置管当天行胸部X线片检查定位管端位置,位置正确6例(55%),位置过浅作为外周静脉使用1例(9%),位置过深3例(27%)。发生心包积液后复查胸部X线片管端位置正确2例(18%);位置较深3例(27%),其中PICC 2例(T5~T9),UVC 1例(膈上3 mm);另6例(55%)行胸部X线片复查时CVC已拔除。11例患儿发生心包积液/心包填塞后心胸比较置管前增大(0.59±0.09 vs 0.53±0.06,t=-2.88,P=0.02)。
2.4 心脏超声检查
心脏超声提示11例患儿均有中-大量心包积液,中位最大液深3.4 mm(范围2.1~10.0 mm),可见心脏摆动征4例(36%),左心功能减低6例(55%)。心脏超声探及深入右心房的CVC管端6例(55%),经卵圆孔进入左心房1例(9%);管端位置正常3例(27%);位于外周静脉1例(9%)。
2.5 临床治疗
5例(45%)发生心包填塞(病例1、2、3、4、9),其中4例行心包穿刺术,抽出乳糜样乳白色浑浊液体。另7例(64%)仅行保守治疗,其中4例因合并右侧胸腔积液行右侧胸腔穿刺术。
2.6 预后转归
11例患儿中有2例(18%)死亡,其中1例因合并严重代谢性酸中毒、内环境紊乱、急性肝肾功能衰竭,于病情变化第2天死亡;另1例合并呼吸循环衰竭、严重凝血功能紊乱、贫血,于发生心包填塞后3 h死亡。存活的9例(82%)患儿中2例于心包穿刺术后2 d内复查心包积液消失,7例患儿仅行保守治疗后心包腔内液体于治疗后7 d(范围1~17 d)吸收。存活患儿在随后的随访中均无心脏结构及功能受损(表3)。
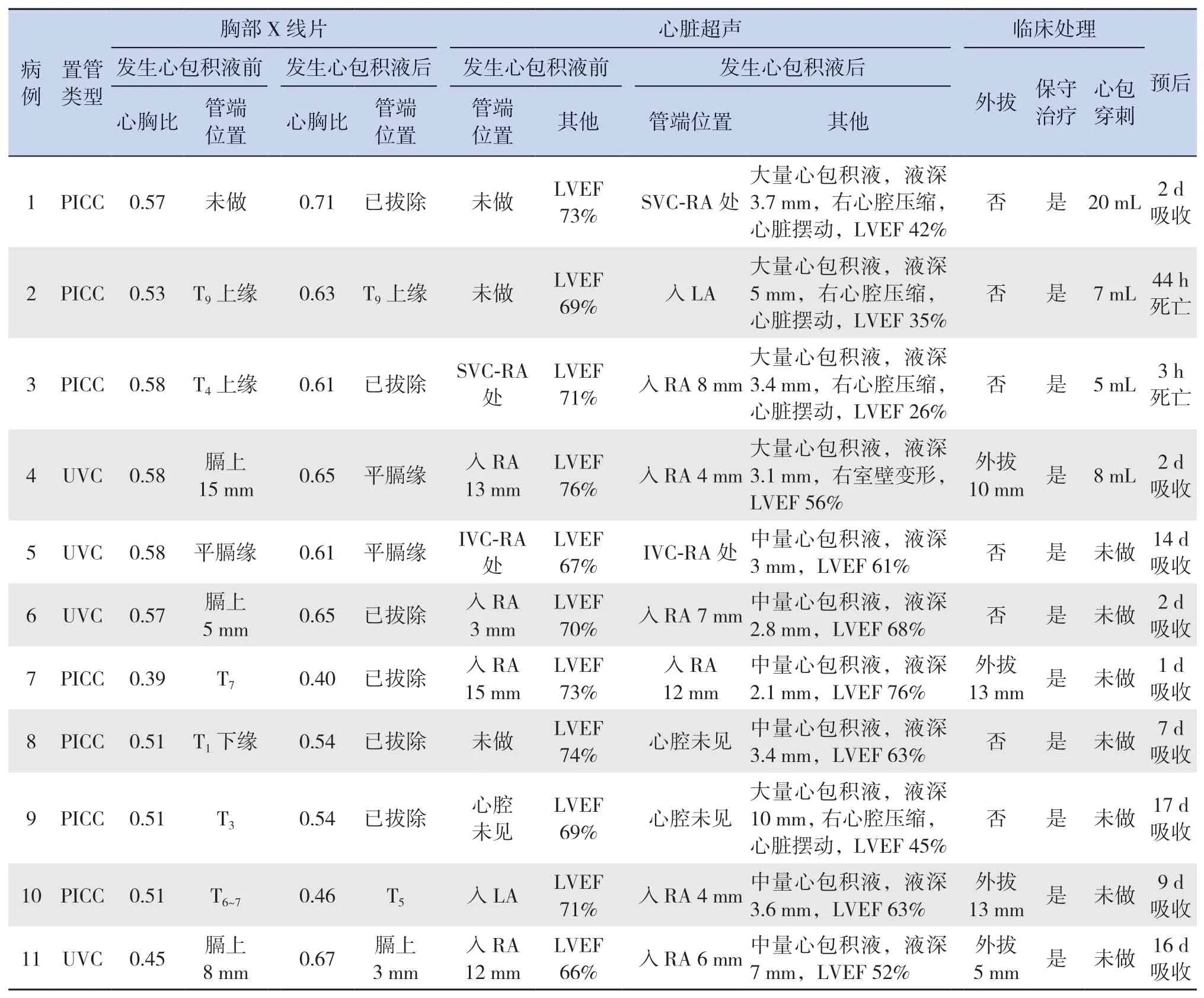
表3 11例心包积液患儿辅助检查、临床处理及预后
3 讨论
CVC相关心包积液、心包填塞主要发生在NICU住院早产儿中,是引起后天性乳糜性浆膜腔积液最主要原因[4]。本研究中CVC相关心包积液发生率为0.42%,引起心包填塞后病死率为40%(2/5),占CVC置管0.08%。国外研究显示,其发生率为0.18%~3%,引起心包填塞后病死率高达36%~95%,占所有CVC的0.5%~3%[5-6]。故心包积液是CVC少见的并发症之一,且进展为心包填塞则提示预后不佳。
心包腔内液体在短时间内大量聚集导致压力骤升、心脏舒张功能受限、心搏出量减低,可迅速出现症状。本研究患儿起病时以呼吸、循环系统症状为主要表现,表现为反应差、皮肤发绀,呼吸困难、呼吸增快、呼吸暂停及频繁血氧饱和度下降、心动过速、心律失常、心率减慢甚至停搏,心音遥远低钝、血压下降、末梢灌注差、毛细血管再充盈时间延长,并可快速进展出现多器官多系统受累、内环境紊乱,与既往研究相仿[7]。本研究中最终死亡的2例患儿在病情进展期均出现惊厥,考虑与患儿出现严重缺氧且不易逆转的代谢性酸中毒及内环境紊乱相关。
本研究中7例(64%)患儿在心包积液发生时心脏超声提示管端过深,于心脏轮廓内,管端深入右心房6例,经卵圆孔入左心房1例,且管端贴邻心房壁,提示管端位置过深是引起心包积液和/或心包填塞的主要危险因素之一。国内外均有文献支持:心内膜及心肌损伤是引起心包积液的主要原因[8]。CVC相关心包积液可由导管末端机械性损伤导致心房壁穿孔,但多数情况下,为导管尖端糜蚀右心房壁引起。国外尸检报道,CVC管端嵌合于明显变薄的右心房壁内时,心房壁完整,嵌合处心肌薄软,组织血栓形成、出血、局灶性胶原沉积、纤维化、心肌细胞凝固性坏死、血管内皮损伤、心内膜增厚,可见间质水肿及血管扩张,染色剂灌注最终弥散到心包间隙[9]。本研究中,3例(27%)患儿发生心包积液时影像学检查提示导管尖端位置正确,却最终引起心包积液,提示管端位置正确也有发生心包积液风险。既往文献也有类似报道,病理检查无直接损伤的组织病理学证据,但心房壁可见间质水肿和血管扩张,提示持续灌注高渗性液体如肠外营养液可引起血管内皮渗透性损伤,最终引起心包积液[10]。另有1例(9%)患儿管端位置过浅,于外周静脉内,置管位置出现局部充血肿胀、皮肤僵硬发灰,双侧胸腔积液及心包积液。可能原因是局部微血栓形成,腔静脉压力过高,淋巴回流受阻,从而出现乳糜性多浆膜腔积液[11]。
新生儿CVC管端最佳位置:由上肢置入PICC管端于上腔静脉中下1/2~1/3处,由下肢置入PICC管端应于胸廓以下的下腔静脉内,而UVC管端为下腔静脉和右心房的交界处[12-13]。CVC导管间断移位可导致心包积液发生[14]。本研究中3例(36%)出现不同程度的导管管端移位,其中PICC 2例(67%),UVC 1例(33%),均为管端向心腔内移位。因此,对于导管固定至关重要,如用完整辅料固定PICC外露端、U字形固定UVC外露导管,以减少移位发生。
本研究中发生心包积液于CVC置入术后10 h至9 d,10例(91%)发生于置管后4 d内,即置入早期发生心包积液可能性更大,与既往研究结果相符[5]。由于导管管端随肢体运动、姿势变化、腹围改变、脐带挛缩、心脏搏动等多重因素影响,导管移位无法完全避免。但早期由于缺乏典型临床表现,医护往往容易忽视,从而在置管后数天内才被发现[15]。故对管端位置监测也是非常必要的。CVC置入后,应每周至少2次检查导管位置,置入后早期应更为频繁。以任何原因进行胸部、心脏影像学检查时都应注意管端位置、心胸比及心脏形态变化,同时应确认患儿肢体姿势,如发现位置不正确,应立即予以纠正,然后重新进行管端定位[16]。
本研究中患儿全部为早产儿,胎龄29~32周,出生体重950~1 680 g,提示早产、低出生体重更易发生心包积液和/或心包填塞,病理机制可能与早产儿心脏组织薄软、发育不成熟相关,且目前的置管长度评估方法不能准确指导早产儿管端位置[17]。另外,低出生体重儿在生后早期由于体重下降导致腹围下降也可引起较为明显的管端移位[18]。
本研究中有5例发生心包填塞,其中4例行心包穿刺术,引流液均为乳糜样乳白色浑浊液体。4例患儿中,1例合并胸腔积液,行胸腔穿刺术,实验室检查提示引流液细胞数增多,以淋巴细胞为主,三酰甘油升高,葡萄糖水平未见上升,符合乳糜液特点,且该患儿浆膜腔积液反复迁延,行多次胸腔穿刺及闭式引流后好转,考虑为CVC导致的创伤性乳糜性心包积液可能性大。另3例行心包穿刺术患儿无合并胸腔积液,其中1例行实验室检查,细胞数及淋巴细胞百分比较低,葡萄糖浓度明显高于血清,结果不符合典型乳糜液特点,且行心包穿刺并拔除CVC后积液未再增多,结合既往文献报道的病理生理结果分析[9],考虑此3例为CVC导致静脉营养液渗漏相关。
本研究中,发生心包积液后患儿心胸比均有不同程度增大,但心影轮廓大致正常,未见典型“烧瓶心”样改变,故从胸部X线片中无法明确提示心包积液。而床旁超声检查因其将导管与心脏的位置关系可视化,具有准确、可靠、安全等优势,可实时进行管端定位,明确诊断及定量评估,识别有无心脏受压,评估大动脉搏出量变化,鉴别充血性心力衰竭、缩窄性心包炎等其他心脏疾病,并可作为定位工具辅助心包穿刺治疗[19]。
本研究中5例(45%)患儿出现心包填塞,严重血流动力学紊乱,其中4例行心包穿刺术治疗。死亡2例(40%),治愈3例(60%)。心包积液一旦出现血流动力学紊乱应警惕合并心包填塞,快速、准确诊断是避免病情恶化的关键。若心脏超声提示心腔受压变形、收缩功能减低、舒张功能受限、心搏出量减少,在无相关禁忌证的情况下尽快予以心包穿刺治疗,可有效避免进一步发展至心脏骤停[20]。对于血流动力学稳定的中等量以下心包积液患儿仅采取保守治疗,主要包括限制液体入量、利尿等。本研究中7例(64%)患儿仅行内科保守治疗,心包积液于治疗1~17 d完全吸收。存活的9例(82%)患儿长期随访均无心脏结构及功能受损,提示早期及时识别、诊断、干预可获得良好转归和预后。
CVC相关心包积液多发生在小胎龄、低出生体重的早产儿,且易发生于置管后4 d内,多与导管尖端深入心房内相关。临床表现多样,严重者出现心包填塞。对于血流动力学稳定的中量以下心包积液患儿可采取保守治疗,出现心脏压塞迹象时,心包穿刺可快速减轻症状、挽救生命。临床应提高对CVC早产儿心包积液的早期识别能力,早期诊断、密切监测,及时干预治疗可有效降低病死率。

