COVID-19疫苗的有效性和安全性的系统评价
邢凯 涂晓燕 刘苗 梁章武 陈江南 李姣姣 江利国 邢富强 姜毅
(武汉大学人民医院儿科,湖北武汉 430060)
新型冠状病毒肺炎(COVID-19)疫情暴发至今已1年余。虽然COVID-19疫情在我国已经得到了有效控制,但全球整体疫情形势依然严峻。根据世界卫生组织的数据,截至欧洲中部时间2021年2月15日16 : 05,全球累计COVID-19确诊病例达到108 579 352例,累计死亡人数达到2 396 408人[1]。作为全球的重大公共卫生事件,COVID-19疫情成为全人类首要的健康威胁,世界政治经济文化也受到巨大冲击[2-3]。导致COVID-19的严重急性呼吸综合征冠状病毒2(SARS-CoV-2)是以RNA为遗传物质的β属冠状病毒,通过刺突蛋白结合血管紧张素转化酶2进入细胞[4-5]。COVID-19患者的首发症状以发热和干咳多见,在多脏器损伤中,肺脏受损最为严重[2,5-6]。在疫情控制上,佩戴口罩和保持社交距离已经在中国抗击疫情的实践中被确认为阻断病毒传播最为有效的措施[3,7-9]。在对COVID-19患者的治疗上,隔离和对症支持治疗仍占主要地位[5],而关于抗病毒药物和中药等的疗效还需更多证据的支持[10-11]。由于口罩在国外普及率的低下和治疗方案的局限性[12-13],越来越多的希望被寄托在COVID-19疫苗的开发上。根据靶点和技术的不同,疫苗可以被分为以下几类:灭活疫苗、重组刺突蛋白疫苗、病毒载体疫苗、RNA疫苗、减毒活疫苗和病毒样颗粒疫苗等[14-16]。目前,已有数百项COVID-19候选疫苗的项目在美国临床试验数据库(clinicaltrials.gov)注册[15,17],数种疫苗的3期临床试验结果予以发表[18-22]。截至2021年1月1日,中、俄、美、英等国家先后批准了本国疫苗在人群中的大规模接种计划。本研究通过系统文献复习及定性分析已发表的COVID-19疫苗临床试验结果,评估COVID-19疫苗的安全性与有效性。
1 资料与方法
本系统评价遵循《系统评价和Meta分析的首选报告项目(PRISMA)》中的准则完成[23-24]。
1.1 文献纳入标准
文献纳入标准包括:(1)试验对象为18岁及以上的健康男性或未孕女性;(2)干预措施为接种COVID-19疫苗;(3)试验类型为随机、对照、盲法试验;(4)临床试验结果指标至少包括以下一项或几项:局部不良反应(疼痛、瘙痒、发红、肿胀和硬结等)、全身不良反应(发热、腹泻、疲劳、恶心/呕吐等)、末次疫苗接种14 d或28 d后以活病毒中和试验测得的中和抗体几何平均滴度(GMT)、血清转化率及其他实验室检测指标。
1.2 文献排除标准
具备以下条件之一的文献被排除:(1)文献类型为医学新闻、科普文章、非医学类论文、综述、信件、评论、基础研究、病例报告、会议摘要;(2)无法获取全文或以中文、英文外的第三种语言发表的文献;(3)若两项研究的受试者存在重叠,则其中之一被排除;(4)若文献的数据被之后发表的文献包含在内,前者予以排除。
1.3 文献检索
对英文数据库PubMed、Embase、Cochrane图书馆和clinicaltrials.gov数据库进行了检索。检索的中文数据库包括中国知网、万方数据库、中国生物医学文献服务系统和中国临床试验注册中心。为了保证检索结果的全面性,本系统评价运用布尔运算逻辑,采取“主题词+自由词”方式进行了检索。主要检索词包括:COVID-19、2019-nCoV、SARS-CoV-2、2019 novel coronavirus、vaccines、vaccination、COVID-19 vaccines、mRNA-1273 vaccine、Ad5-nCoV vaccine、ChAdOx1 COVID-19 vaccine、BNT162 vaccine、controlled clinical trial、randomized controlled trials、controlled clinical trial、random、blind、placebo、trial、Meta等。中文检索词包括新型冠状病毒、新冠肺炎、新型冠状病毒肺炎、疫苗、试验、随机对照试验、随机对照研究、随机对照、随机、元分析、Meta、荟萃等。
1.4 文献筛选和资料提取
文献筛选和资料提取工作由两位研究者独立完成。若结果汇总时出现分歧,由两位研究者讨论处理或交由第3位研究者决定。在数据库中获得的所有检索结果导入NoteExpress(武汉大学图书馆版)软件中,使用软件的查重功能机械地去除重复文献。然后通过阅读标题和摘要完成初次筛选,通过阅读全文完成二次筛选。在第二次筛选中,每一篇文献被剔除的原因均被记录。所提取数据包括:第一作者、疫苗类型、接种剂量、接种间隔时间、受试者人数及基线特征(种族、性别比例、年龄范围或平均年龄)、研究设计方案、局部和全身不良反应、实验室检查指标,以及基金、赞助商和注册号等。
1.5 方法学质量评价
依据Cochrane系统评价手册评估偏倚风险[25-26]。
1.6 统计学分析
本系统评价的主要结果包括疫苗的安全性和有效性。评估安全性的指标包括局部不良反应(疼痛、瘙痒、红肿、硬结等)及全身不良反应(咳嗽、腹泻、疲倦、发烧、头痛、恶心/呕吐、瘙痒、肌肉疼痛、关节痛/不适、厌食等)。评估免疫原性的指标包括GMT、血清转化率、IgG或其他特异性抗体对受体结合域的反应。
2 结果
2.1 文献检索结果
检索了截至2020年12月 31日之前发表的所有相关文献,共得到753篇。经过筛选后纳入13篇[19-22,27-35]进入本系统评价。文献筛选的具体流程见图1。
2.2 纳入研究的方法学质量评价
纳入的13项研究[19-22,27-35]均采用了随机对照的方法,其中10项[21-22,27-32,34-35]实施了双盲法,2项[20,33]实施了单盲法,1项[19]在不同试验地点分别使用了单盲法和双盲法;所有试验均隐藏了分配方案;9项[19,22,27,29-31,33-35]数据不完整或选择性报告,其中2项[22,29]预印本缺失数据较多,其余7项[19,27,30-31,33-35]缺失个别数据;9项[19-20,22,29-32,34-35]存在其他类型偏倚,如Keech等[30]在试验设计中未做病毒中和试验。总的来讲,所纳入文献的偏倚风险较低。见图2和表1。
2.3 纳入研究的基本特征
所纳入的13项研究均为随机、盲法、对照试验,共涉及灭活疫苗5种[21-22,27-29,34]、重组刺突蛋白疫苗2种[30,32]、RNA疫苗2种[20,31,33]和腺病毒载体疫苗2种[19,35],疫苗特性、开发者等信息见表2。有6项研究比较了疫苗单剂量与双剂量接种的效应[19,27,30-31,33,35]。大部分研究比较了以2周、3周或4周为间隔注射两剂疫苗的差别。大部分研究也比较了低、中、高不同注射剂量的差别。所有试验的参与者均为成年人,有5篇文献报道了疫苗在老年人群体中的结果[19-20,32-33,35]。所纳入研究参与者的基线特征见表3。
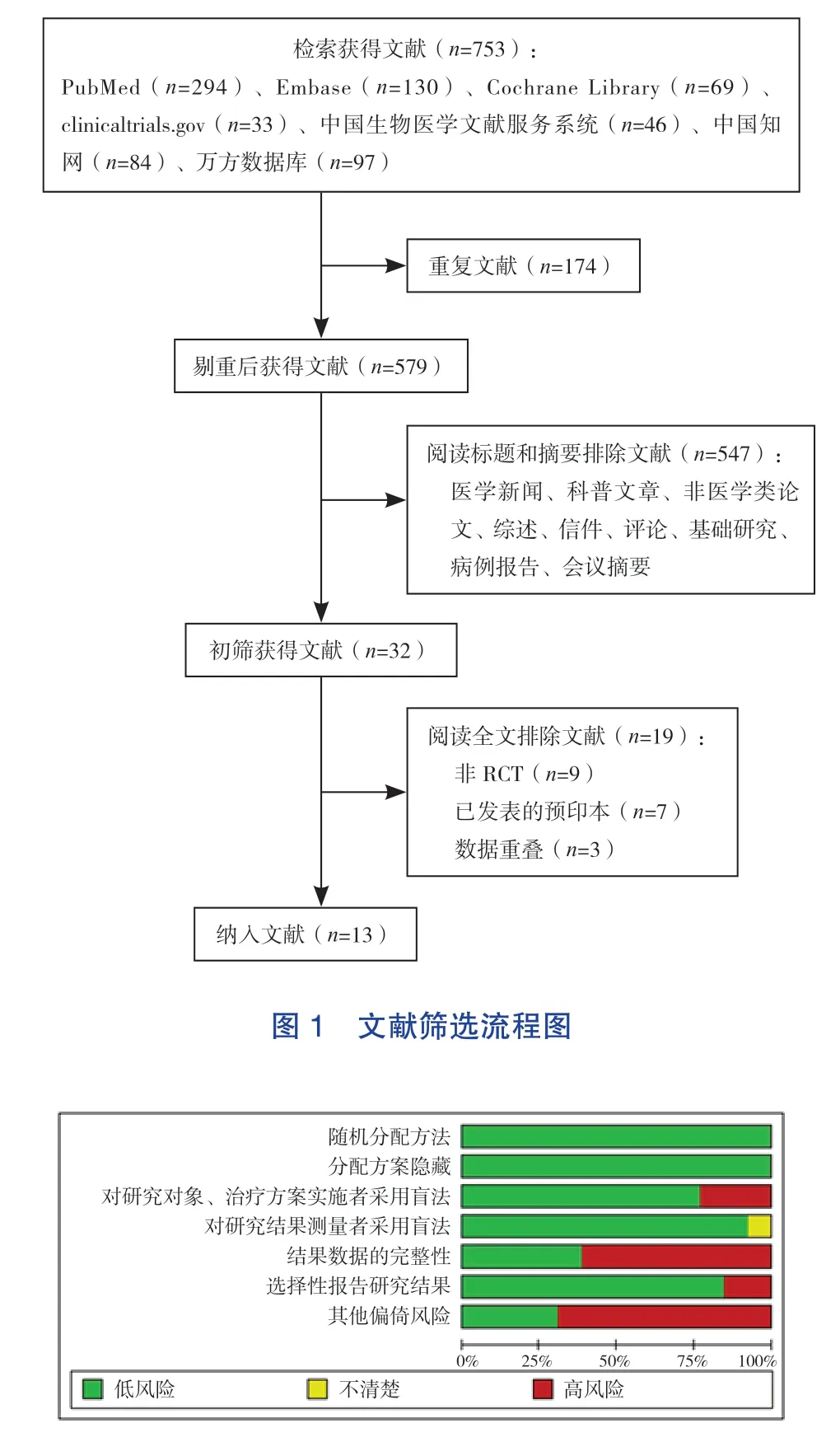
图2 文献偏倚风险评估
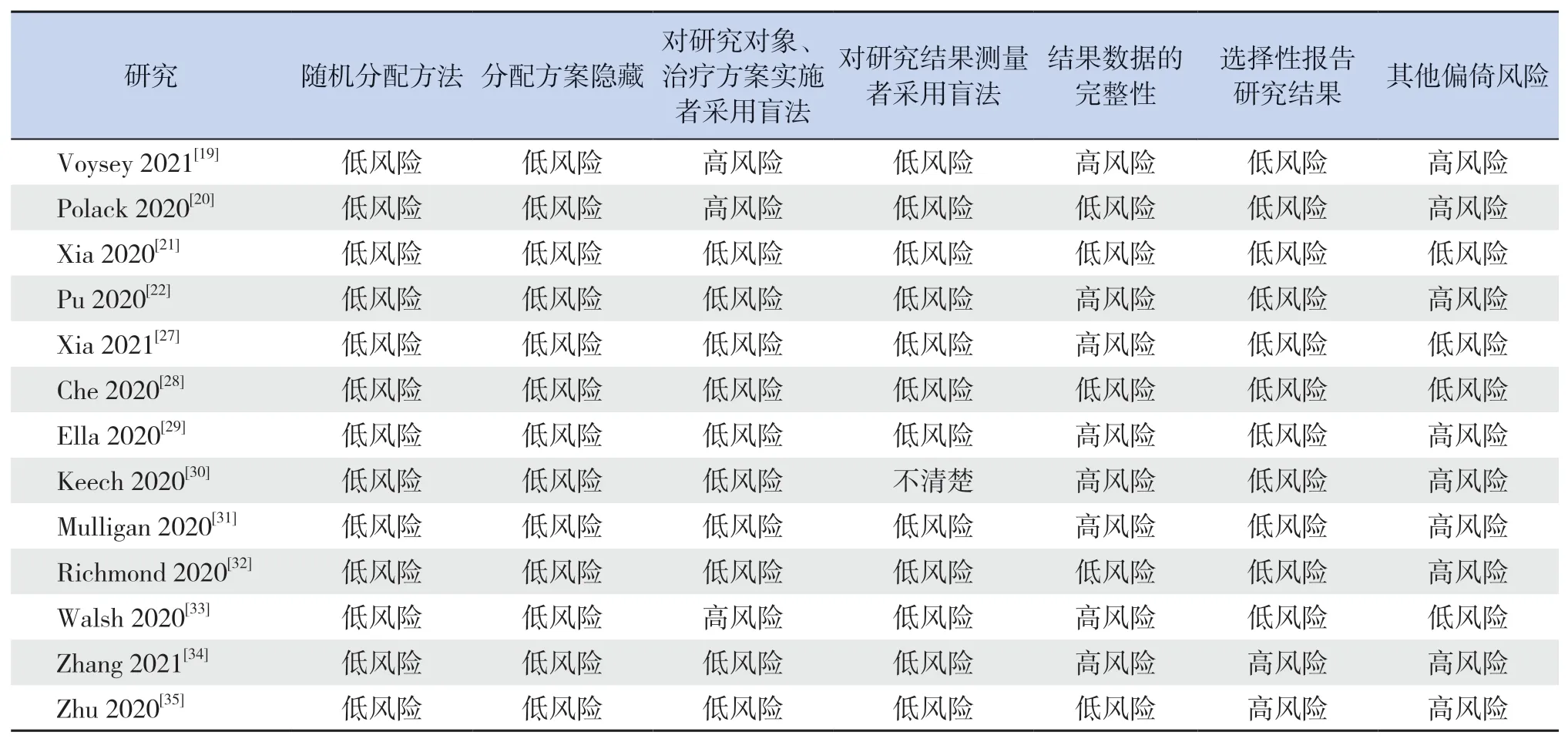
表1 纳入研究的方法学质量评价
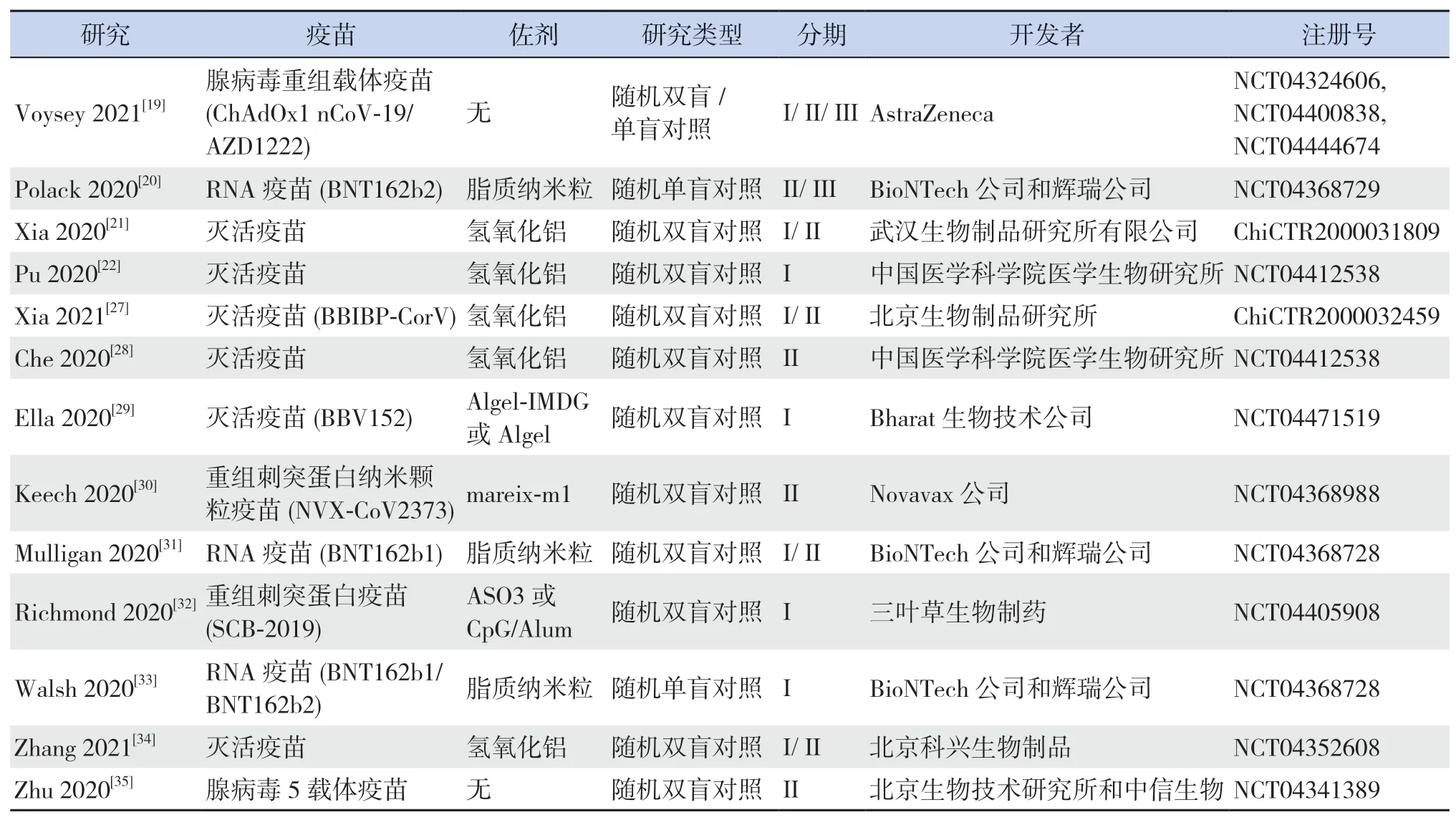
表2 纳入研究的试验设计和开发者
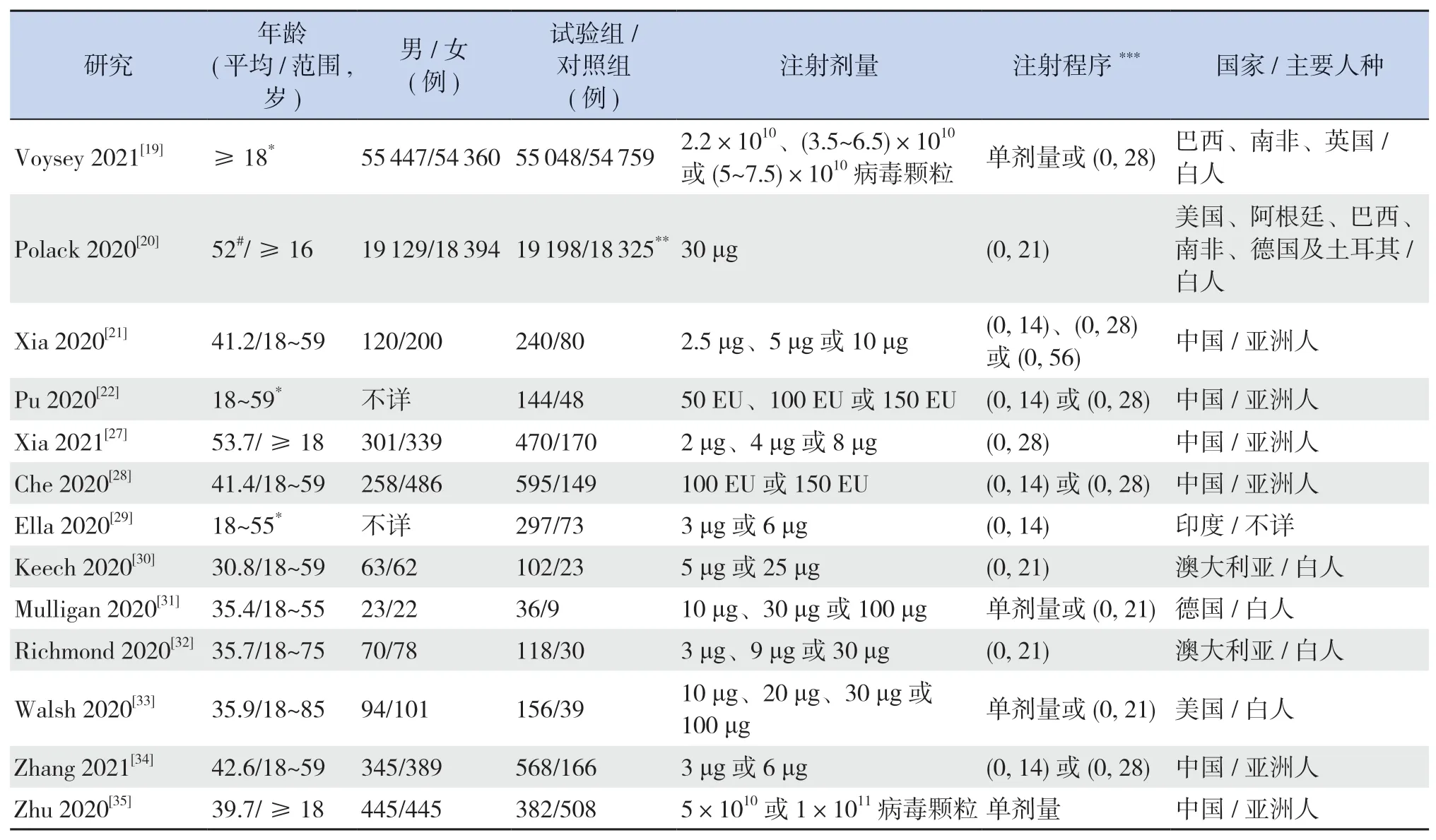
表3 纳入研究的基线特征
2.4 定性分析结果
2.4.1 疫苗的有效性和安全性 在10项研究中,受试者的28 d血清转化率超过80%[21-22,27-34];在两项万人规模的临床试验中,Polack等[20]报道的RNA疫苗(BNT162b2)取得了95%的有效率,Voysey等[19]报道的腺病毒重组载体疫苗(ChAdOx1 nCoV-19)取得了70.4%的有效率;Zhu等[35]报道的腺病毒重组载体疫苗在受试者中的28 d血清转化率低于60%。见表4。
在6项研究中,志愿者在接种疫苗后的28 d内不良反应发生率低于30%[20-22,27-28,34];Richmond等[32]报道的重组刺突蛋白疫苗(SCB-2019)和Walsh等[33]报道的RNA疫苗的不良反应率分别为34.7%和39.1%;Mulligan等[31]报道的RNA疫苗(BNT162b1)和Zhu等[35]报道的腺病毒重组载体疫苗的不良反应率分别为52.8%和73.0%;3项研究无法获取不良反应率[19,29-30]。所有疫苗接种的受试者发生不良反应事件绝大部分都是轻度到中度,且在接种后24 h内可缓解;所有疫苗接种最常见的局部不良反应均为注射部位疼痛或压痛[19-22,27-35];疲劳在9项研究中被报道为最常见的系统性不良反应[19-20,22,28-29,31,33-35]。此外,发热在2项研究中被报道为最常见的系统性不良反应[21,27],也有2项研究报道躯体痛为最常见的系统性不良反应[30,32]。见表4。
2.4.2 剂量差异的影响 注射剂量的不同是影响疫苗免疫原性和安全性的重要因素。共有9项研究[21-22,27-29,32-35]发现接受不同剂量疫苗接种的受试者获得的GMT和血清转化率存在显著性差异,其中8项[20-22,28-29,31,34-35]发现GMT随着疫苗剂量的增加而增加,4项[22,28-29,32]发现受试者血清转化率随疫苗剂量的增加而增加。但随着接种剂量的加大,不良反应的发生率也相对增加[22,28-29,32]。因此,当临床试验进入Ⅲ期阶段,研究者将中等剂量设定为疫苗的标准剂量[19-20]。
2.4.3 年龄差异的影响 有4项研究专门招募了60岁及以上的老年人群,并在结果中进行了专门的亚组分析。Richmond等[32]报道使用微量中和试验在老年人组测得的GMT范围为1 567~3 625,低于18~59岁组的2 510~4 452;而老年人在第1次注射后的全身不良反应发生率为17%,低于18~59岁组的38%。Xia等[27]也报道老年人组GMT低于18~59岁组,且达到血清转化时间晚于18~59岁组;而老年人在接种后7 d内的全身不良反应发生率为28.6%,低于18~59岁组的41.7%。Polack等[20]和Walsh等[33]两项研究也报道了相似结果。总之,相比于18~59岁的健康人群,老年人群按照相同的程序接种同种疫苗后,血清中所检测到的GMT显著偏低,但相应地老年人群中不良反应发生率也显著偏低[20,27,32-33]。
2.4.4 接种程序差异的影响 虽然多项研究设计了不同接种程序的对比,但试验结果是复杂的。Zhang等[34]的研究表明,以2周为间隔接种疫苗的受试者获得了更快的免疫反应,但以4周为间隔接种疫苗的受试者获得了更强的免疫反应。但Che等[28]在以2周为间隔接种疫苗的受试者中检测到了更强的免疫反应,Xia等[21]也发现以2周为间隔接种疫苗的受试者不良反应发生率低于以4周为间隔接种疫苗的受试者。在6项比较了疫苗的单剂量与双剂量接种的研究中,4项研究显示疫苗双剂量接种比单剂量接种产生更强的免疫反应[19,31,33,35]。
2.4.5 疫苗类型差异的影响 Polack等[20]报道的RNA疫苗(BNT162b2)和Voysey等[19]报道的腺病毒重组载体疫苗(ChAdOx1 nCoV-19)受试者人数超过10 000人,都采用相对危险度计算有效率,显示前者有效率为95%[20],后者有效率为70.4%[19]。其他临床试验的设计存在差异,受试者规模较小,结局指标也有所不同,其有效率尚无法比较。
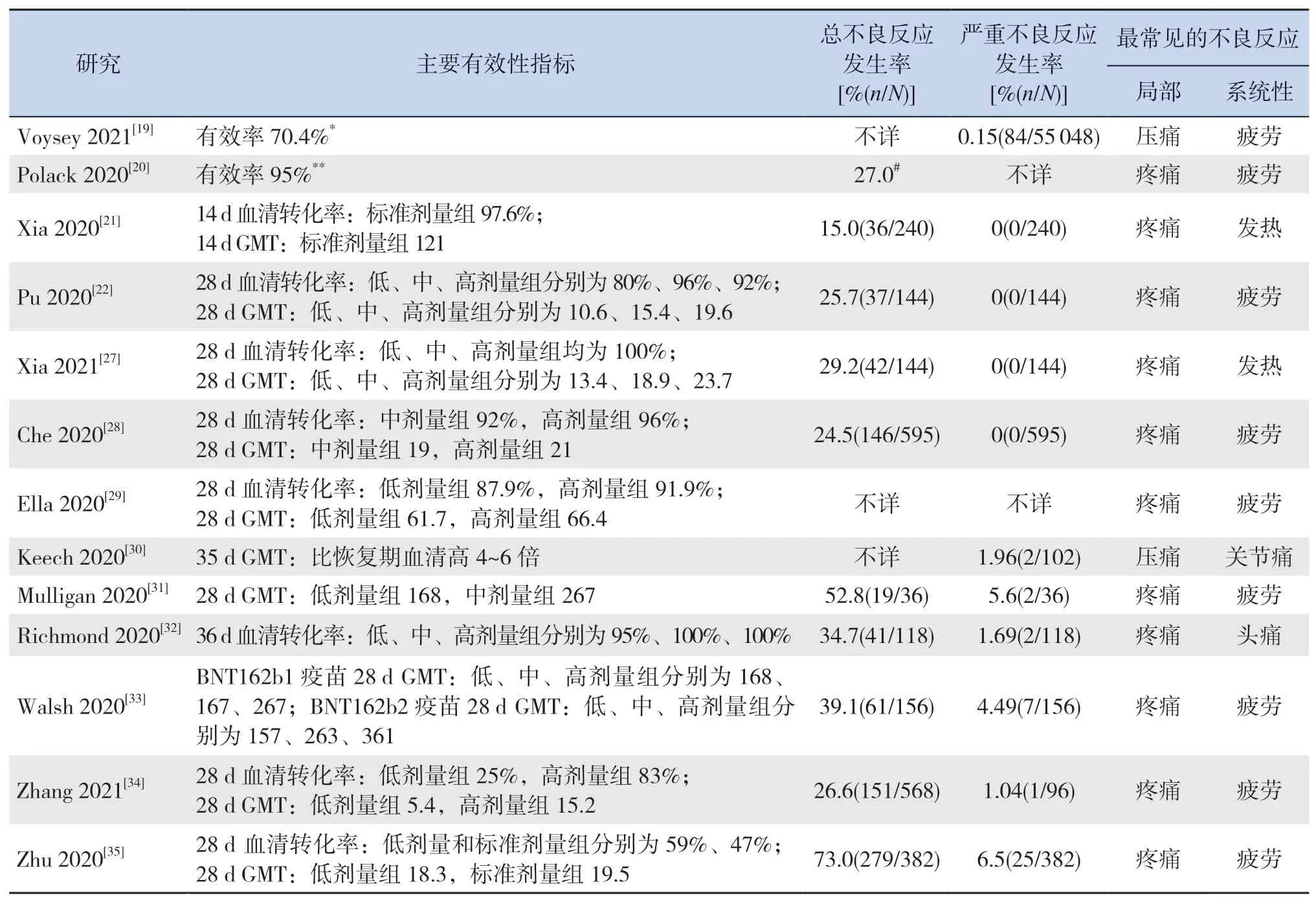
表4 疫苗的有效性和安全性
3 讨论
本系统评价得出以下结论:(1)除了Zhu等[35]报道的疫苗外,所有候选疫苗都具有良好的免疫原性和安全性。接种后28 d内,受试者血清GMT显著增加,血清转化率大多大于80%,大部分疫苗的不良反应率低于30%,且以轻到中度为主,24 h内缓解。(2)接种后产生的效价和不良反应率与剂量呈正相关,因此,大部分临床试验进入Ⅲ期阶段后,选择了中等剂量作为标准剂量,这可能是对有效性和安全性综合考虑的结果。(3)相同条件下,疫苗对60岁以上的老年人的免疫原性较差,但不良反应率也偏低,一种可能的解释是这与人体的免疫衰老有关。老年人群对疫苗的耐受性需要继续研究。此外,目前尚没有针对未成年人的临床试验结果发表。(4)大部分疫苗研究都推荐双剂量接种,但接种间隔时间需进一步研究。
然而,本系统评价有一定的局限性:(1)缺乏疫苗的长期有效性和安全性的证据。由于疫苗研发的急迫性,大部分试验只随访到了接种后28 d,中和性抗体能否长期维持,接种疫苗后是否有迟发的不良反应,仍需要更长时间的随访。(2)为了纳入更多最新证据,本系统评价也将预印本文献包含在内,这些文献没有经过同行评议,且其中一些数据无法获取。(3)本系统评价只纳入了随机、双盲、对照试验,而观察性研究、回顾性病例分析及早期的动物试验均被排除在外。如Anderson等[36]实施的一项开放标签试验发现mRNA-1273疫苗在老年人群体具有较好的安全性,Logunov等[37]在非随机临床试验中报道了两种腺病毒重组载体疫苗制剂(rAd26-S和rAd5-S)在18~60岁健康人群具有较好的安全性和免疫原性。(4)各项临床试验的设计存在差异,导致无法对不同类型疫苗的优劣进行比较,如Voysey等[19]和Polack等[20]采用相对危险度计算有效率,Keech等[30]未做病毒中和试验,其余10项研究虽然均完成了病毒中和试验,但试验设计方案差异较大[21-22,27-29,31-35]。(5)本系统评价只检索了中英文文献,以日文、法文等其他语言发表的文献被排除在外。
综上所述,本系统评价总结了COVID-19疫苗相关的临床试验结果,表明大部分疫苗都具有较好的安全性和有效性。这让我们有理由相信,随着COVID-19疫苗的广泛接种,有望控制、终结COVID-19的全球大流行。
利益冲突声明:所有作者均声明不存在利益冲突。

