《川崎病心血管后遗症的诊断和管理指南(JCS/JSCS 2020)》解读
穆志龙 焦富勇 谢凯生
(1.陕西省人民医院儿童病院/陕西省川崎病诊疗中心,陕西西安 710068;2.台北医学大学署立双和医院,台湾台北)
自1967年川崎病(Kawasaki disease, KD)首次被报道以来,已经过去了50多年[1]。越来越多的儿科医生开始关注KD所引起的心血管问题。尽管目前使用大剂量人免疫球蛋白治疗KD已广泛推行,但我国 KD急性期冠状动脉病变(coronary artery lesion, CAL)的发生率仍然高达15.9%,冠状动脉瘤(coronary artery aneurysm, CAA)的发生率为1.8%[2]。相关研究表明,CAA瘤体大小、持续时间与远期预后密切相关,其中以巨大冠状动脉瘤(giant coronary artery aneurysm, GCAA)预后最差,其管腔内血栓形成或内膜增厚可导致冠状动脉狭窄,造成心肌缺血、梗死,严重者可猝死[3]。随着KD诊疗技术的进步,CAA及血栓检出率不断提高,其在KD病程急性期或后遗症期均可出现,一旦发生,风险高、预后凶险,因此及时准确识别并积极处理非常重要。
许多KD心血管后遗症诊治方案在成年患者有确切的证据,但这些证据在儿童患者还没有得到充分证实,因此KD心血管后遗症的诊治方案在儿童的可取证据目前仍很欠缺。日本循环学会(JCS)联合日本心脏外科学会(JSCS)于2020年7月共同发布了《川崎病心血管后遗症的诊断和管理指南(JCS/JSCS 2020)》[4](以下简称“JCS/JSCS 2020指南”)。JCS/JSCS 2020指南系统介绍了川崎病心血管后遗症的诊疗和管理新进展。本文对该指南中关于儿童KD心血管后遗症的诊断、治疗、远期管理等方面的内容进行解读。
1 KD心血管后遗症的诊断和治疗指南推荐评估
关于 KD心血管后遗症诊治的最优方案信息变化快,其指南也随着时间推移快速更新。JCS/JSCS 2020指南是基于专家组成员的临床专业知识及文献证据而制定的。专家组考察了临床数据的多个方面,然后将每个建议按照分类推荐及证据级别两个方面进行评估(表1~2)。

表1 分类推荐

表2 证据级别
2 KD严重程度评估
评估KD患者严重程度的最重要因素为是否存在CAL及其严重程度。JCS/JSCS 2020指南强烈推荐使用Z值进行评估(Ⅱa类推荐,B级证据)。
2017年美国心脏协会的声明引起了人们的注意,其强调Z值反映了个体相对于相同体表面积正常人群的位置变量,其大小反映KD个体偏离正常值的程度,对于评估KD的冠状动脉扩张有重要的临床价值[5]。该声明将Z值2.0~<2.5定义为“仅冠状动脉扩张”。在日本,把急性期CAL达到CAA的水平,但却在病程1个月后达不到CAA水平者定义为“暂时性冠状动脉扩张”,且大多数病例属于此范畴[4]。如果这种暂时性的扩张持续存在,没有必要长期观察,因为它不会带来明显的问题。从长期管理的角度来看,对于冠状动脉后遗症,以Z值评估严重程度为标准方法,建议评估左回旋支和右冠状动脉主干近段、中段、远段 3 个部位的 Z 值。JCS/JSCS 2020指南指出,对于远端没有 Z 值的冠状动脉,可以采用冠状动脉内径绝对值的方法进行评估。推荐Z 值评估CAL标准为:(1)无病变:Z值始终<2。(2)仅冠状动脉扩张:2≤Z值< 2.5;或最初Z值< 2,随访期间Z值下降>1。(3)小型CAA:2.5≤Z值< 5。(4)中型CAA:5≤Z值<10,或绝对值内径< 8 mm。(5)GCAA:Z值≥10,或绝对值内径≥8 mm。且将Z值≥2.5定义为长期显著CAL(后遗症)(Ⅱa类推荐,B级证据)。
JCS/JSCS 2020指南指出,传统测量冠状动脉内径绝对值的方法仅限于5岁以下儿童的评估或无法获取Z值的情况下选用(小型CAA:3 mm≤内径<4 mm;中型CAA:4 mm≤内径< 8 mm;GCAA:内径≥8 mm)。然而没有5岁以上患儿实际测量值的评估标准,建议5岁以上患儿采用Z值评估。JCS/JSCS 2020指南指出,对于发病1个月后CAL的定义分为以下5级:Ⅰ级,冠状动脉无扩张;Ⅱ级,急性期短暂扩张,轻微的一过性扩张,在发病后1个月恢复正常;Ⅲ级,发病1个月后合并CAL,并发现双侧冠状动脉在随访中恢复正常;Ⅳ级,冠状动脉造影术显示单侧或双侧CAA,各种试验无缺血性结果;Ⅴ级,冠状动脉造影显示冠状动脉狭窄病变,各种试验无或均有缺血性表现。
3 KD心血管后遗症的检查和诊断
3.1 血液检查及生物标记
主要包括肌酸激酶同工酶(CK-MB)及心肌肌钙蛋白T或I(cTnT或cTnI)。传统上,CK-MB是心肌坏死最常见的标志物,已广泛用于心肌梗死的诊断和预后预测[6]。CK-MB对心肌具有特异性,若考虑CK-MB与总肌酸激酶(CK)的比值,则评价心肌损伤的意义较大。ST段抬高型心肌梗死患者CK-MB水平在发病后3~8 h开始升高,10~24 h达到峰值,3~6 d后恢复正常。CK和CK-MB与心肌肌钙蛋白相比,其诊断心肌梗死的敏感性较低[7]。
肌红蛋白也是一种诊断心肌梗死的常见标志物,在心肌梗死发病后1~2 h升高,10 h左右达到峰值,24~48 h恢复正常水平,对心肌梗死的早期诊断、再灌注检测均有帮助。另一方面,肌红蛋白对心肌的特异性较低,不能作为独立的标志物。心脏型脂肪酸结合蛋白(H-FABP)是一种富含于心肌细胞细胞质中的小分子蛋白。H-FABP对心肌的特异性在一定程度上高于肌红蛋白。可用于急性心肌梗死的早期诊断和危险分层。与高敏感性肌钙蛋白相比,H-FABP对超急性期心肌梗死的诊断敏感性较低[4]。
血脂检测对KD患者发生动脉粥样硬化的诊断必不可少。据报道,在KD急性期血清高密度脂蛋白胆固醇(HDL-C)降低,在对KD合并CAL患者的长期随访中也可以观察到HDL-C降低[8]。有研究对长期随访的KD患者(急性疾病后7~20年)和年龄匹配的健康对照者检测动脉粥样硬化各标志物,显示KD患者的总胆固醇和载脂蛋白B水平明显高于健康者[9]。
3.2 心电描记法
3.2.1 静息心电图 静息心电图是在KD冠状动脉后遗症发作的远期阶段的基本随访检查之一。通过对比其他形式心电图和既往心电图结果,可以筛查缺血事件(Ⅰ类推荐,C级证据)。
3.2.2 动态心电图 如果急性期出现心律失常,或患者主诉胸痛、心悸,建议行动态心电图检查。其优点是可以用于不能运动的婴儿检查心律失常、ST-T改变和Q波的出现。
3.2.3 运动心电图 运动心电图对儿童具有临床意义,因为它简单且执行起来相对安全。对于幼儿来说,可在以任意节奏跳跃后进行运动心电图检查。对于小学低年级学生,可通过跑步机测试、评估运动量后进行运动心电图检查。对于KD并发CAA患儿心肌缺血的检测,运动心电图的敏感性并不是很好,建议与影像学检查联合使用。
3.2.4 其他心电图检查 如载药体表心电图、心磁图和信号平均心电图已被研究,但在目前的日常实践中尚未得到广泛应用。
3.3 超声心动图
3.3.1 静息超声心动图 超声心动图是KD的基本检查,因为它的侵入性小,可以反复进行。这对于评估冠状动脉随时间的扩张和CAA中是否存在血栓是有用的[10]。可评估心肌节段性运动不良、心肌缺血引起的腱索和瓣膜损伤及心功能状态,可结合组织多普勒显像和二维斑点追踪分析心肌的变形与应变率,评估不同节段心肌的缺血。对于冠状动脉扩张及CAA的诊断,内径的正常值除绝对直径外,还采用Z值。
3.3.2 负荷超声心动图 负荷超声心动图(stress echocardiography, SE)包括通过运动或药物(多巴酚丁胺或双嘧达莫)负荷评估左心室壁运动。运动SE仅适合于大龄患儿。特别是多巴酚丁胺负荷,已被确立为缺血性心脏病的诊断方法。它是一种有用的微创诊断缺血的方法,也是KD的随访方法。
3.4 冠状动脉造影
冠状动脉造影(coronary angiography, CAG)是KD中最具侵入性的影像学检查,可以对冠状动脉管腔进行详细的图像评估,是评估CAL狭窄程度、预后预测和治疗指征的金标准。然而,随着冠状动脉MRI和冠状动脉CT等非侵入性成像技术的发展,近年来KD后冠状动脉疾病确诊和随访所需的检查数量有所下降。
有诱发性心肌缺血证据的患儿应进行有创性CAG(Ⅰ类推荐,A级证据)。经皮冠状动脉介入治 疗(percutaneous coronary intervention, PCI)或冠状动脉旁路移植术的患儿应在1年内进行侵入性CAG(Ⅱb类推荐,C级证据)。急性期中度至GCAA患者应定期行侵袭性CAG(Ⅱa类推荐,C级证据)。即使无明显诱导性心肌缺血,经冠状动脉MRI或冠状动脉CT等非侵入性影像学检查提示有明显冠状动脉狭窄的患儿,也应进行侵入性CAG检查(Ⅱa类推荐,C级证据)。经超声心动图等非侵入性成像提示有冠状动脉内血栓的患儿,除侵入性CAG 外,还应进行冠状动脉内溶栓治疗(Ⅱb类推荐,C级证据)。
3.5 其他方法
心肌灌注成像、计算机断层血管造影(CTA)(Ⅱa类推荐,C级证据)和MRI已被广泛用于检测和诊断心血管后遗症。分流储备、血管内超声和光学相干断层摄影,也可以使用。特别是在年龄较大的儿童中,心肌灌注成像、CTA、MRI/磁共振血管造影术(MRA)等(Ⅱa类推荐,C级证据)的应用已变得广泛。如果不需要介入治疗,经心导管冠状动脉选择性造影术的意义有限。
4 心血管后遗症的治疗
对于有心血管后遗症的 KD患者,缺血性心脏病的治疗对于改善症状和预防或治疗心血管事件是重要的。缺血性心脏病是由于冠状动脉狭窄或梗阻而导致心肌氧供应不足,大致可分为心绞痛和心肌梗死。在成人中,根据心电图结果将其分为不伴有持续性ST段抬高的急性冠状动脉综合征和ST段抬高的急性心肌梗死[11]。KD引起的心肌缺血是由CAA的血栓性阻塞,以及由于内膜增厚而导致CAA流入或流出的管腔狭窄而引起[12],这些情况都需要接受药物或非药物治疗。
4.1 药物治疗
4.1.1 他汀类药物 据报道,他汀类药物具有多方面的药理作用,合理的作用如抗炎作用、抗氧化作用、抑制凝血作用和促进溶栓作用,以及降低胆固醇水平,有望改善血管内皮功能[13]。在干酪乳杆菌细胞壁提取物诱导的KD型血管炎模型中,阿托伐他汀抑制了T细胞活性和增殖、TNF-α的产生和基质金属蛋白酶(MMP)-9的激活[14]。因此,他汀类药物有望对CAL起到修复作用。JCS/JSCS 2020指南建议,对于 CAA 患儿可考虑他汀类药物的非降脂(多效性)作用,考虑经验性使用他汀类药物治疗(Ⅱb类推荐,C级证据)。
4.1.2 血管紧张素转换酶抑制剂和血管紧张素Ⅱ
受体拮抗剂 经常在多发性动脉瘤病变的动脉瘤的近端和远端部位或在动脉瘤间部位观察到明显的冠状动脉狭窄。这种狭窄是作为血管重建的一部分,是由于内膜周围增厚而形成,这在很大程度上是由位于血管壁的肾素-血管紧张素系统的作用引起的。血管紧张素Ⅱ通过血管紧张素Ⅱ-1型受体诱导血管平滑肌细胞肥大,促进细胞外基质产生,氧化应激增加,黏附分子和生长因子产生增加或细胞因子/趋化因子表达增加[15]。有报告称,血管紧张素Ⅱ受体拮抗剂[坎地沙坦0.2~0.3 mg/(kg · d),在CAA形成后的几天内开始]可能通过内膜过度增厚有效预防冠状动脉狭窄[16]。
4.1.3 抗血小板药 KD急性期的血小板数量多在发病后立即减少,病情严重时进一步减少,然后在恢复期增加。基于血小板聚集和血小板衍生微粒子的研究显示,血小板数量一般在患病31~40 d后恢复正常,并且血小板活化在发作后的2~3个月内仍持续[17-18]。因此,在此期间,所有患儿均应给予口服抗血小板药物治疗,对于持续性CAA患儿继续给予抗血小板药物治疗,以预防血栓形成和缺血性心脏病(Ⅰ类推荐,C级证据)。
(1)阿司匹林:阿司匹林通过乙酰化抑制环氧合酶-1抑制血栓素A2的产生,阻止血小板聚集,从而具有抗血小板作用。患有心血管后遗症的KD儿童需要及时应用阿司匹林。因为阿司匹林是急性治疗的标准疗法,如果诊断为KD并且出现发热,就应该开始口服中等剂量的阿司匹林[30~50 mg/(kg · d),每日3次]。退热后,阿司匹林降至低剂量[3~5 mg/(kg · d),每日1次,口服],即使没有CAA,仍持续至发病后2~3个月(Ⅰ类推荐,C级证据),如果有CAA,则降至消退(Ⅰ类推荐,C级证据)。根据包装说明书,既往有过敏史、消化性溃疡、出血倾向、阿司匹林哮喘等症状为禁忌证;严重肝功能障碍需要谨慎用药,但不是禁忌证。由于与雷氏综合征有关系,如果患者患有水痘或流感,最好停止服用阿司匹林。环氧合酶-1的抑制作用在血小板的细胞寿命中持续8~10 d,停服阿司匹林后,这种效果会持续几天以上,直到大部分是新产生的血小板[19]。因此,改用另一种抗血小板药物通常是不必要的。
(2)双嘧达莫:双嘧达莫主要通过抑制磷酸二酯酶来增加环磷酸腺苷浓度,具有抗血小板作用。在使用说明书中没有说明KD患者的使用剂量,但可以保守使用,2~5 mg/(kg · d),口服,每日3次。
(3)氯吡格雷:噻氯匹啶和氯吡格雷抑制二磷酸腺苷受体P2Y12和G蛋白偶联,并通过抑制腺苷酸环化酶增加环磷酸腺苷浓度,诱导抗血小板作用。儿童患者口服噻氯匹定2~5 mg/(kg · d),每日2~3次;氯吡格雷0.2~1.0 mg/(kg · d),每日1次。据报道,0~24月龄的婴儿服用氯吡格雷0.2 mg/(kg · d)就足够了[20]。早期可能出现血栓性血小板减少性紫癜、粒细胞缺乏症和严重的肝功能障碍等不良反应。
(4)其他药物:氟比洛芬是环氧合酶-1抑制剂,对急性KD型肝功能障碍患者有较好疗效[21],但氟比洛芬是否比阿司匹林对肝功能障碍患者的不良反应更小还没有足够的证据证明。西洛他唑是一种磷酸二酯酶抑制剂,在严重冠状动脉狭窄的患者中需要谨慎使用,因为它会增加心率[11]。新的P2Y12抑制剂普拉格雷,被报道用于儿童镰状细胞病[22-23]。
4.1.4 抗凝药 (1)华法林:华法林具有与维生素K相似的化学结构,可抑制肝脏中维生素K依赖性凝血因子的产生,从而产生抗凝作用。华法林可应用于儿童和成人血栓栓塞,其包括心肌梗死和静脉血栓。儿童口服剂量[12月龄以下0.16 mg/(kg · d),1岁以上和15岁以下0.04~0.10 mg/(kg · d),每日1次]。由于对华法林的敏感性因人而异,同一个人也会发生变化,所以必须使用国际标准凝血酶原时间比(PT-INR)定期调整剂量。华法林的作用易受饮食和药物相互作用的影响。发酵大豆(纳豆)、绿色果汁和强化维生素K的配方奶会降低其效果,而母乳喂养和减少喂养会提高其效果。华法林治疗KD的指征是GCAA、既往心肌梗死史和CAA血栓形成。考虑年龄、婴儿出血风险高、临床情况等因素,将剂量调整到PT-INR目标范围2.0~2.5(Ⅱa类推荐,C级证据)[10,24]。
(2)肝素钠(未分离肝素):肝素钠激活抗凝血酶Ⅲ,抑制凝血酶、ⅠXa-XⅡa因子和激肽酶,从而抑制血液凝固。儿童静脉维持剂量为10~20单位/(kg · h),连续输注或不连续输注50 mg/kg,输注时间大于10 min[10]。有些机构开始时使用剂量较低,5~8单位/(kg · h),随后根据出血风险适当增加。JCS/JSCS 2020指南建议活化部分凝血酶时间(APTT)目标值为对照组的1.5~2.5倍,约等于46~70 s[10]。潜在出血、严重肝肾功能障碍、术后立即出血或中枢神经系统损伤、过敏、既往肝素所致血小板减少史等为相对禁忌证[19,25]。
(3)其他药物:如肝素或肝素类药物、肝素钙、皮下注射制剂、低分子肝素联合抗凝血酶Ⅲ、达那肝素钠(danaparoid sodium)和磺达肝癸钠(fondaparinux sodium)等均可考虑使用。作为最近开发的直接口服抗凝剂(DOAC),即达比加群、利伐沙班、阿哌沙班和依多沙班4种药物主要用于成人心房颤动。尽管它们都不属于儿童适应范围,但利伐沙班对儿童深静脉血栓形成和丰坦术后的临床试验仍在进行中。DOAC治疗KD的临床试验有望进行。
4.1.5 特殊治疗 冠状动脉后遗症是KD患者最主要的死亡原因,其冠状动脉狭窄处新形成的血栓可导致心肌缺血,血栓一般位于动脉瘤的入口或出口[26]。GCAA患者发生血栓性闭塞的风险最高。目前还没有关于儿童KD冠状动脉后遗症的溶栓治疗的高水平证据研究,因此,该建议是基于成人动脉粥样硬化性缺血性心脏病领域的证据。溶栓治疗应该在不能进行PCI的儿童或早期PCI无法进行的情况下进行。对于ST段抬高或完全性左束支传导阻滞的急性心肌梗死,建议在发病后12 h内和就诊后2 h内进行再灌注治疗。虽然初次PCI对于适合导管介入的患者是理想的,但对于合并KD的小儿急性冠状动脉综合征患者推荐溶栓治疗(Ⅰ类推荐,C级证据)。
为了改善急性冠状动脉综合征的预后,充足的冠状动脉再灌注(TIMI3)是强制性的,无论采用全身性溶栓还是PCI。心血管血管造影和介入学会指南[27]建议在急性心肌梗死发病后12 h内进行溶栓治疗。在日本,通常在未进行溶栓治疗的情况下进行原发性PCI,特别是在到达医院后90 min内。然而,对于合并KD的儿童CAA是否应该采用溶栓或PCI治疗,目前还没有足够的证据。部分原因是与动脉粥样硬化性急性冠脉综合征相比,合并KD的急性冠状动脉综合征患者较少,而且儿科患者的初次PCI只能达到平均水平。此外,在GCAA病例中,即使是经验丰富的介入科医师也很难将导管通过狭窄/闭塞部位。因此,是否采用PCI应慎重决定,对于儿童,多选择全身溶栓治疗。其原因为:首先,急性冠状动脉综合征作为KD后遗症主要由CAA血栓性闭塞引起;其次,出血并发症在儿童中较成人少见。此外,儿童因体型较小,PCI操作通常比成人困难。当全身性溶栓效果不足时,应考虑冠状动脉内溶栓(Ⅰ类推荐,C级证据)。
对于ST段抬高或伴完全性左束支传导阻滞的急性心肌梗死患者,溶栓治疗的效果已经确定。事实上,在发病后12 h内越早开始溶栓治疗,死亡和并发症的发生就越少。当急性冠脉综合征发病后12 h内和到达医院后2 h内不能进行初次PCI时,建议进行全身溶栓治疗。如果能在溶栓后3~24 h内进行PCI,则可以进一步进行PCI,以期获得更大的疗效。然而,对于心肌梗死后再次发生心脏骤停或复苏时间较长者,溶栓是相对禁忌证,因为有严重出血的风险。
溶栓通常使用尿激酶、组织纤溶酶原激活剂(t-PA)或改良t-PA。尿激酶组织亲和力小,可激活纤溶系统。相比之下,t-PA具有较强的组织亲和力,修饰后的t-PA生物半衰期较长。因此,后两种药物可以减少总剂量,因此可以一次性快速输注。然而,当需要额外的PCI(如支架植入)时,溶栓治疗的适应证应仔细判断。
4.2 非药物疗法
非药物治疗或侵入性治疗包括导管治疗和冠状动脉搭桥手术。导管治疗包括球囊血管成形术、支架植入和旋转支架。对于急性心肌梗死,建议由熟练的冠状动脉介入医师进行冠状动脉介入治疗(Ⅰ类推荐,C级证据)。选择性PCI的指征是心肌缺血的存在。经皮冠状动脉腔内旋转消融(PTCRA)是一种适用于有钙化(Ⅱa类推荐,C级证据)的局限性狭窄的手术。儿童参考血管和股动脉直径较小,这是引导导管尺寸和设备选择的限制因素。严重冠状动脉钙化是KD引起的CAL的特点,应慎重考虑处理。在动脉粥样硬化引起的缺血性心脏病中,PCI对于冠状动脉重建术和冠状动脉搭桥术都是必不可少的。然而,KD引起的CAL患者冠状动脉重建术年龄从儿童到成人不等。在这一人群中,目标是长期维持生活质量。据推测,该人群冠状动脉重建率低于1%[28-29]。儿童参考血管和股动脉的直径很小,引导导管球囊或毛刺较大时,适合使用的引导导管尺寸受参考血管及股动脉直径的限制[30]。KD合并复杂的GCAA和严重钙化患者,其形态随病变的不同而不同。因此,PCI在这一人群中的作用尚未确定,证据水平也很低。
5 KD心血管后遗症的远期管理及随访
KD患者长期预后的具体情况仍不清楚。至于并发哪种类型的CAL患者会在中长期造成临床问题,目前还很少有报道。尽管证据不足,但对于有KD病史的患者,管理其日常生活和学校生活的标准是是否存在CAL,以及CAL的严重程度分级。建议根据KD患儿 CAL 的临床风险分级进行管理及随访(表3)。
6 结语
综上,本文对《川崎病心血管后遗症的诊断和管理指南(JCS/JSCS 2020)》中关于儿童 KD的病情评估及心血管后遗症的诊断、治疗、远期管理等内容进行了解读,希望对国内同行诊治KD心血管后遗症有所帮助。然而,许多 KD心血管后遗症的诊治方案在儿童仍缺乏客观的可取证据,因此,我们期待有更新的指南提出更高证据级别的推荐意见,也希望国内同行们携手共进,为更优质的儿童KD心血管后遗症诊断和治疗指南做出努力和贡献。
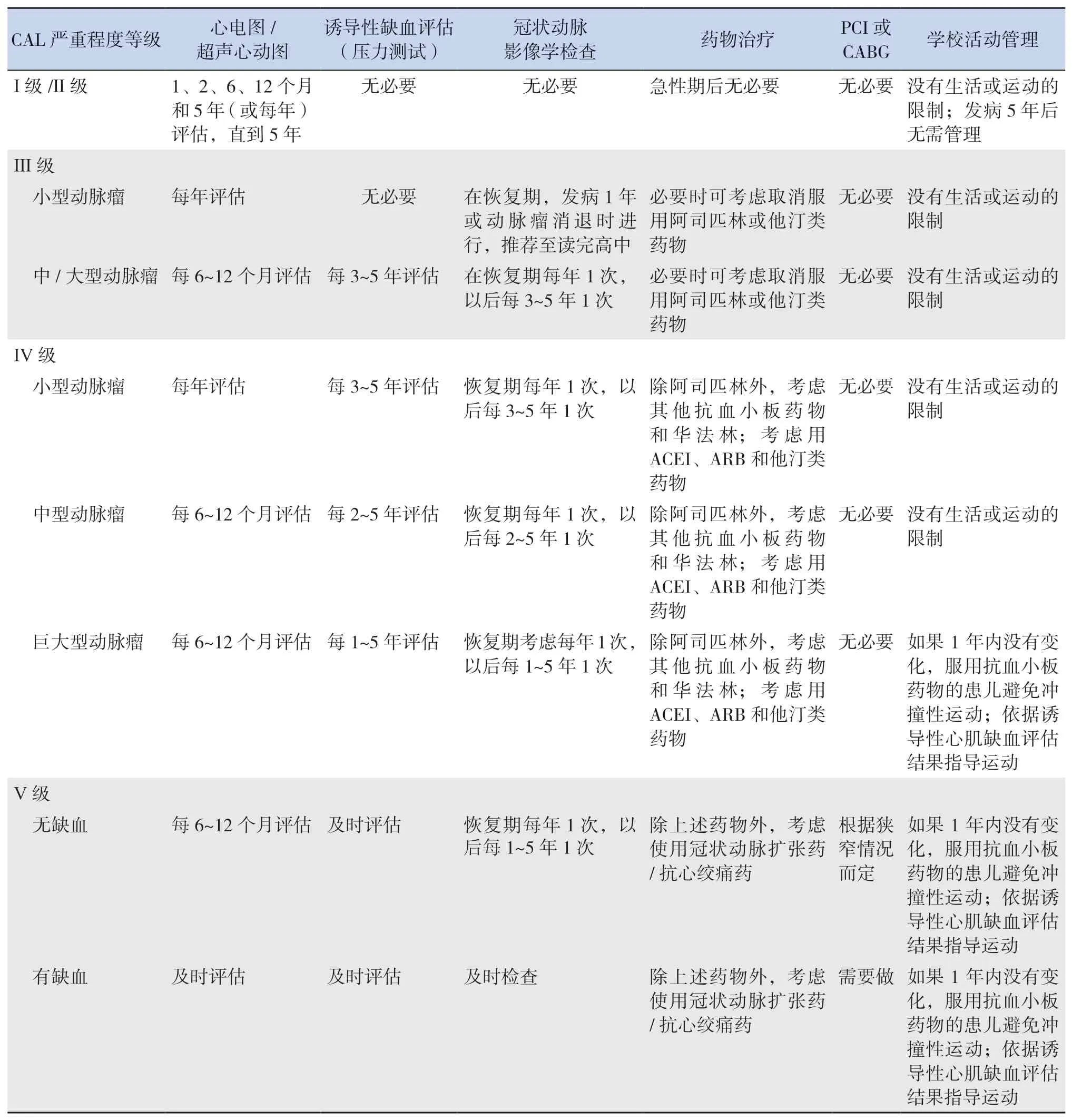
表3 川崎病的远期治疗管理及随访建议[4]#
利益冲突声明:所有作者均声明不存在利益冲突。

