苦瓜多糖对环磷酰胺诱导的免疫抑制小鼠免疫功能的影响*
周惠萍,周东海,彭宇轩**
(1.湖北科技学院基础医学院,湖北 咸宁 437100;2.华中农业大学动物科学技术学院)
苦瓜(momordica charantia L)是葫芦科植物,其苦寒、无毒、除邪热、解疲乏、清心明目、益气壮阳[1],具有多种药理特性,如抗高血糖、抗氧化、抗病毒、抗肿瘤等作用[2],主要成分为多糖、蛋白质、类黄酮、三萜等[3]。多糖广泛存在于植物中,在临床上常用作治疗剂,主要作用是增强和激活巨噬细胞的免疫反应、抗肿瘤活性、促伤口愈合和其他治疗作用[4]。本研究探讨了苦瓜多糖(momordica charantia polysaccharide,MCP)对环磷酰胺(cyclophosphamide,CY)诱导免疫抑制小鼠免疫功能的影响,及可能的作用机制,为更好地开发苦瓜的药理作用提供试验依据。
1 材料与方法
1.1 实验动物与试剂
1.1.1 动物
SPF 级KM雄性小鼠,体重(30±2)g,购自华中农业大学实验动物中心,动物自由摄食和饮水,在室温(24±1)℃、湿度(65±5)%、昼夜12h交替标准环境条件下,适应性饲养1周后用于实验。
1.1.2 试剂
苦瓜多糖(含量为90%,西安万方生物技术有限公司,批号2018092801);环磷酰胺(江苏恒瑞药业有限公司,批号15073125);印度油墨(北京来宝科技有限公司);豚鼠血清(江莱生物);ConA(康朗生物);无菌Hanks和RPMI 1640培养基(Gibico公司);CCK-8(Bioss公司)。
1.1.3 仪器
酶标仪(美国赛默飞公司,型号MK3);全自动血液分析仪(日本希森美康公司,型号F2340);CO2细胞培养箱(美国赛默飞公司,型号3423);电子天平(北京赛多利斯公司,型号BSA124S-CW);超洁净工作台(苏净安泰公司,型号SW-SJ-2FD)。
1.2 实验方法
1.2.1 小鼠分组及处理
参考文献方法[5-6]造小鼠免疫功能低下模型,将50只小鼠按随机数字表法分为5组,每组10只,即正常对照组(C)、CY模型对照组(M)、低剂量治疗组(T1)、中剂量治疗组(T2)和高剂量治疗组(T3)。第1d至3d,除正常对照组腹腔注射生理盐水外,其他各组于小鼠腹腔注射CY 80mg/kg。在第4d至10d,正常对照组和模型对照组灌胃双蒸水,对低、中和高剂量组小鼠分别灌胃MCP 1次,剂量分别是50mg/kg、100mg/kg和200mg/kg。在最后一次喂药24h后进行采样检测。
1.2.2 小鼠WBC计数的测定
全自动血液细胞分析仪检测各组抗凝血白细胞水平。
1.2.3 小鼠免疫器官指数的测定
实验第10d,称量小鼠的体重后,使用颈椎脱臼法处死小鼠,分别对小鼠的胸腺和脾脏精准称重,计算胸腺指数和脾脏指数,公式如下:
胸腺指数=胸腺重量(mg)/体重(g)
脾脏指数=脾脏重量(mg)/体重(g)
1.2.4 小鼠脾淋巴细胞增殖的测定[7]
无菌取小鼠脾脏,放入无菌Hanks液中,用200目筛网过滤成单细胞悬液。通过1 000rpm离心5min进一步纯化细胞悬液,弃上清液。将沉淀的细胞与无菌蒸馏水1mL混合约30s,之后加入1mL 1.8%NaCl。接着用无菌PBS洗涤细胞悬液3遍,调整脾细胞悬液最终浓度至1×10-6个/mL。将脾细胞悬液分两孔加入96孔培养板中,每孔100μL,再加入7.5μL ConA,置37℃,5%CO2培养箱中静止培养24h。每孔加入10μL CCK-8后,置37℃,5%CO2培养箱孵育4h,在酶标仪450nm的波长下测定吸光度(A)值,计算小鼠脾淋巴细胞增殖比例,公式如下:
淋巴细胞增值比例(%)=A(实验组)/A(对照组)×100%
1.2.5 小鼠巨噬细胞吞噬作用的测定[8]
在最后一次给药后,将印度墨水稀释5倍,然后以10mL/kg的剂量通过尾静脉注射,通过眼眶两次采集血液共20μL,时间分别是注射印度墨水后2min(t1),和注射印度墨水后10min(t2),随后立即将血液与4mL 0.1%(w/v)Na2CO3溶液混合。最后在酶标仪680nm的波长下测量吸光度OD1和OD2值,计算小鼠的碳粒廓清指数(κ)和吞噬指数(α),公式如下:
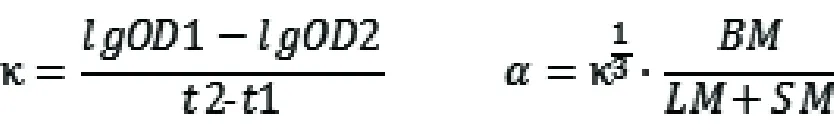
(BM:体重;LM:肝脏重量;SM:脾脏重量)
1.2.6 小鼠血清溶血素的测定[9]
在给药第6d腹腔注射20%兔红细胞悬液0.2mL/只进行免疫。在第10d处死小鼠后制备血清。兔红细胞用生理盐水1 000r/min,5min洗涤3次备用。将0.1mL小鼠血清、0.9mL生理盐水、0.25mL的豚鼠血清和0.25mL 1.5%的兔红细胞悬液加到离心管中,混匀后置于37℃的水浴箱中1h,随后以2 500rpm/min离心5min,吸取上清液,最后在酶标仪450nm的波长下测定吸光度值。
1.3 统计学方法
本实验数据采用SPSS 25.0统计软件进行独立样品t检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 MCP对小鼠WBC计数的影响
由表1可见,CY模型组小鼠的WBC计数较正常对照组明显降低(P<0.01),说明造模成功;MCP中、高剂量组小鼠WBC计数较CY模型对照组均明显增加(P<0.05或P<0.01),说明MCP对免疫抑制小鼠的WBC计数有明显提升作用。
表1 MCP对免疫抑制小鼠WBC计数,脏器指数以及溶血素的影响
2.2 MCP对小鼠脏器指数的影响
由表1可见,CY模型对照组小鼠的胸腺指数和脾脏指数较正常对照组明显降低(P<0.01),说明小鼠免疫功能受到明显抑制;MCP中、高剂量组小鼠胸腺指数和脾脏指数较CY模型对照组明显升高(P<0.05或P<0.01),说明随着MCP治疗剂量的增加,免疫抑制小鼠的脏器指数逐渐增加,但MCP高剂量组的脏器指数仍低于空白对照组。
2.3 MCP对小鼠溶血素水平的影响
由表1可见,CY模型组小鼠的溶血素水平较正常对照组明显降低(P<0.01);MCP高剂量组小鼠的溶血素水平较CY模型对照组明显升高(P<0.05)。说明MCP对免疫抑制小鼠的溶血素水平有一定改善作用。
2.4 MCP对小鼠脾淋巴细胞增殖的影响
由图1可见,CY模型组小鼠的脾淋巴细胞增殖较正常对照组明显降低(P<0.01);MCP中、高剂量组小鼠的脾淋巴细胞增殖较CY模型对照组明显升高(P<0.01),说明MCP可有效促进免疫抑制小鼠脾淋巴细胞的增殖。
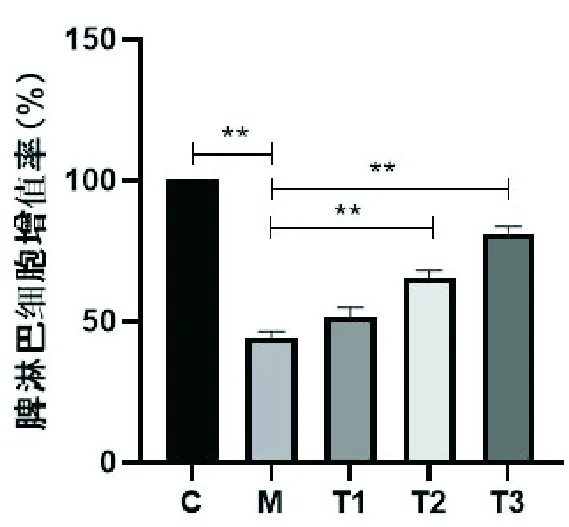
与CY模型对照组比较,**P<0.01
2.5 MCP对小鼠巨噬细胞吞噬作用的影响
由图2可见,CY模型对照组小鼠的廓清指数和吞噬指数较正常对照组皆明显降低(P<0.01),说明CY明显降低了小鼠巨噬细胞的吞噬作用;MCP高剂量组小鼠的廓清指数较CY模型对照组升高(P<0.05),MCP中、高剂量组小鼠的吞噬指数较CY模型对照组升高(P<0.05)。说明MCP对免疫抑制小鼠巨噬细胞的吞噬作用有一定提升。
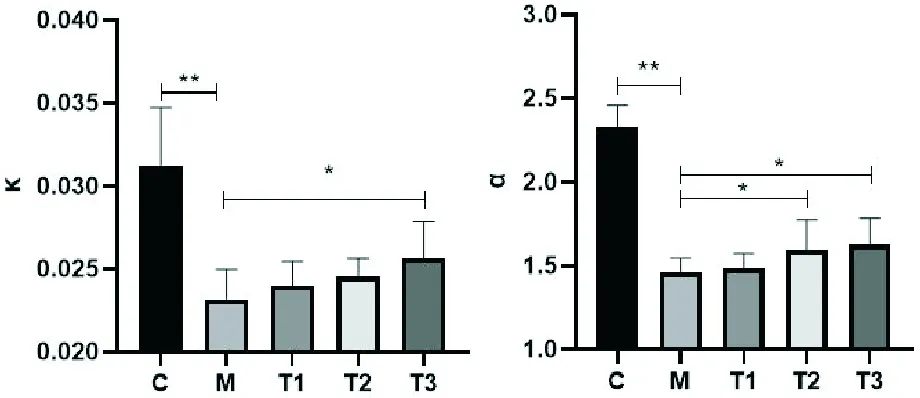
(a)小鼠廓清指数 (b)小鼠吞噬指数
3 讨 论
在科学研究领域,CY常用于构建免疫功能低下或免疫功能抑制的动物模型。本研究以CY 80mg/kg连续3d腹腔注射构建免疫抑制小鼠模型,观察到模型组小鼠体重减轻,脱毛现象明显,与众多文献一致[10-11]。本研究结果表明CY模型对照组小鼠的WBC计数较正常对照组小鼠显著下降(P<0.05)。WBC计数下降常见于病毒感染、自身免疫性疾病、急性白血病、药物性骨髓抑制等,本研究表明致使WBC计数下降的原因是药物性骨髓抑制剂CY的使用,说明本研究免疫功能抑制小鼠模型构建成功。
胸腺和脾脏是机体重要的免疫器官,两者的发育状况与机体免疫功能密切相关,所以通过胸腺指数与脾脏指数的大小能够反映机体免疫功能的强弱[12]。本研究模型对照组小鼠的脏器指数较正常对照组明显降低,差异有统计学意义,表明CY使小鼠胸腺和脾脏重量明显减轻,与蔡帆等[13]研究相一致。MCP低剂量组小鼠脏器指数较模型对照组无统计学意义(P>0.05),而MCP中、高剂量组小鼠脏器指数较模型对照组明显升高,差异有统计学意义(P<0.05),说明在运用MCP治疗过程中,能在一定程度上纠正胸腺和脾脏萎缩,减轻CY对小鼠免疫器官的损害,但与正常小鼠相比仍有一定的差异,没有完全恢复到正常状态。
血清溶血素的变化可从分子水平反映机体体液免疫功能状态。本研究表明MCP低、中剂量组小鼠溶血素水平较模型对照组略微升高,但无统计学意义(P>0.05),MCP高剂量组小鼠溶血素水平较模型对照组升高,有统计学意义(P<0.05),说明随着MCP治疗剂量的增加,小鼠的血清溶血素水平在逐渐提升,有一定量效相关性,故MCP可减轻CY对小鼠体液免疫功能的抑制作用,促使小鼠免疫功能逐渐恢复。
机体免疫功能分为特异性免疫和非特异性免疫,淋巴细胞可反映机体特异性免疫功能的状态,而巨噬细胞的吞噬作用可反映机体非特异免疫功能的强弱。淋巴细胞增殖是特异性免疫激活的关键过程,脾脏中含有大量的淋巴细胞,因此,脾淋巴细胞增殖试验是检验淋巴细胞活力的重要方法[14]。本研究结果表明模型组免疫抑制小鼠的脾淋巴细胞增值率低,在MCP以200mg/kg浓度治疗下,可使小鼠脾淋巴细胞增值率恢复,说明MCP能够有效刺激小鼠脾淋巴细胞的增殖。巨噬细胞作为非特异性免疫重要一员,具有极强吞噬异物的特性。本研究结果显示,高剂量的MCP能明显提高免疫抑制小鼠的廓清指数和吞噬指数,故MCP可有效提高机体巨噬细胞的吞噬能力,增强免疫抑制小鼠的非特异性免疫功能。
综上,可认为MCP是一种免疫促进剂,它既能促进机体的体液免疫功能,又能增强特异性和非特异性免疫,从而有效地发挥免疫调节作用,具有一定的研究价值和开发前景。

