鸡柔嫩艾美耳球虫抗体ELISA 检测方法的建立
田崇瑜,段小超,陈彦华,霍乃蕊,韩克光,古少鹏,郑明学
(1.山西农业大学动物医学学院,山西太谷 030801;2.山西安弘检测技术有限公司,山西太原 030008)
鸡球虫在养殖环境中普遍存在[1]并随时可能形成循环感染[2],严重危害养鸡业。鸡球虫病由艾美尔属球虫寄生在肠上皮细胞引发,尤以寄生在盲肠的柔嫩艾美耳球虫(Eimeria tenella)致病性最强[3]。鸡只摄入环境中的孢子化卵囊而感染,严重时引发鸡只大批死亡,轻症或痊愈鸡生长发育受阻,对其他传染病易感,产蛋率下降、料肉比增加,并且对新城疫、法氏囊、传支等形成免疫抑制[4]。近年鸡球虫病呈现出一些新的变化[2],表现出向小龄化发展、发病率和死亡率高、发病常年化、症状温和、耐药性增强、一般的消毒剂不起作用[5]等新的特征,给养鸡业造成重大经济损失[4]。
鸡球虫特异性抗体检测技术将促进攻虫后的抗体应答机制研究[6]和该病的免疫防控[7]。卵黄抗体防治鸡球虫病效果显著[8],是一种无药物残留、安全可靠、绿色环保的球虫病防治新途径[9],鸡球虫抗体检测技术的建立将有助于口服卵黄抗体制剂的研发[10]。
本研究以柔嫩艾美耳球虫孢子化卵囊接种雏鸡制备阳性血清和可溶性抗原,优化最佳抗原包被浓度、包被条件、最佳血清稀释度、酶标二抗工作浓度等,从而建立柔嫩艾美耳球虫特异性抗体的ELISA 检测技术,为相应试剂盒的研发奠定基础。
1 材料和方法
1.1 材料
供试40 只5 日龄健康雏鸡购自太谷某种鸡厂。柔嫩艾美耳球虫孢子化卵囊、部分阳性血清及纯化的柔嫩艾美耳球虫特异性IgG(13.4 μg/mL),由山西农业大学郑明学教授惠赠。
1.2 试剂与仪器
牛血清白蛋白(Bovine serum albumin,BSA)、显色剂TMB 和Tween-20 为Sigma 产品,标准品鸡IgG 和兔抗鸡IgG-HRP 购自北京博雅宏兴科技发展有限公司。PBST 为磷酸盐缓冲液(PBS,pH 值为7.4)中加入0.5 mL Tween-20 等。
UV-2000 紫外/ 可见分光光度计(Unico,美国)、JY92-2D 超声波细胞粉碎机(宁波新芝生物科技股份有限公司)和SpectraMax M5 多功能酶标仪(Molecular Devices,美国)等。
1.3 方法
1.3.1 柔嫩艾美耳球虫阴性血清和阳性血清的制备 将40 只5 日龄健康雏鸡在无球虫环境中饲养,饮用水为凉白开,制备阴性和阳性血清前连续镜检粪便7 d,要求不能观察到球虫卵囊,采血制备20 份阴性血清。3 周龄无球虫雏鸡用柔嫩艾美耳球虫孢子化卵囊口服免疫,首免剂量为1×104个/羽,10 d 后二免,剂量为5×104个/羽,再隔7 d 三免,剂量为5×104个/羽。第三免7 d 后,强化免疫,剂量为5×104个/羽,7d 后采血,琼脂扩散试验测定抗体效价,达到1∶16 以上时大量采血[11]。大量采血前禁食12 h,将采的血放置于37 ℃1 h,然后置4 ℃30 min,取出后2 500 r/min 离心20 min,血清分装后置于-20 ℃保存备用。
1.3.2 琼脂扩散试验检测血清抗体 用0.01 mol/L PBS(pH 值7.4)制备1.5%的琼脂糖凝胶,厚度为2.5~3.0 mm,凝固后梅花打孔器打孔,挑出孔中琼脂,封底,中间孔加入柔嫩艾美耳球虫可溶性抗原,外周孔1 加入已知阳性血清,新制备的阳性血清32、64、128 倍稀释后依次加入孔2、孔3 和孔4,孔5 和孔6 加入制备的阴性血清。37 ℃湿盒中反应72 h,出现沉淀线为阳性,无沉淀线则为阴性。
1.3.3 柔嫩艾美耳球虫可溶性抗原的制备 柔嫩艾美耳球虫孢子化卵囊经超声破碎后反复冻融处理,10 000 r/min 低温高速离心30 min,收集上清液,用紫外分光光度计分别在260、280 nm 处测OD值,按公式(1)计算可溶性抗原含量(以蛋白质计)。
蛋白质含量(mg/mL)=(1.45×OD280-0.74×OD260)×稀释倍数 (1)
1.3.4 ELISA 操作流程 可溶性抗原包被酶标板并用3%BSA(pH 值7.4)封闭,加样前血清用含1%BSA 的PBST 稀释至不同浓度,同时设阴性和阳性对照孔,37 ℃孵育40 min;稀释兔抗鸡IgG-HRP 并加样37 ℃孵育40 min;加TMB 工作液显色,37 ℃避光反应30 min,用2 mol/LH2SO4终止反应,酶标仪测定各孔OD450。ELISA 过程中每步的加样量为100 μL,每步操作前用PBST 洗板3 次,每次3 min。
1.3.5 酶标板均一性检验 随机抽取8 条酶标板,测定各孔空白OD450值,用稀释1 000 倍的酶标二抗4 ℃过夜包被酶标板,加底物避光显色,终止反应,测定并计算各孔间的标准差和变异系数。
1.3.6 ELISA 反应条件的确定
1.3.6.1 酶标二抗工作浓度的确定 用质量浓度分别为1.25、1.20、1.15、1.00 μg/mL 的标准品鸡IgG 包被反应板,用稀释250、500、1 000 倍的兔抗鸡酶标二抗分别与鸡IgG 孔反应,每个组合做2 个平行,取能够与最大稀释度IgG 反应且OD450平均值为1.0 左右的最大酶标抗体稀释度作为其工作浓度。
1.3.6.2 抗原最佳包被浓度和血清稀释倍数的选择
吸取20 μL 可溶性抗原(858.35 μg/mL)加入第1 孔,加180 μL0.05 mol/L 碳酸盐缓冲液(pH 值9.6)10 倍稀释,以后各孔分别加稀释液100 μL,从第1 孔吸取100μL加入第2 孔,反复吹吸后,吸取100μL加入第3 孔,依次操作,最后从第4 孔取100 μL 弃掉,4 ℃静置12 h。将阳性血清和阴性血清分别进行10、20、40、80、100 倍稀释,进行方阵ELISA,以阳性血清OD 值(P 值)与阴性血清OD 值(N 值)的比值(P/N 值)最大、阳性血清OD450接近1 的抗原最大稀释倍数为抗原最佳稀释浓度和血清最佳稀释倍数。
1.3.6.3 包被液和包被条件的选择 分别以0.01mol/L PBS(pH 值7.4)、0.05 mol/L Na2CO3-NaHCO3(CBS,pH 值9.6)、生理盐水作包被液,抗原质量浓度为21.46 μg/mL,4 ℃包被12 h,阳性血清稀释20 倍,酶标二抗稀释500 倍,进行ELISA,测定OD450,选择最佳包被液。
用0.05 mol/L 的碳酸盐缓冲液(pH 值9.6)稀释可溶性抗原至21.46 μg/mL,每孔加入100 μL 分别在以下条件进行包被:37 ℃/6 h、37 ℃/2 h、4 ℃/16 h、4 ℃/12 h,然后按1.3.4 进行ELISA,以抗原包被孔出现最大P/N 值时的包被条件最佳。
1.3.6.4 封闭时间的确定 每孔加100 μL 3%BSA,37 ℃分别封闭60、90、120、150 min,包被条件为4 ℃/16 h,其余操作同1.3.4,以P/N 值最大时所对应的封闭时间为最佳封闭时间。
1.3.7 阴、阳性临界值的确定 抽取20 份阴性血清在上述确定的ELISA 条件下反应,计算OD450的平均值(x)和标准差(S),若样品的OD450>x+3S,判定为阳性,若OD450<x+2S,则判定为阴性,中间值为可疑[12]。
1.3.8 标准曲线的绘制 以制备的可溶性抗原包被反应板,将纯化柔嫩艾美耳球虫特异性IgG(13.4 μg/mL)作为一抗并作1~14 倍稀释,按照本研究确定的ELISA 条件反应,以OD450为横坐标、特异性IgG 浓度为纵坐标,绘制标准曲线,并建立回归方程。
1.4 数据分析
数据采用Excel 软件处理并作图。ELISA 反应结果OD450值以平均值±标准差表示,以P 值和N值的平均值计算P/N 值。
2 结果与分析
2.1 可溶性抗原含量的测定
所制备的可溶性抗原的OD280和OD260平均值分别为0.488 5 和0.308 5,按公式(1)计算,可溶性抗原中的蛋白含量为858.35 μg/mL。
2.2 阴性和阳性血清的检测
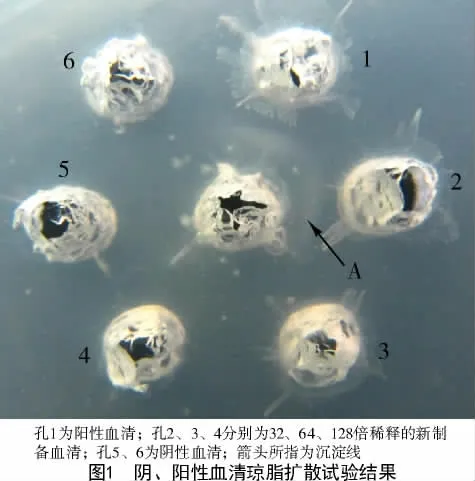
由图1 可知,阳性血清对照(孔1)和新制备的阳性血清(孔2)与柔嫩艾美耳球虫可溶性抗原孔之间均出现了明显的白色沉淀线,而阴性血清(孔5和孔6)则没有,说明所制备的高免阳性血清和阴性血清均可用于后续ELISA 方法的建立。
2.3 酶标板均一性测定
经测定,酶标板的变异系数为1.52%,小于10%,表明该可拆开式聚苯乙烯酶标板符合ELISA 实验的要求,可保证检测结果的有效性和稳定性。
2.4 酶标二抗工作浓度的测定
从表1 可以看出,当酶标抗体稀释500 倍时,与不同浓度的鸡IgG 反应,OD450均接近1,故选用此稀释倍数。
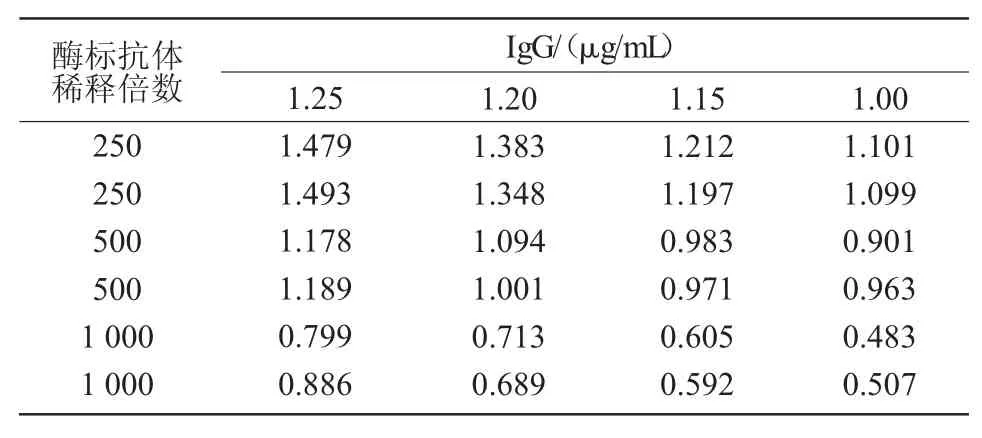
表1 不同稀释倍数兔抗鸡IgG-HRP 与鸡IgG反应的ELISA 结果(OD450)
2.5 抗原包被浓度及血清稀释倍数的确定
方阵ELISA 结果表明(表2),抗原包被质量浓度为21.46 μg/mL,血清稀释倍数为20 时,P 值接近1,且P/N 值也较高,故选择稀释20 倍作为ELISA反应的血清稀释倍数。
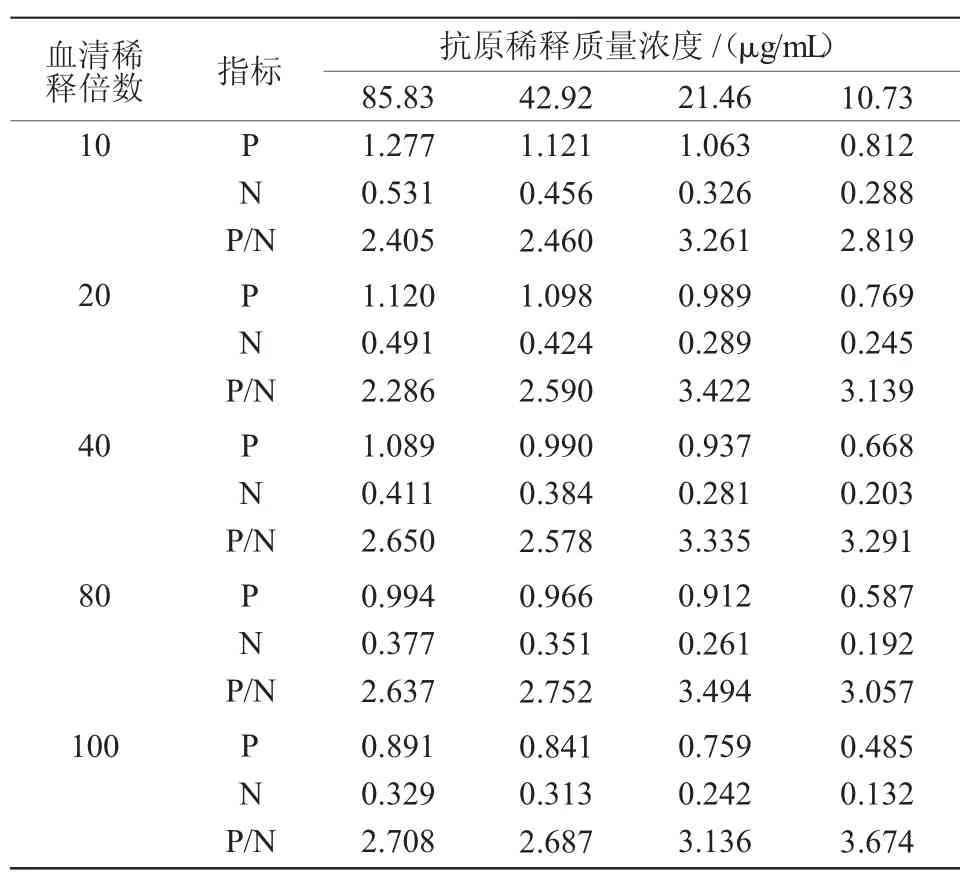
表2 不同抗原包被浓度与不同稀释倍数血清的方阵ELISA 结果(OD450)
2.6 包被液和包被条件的选择
从表3 可以看出,用PBS 和生理盐水作为包被液,OD 值仅为碳酸盐缓冲液的1/3,而空白对照孔OD 值基本一致。因此,选择0.05 mol/L 碳酸盐缓冲液(pH 值9.6)为包被液。

表3 不同包被液的ELISA 结果(OD450)
以0.05 mol/L 碳酸盐缓冲液(pH 值9.6)作包被液,由表4 可知,在不同的温度和时间下,N 值变化不大,4 ℃包被16 h 时,P 值接近1,且P/N 值最大,所以,选择的最佳包被条件为4 ℃放置16 h。

表4 抗原最适包被温度和时间的确定(OD450)
2.7 封闭时间的确定
由表5 可知,P 值接近1,且P/N 值最大时所对应的封闭时间为120 min。

表5 封闭不同时间的ELISA 检测结果(OD450)
2.8 阴、阳性临界值的确定
经测定和计算,20 份阴性血清样品的OD450平均值()为0.108,标准差(S)为0.006 5,如果OD450>0.127 5(+3S),结果判为阳性;如果OD450<0.121(+3S),结果判为阴性,中间值为可疑。
2.9 标准曲线的绘制

以柔嫩艾美耳球虫特异性IgG 建立的标准曲线(图2)可知,在0.007~13.4 μg/mL 范围内,柔嫩艾美耳球虫特异性IgG 含量(y)与OD450(x)的关系为:y=5.151 8x2-4.763 4x+1.004 4,相关系数为0.992 1。
3 结论与讨论
柔嫩艾美耳球虫是鸡球虫病中最常见的一种,其突出特点是致病性强而免疫原性弱[13],所以,一旦鸡群对柔嫩艾美耳球虫产生了保护力,就可判定对其他虫株也产生了保护作用,这也是本研究以柔嫩艾美耳球虫为研究对象,建立其特异性IgG ELISA 检测方法的原因,一方面可为球虫疫苗免疫效力评价提供有效监测手段,另一方面也有利于研究球虫的体液免疫应答机制。IgG 在球虫免疫中发挥着重要作用[13],检测球虫抗体的方法有琼脂糖扩散法和Dot-ELISA[14],但这2 种方法不能对IgG 精确定量。ELISA 检测方法是一种具有高灵敏度的定量分析技术。学者们分别以原核表达的鸡柔嫩艾美耳球虫重组蛋白例如微线体蛋白4[12]、λMzp5-7 蛋白[11]等作为包被抗原建立ELISA 检测方法,虽然包被抗原易制,但在实际检测中需要去除待检血清中的大肠杆菌抗体,否则易出现假阳性结果。还有人用减毒虫株[15]的可溶性卵囊抗原以及直接以弱毒四价活疫苗[6]等作为包被抗原建立ELISA 检测方法,每种建立的方法包被抗原浓度、包被缓冲液、封闭液及封闭时间、血清稀释度和酶标抗体的工作浓度等参数都有所不同,所使用的酶标二抗也不尽一样。
本试验研究结果采用阴性血清OD450平均值加3 倍标准差(0.127 5)作为阳性血清的临界值,阴性临界值为OD450平均值加2 倍标准差(0.121),置信度为99%,即高于0.127 5 和低于0.121 为阳性血清和阴性血清的可能性为99%[16-18]。
本研究建立了鸡柔嫩艾美耳球虫抗体的ELISA 检测方法,以0.05 mol/L 的碳酸盐缓冲液(pH 值9.6)稀释可溶性抗原至21.46 μg/mL,4 ℃包被16 h;3%牛血清白蛋白37 ℃封闭2 h;待检血清和兔抗鸡IgG-HRP 的最佳稀释倍数分别为20 倍和500 倍,阴性和阳性结果判定的临界OD450值分别为0.127 5 和0.121。该方法的建立有助于相应检测试剂盒的研发并可促进鸡球虫病的有效防控。

