Meta分析帕金森病患者与肠道乳酸杆菌量的关系
荣婷1,滕文慧,高杏娜1,丁鸿斐1,姜英1,王乃东
(1. 青岛大学医学部,山东 青岛 266071;2.青岛大学附属医院,山东 青岛 266071)
帕金森病(Parkinson’s disease,PD)常见于中老年人[1],我国年龄>65岁的老年人中,患病率为1.7%[2]。PD以运动迟缓、肌强直、静止性震颤以及姿势步态异常为特点,常伴有一些非运动症状,如:嗅觉减退、便秘、焦虑、抑郁、快速动眼睡眠障碍、白天过度嗜睡等。这些症状与黑质致密部中多巴胺能神经的进行性缺失以及主要由α突触核蛋白形成的路易体(Lewy Body,LB)增加密切相关,也与肠道菌群有着密不可分的关系。在人体中,细菌数目与有核细胞总数数目之比为10∶1,微生物群的基因是人类基因组的100倍[3]。绝大多数细菌位于结肠中,约1014种。有文献[4]证实:粪便中含19个细菌群/属,包括:①占优势的6种厌氧物种(拟球梭菌、柔嫩梭菌、脆弱拟杆菌、双歧杆菌、奇异菌和普雷沃菌);②5种潜在的病原体(产气荚膜梭菌、肠杆菌、肠球菌、葡萄球菌和假单胞菌);③8种乳酸杆菌(格氏乳杆菌、短乳杆菌、干酪乳杆菌、发酵乳杆菌、植物乳杆菌、罗伊氏乳杆菌、鲁氏乳杆菌和清酒乳杆菌)。近年,发现这些细菌具有改变宿主代谢、免疫等多种功能,与PD等疾病的发生密切相关。在本研究中,我们采用Meta分析的方法,探讨帕金森病与肠道乳酸杆菌量的改变关系。
1 资料和方法
1.1 检索策略 我们从PubMed、Embase、Cochrane、Clinicalkey数据库中搜索了从开始建库到2019年4月的文章;知网、万方数据库从建库到2020年7月的文章;纳入研究中所引用的参考文献,手工检索相关会议、论文、报告。最终检索于2020年7月完成。检索词有Parkinson’s disease、PD、lactobacilli、intestinal flora、帕金森、肠道菌群等。
1.2 文献纳入、排除标准 纳入标准:①病例对照研究;②全文文献;③研究对象:人;④研究内容:人体肠道内的乳酸杆菌;⑤PD组和对照组一般资料差异无统计学意义,有可比性;⑥当多个出版物报告从相同群体获得的数据时,仅选择具有最大样本的研究;⑦有提供足够的数据可以进行Meta分析。排除标准:①动物实验;②非病例对照研究;③自身对照试验;④数据不完整或报道信息太少且联系不上作者以至于无法使用的文献;⑤通过各种方法均未获得原文;⑥原始研究中的数据,本研究无法使用者;⑦在过去3个月内摄入抗生素药物或摄入益生菌或益生元产品;⑧有急性或慢性胃肠道疾病史;⑨综述;⑩结局指标不明确或为非量化指标如图像等。
1.3 文献筛选和资料提取 见图1,由2名评价员独立阅读文献标题及摘要,选择符合纳入标准的文献并进一步阅读全文,如果意见相左,由第3名研究员与2名研究员共同讨论决定。从每个文献中提取以下信息:第一作者、出版年份、对照组和病例组的数量、研究对象、研究方法、结局指标。如果文章中没有这些信息,则通过电子邮件联系该出版物的作者,并要求提供更详细的信息。
1.4 文献质量评估 纳入文献均使用非随机研究系统评价工具纽卡斯尔-渥太华量表(Newcastal-Ottawa Scale,NOS)[5]进行评价。包括3个类别8个条目,分别是:①选择:含4项条目,即病例确定是否恰当、病例代表性、对照组的选择、对照组的确定;②可比性:含1项条目,即研究设计或统计分析中病例与对照者的可比性;③暴露:含3项条目,即暴露因素的确定、是否采用相同的方法确定病例和对照者的暴露因素、有无应答率。采用NOS分别对研究对象选择、组间可比性、暴露因素和结局进行评价:①研究对象选择,共计4分;②组间可比性,共2分;③暴露因素和结局,共3分;总的评分为9分。按NOS评分标准:>6分为高质量文献;等于6分者为中等质量文献;<6分者为低质量文献[6]。

图1 文献检索流程
1.5 统计学方法 采用Cochrane协作网的Revman 5.3 软件进行Meta分析。对连续性变量采用标准化均数差(SMD)以及95%置信区间(CI)表示效应指标分析结果。绘制森林图,用于描述Meta分析的统计结果,以α=0.05为检验标准。各纳入研究结果间采用I2检验进行异质性检验,根据判断异质性大小,I2<50%表明异质性尚在可接受范围内;I2>50%为不可接受。若纳入研究结果同质性好(P>0.1,I2<50%),采用固定效应模型(fixed effects model)描述进行Meta分析,否则,则采用随机效应模型(random effects model)进行Meta分析。对异质性大的结局指标进一步根据评分表不同而进行亚组分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果及特征 根据纳入标准和质量控制要求,剔除不符合要求的文献(见图1)。最终纳入5篇文献,均为病例对照的全文文献。共641例研究对象,其中病例组371例,对照组270例。纳入文献的一般情况见表1、表2。
2.2 纳入文献的质量评价 纳入文献均使用非随机研究系统评价工具NOS量表进行评价,总分为9分。见表2。
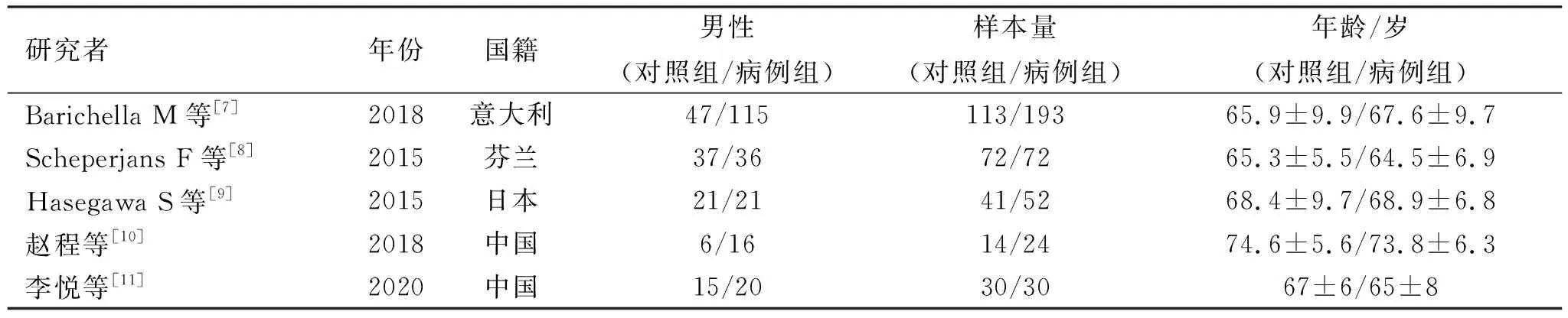
表1 纳入文献的一般情况

表2 纳入文献的一般情况及质量评价
2.3 Meta分析结果 纳入病例组371例,对照组270例,共计5个公开发表的病例对照研究,对其基线资料进行对比,结果表明无差异;所有纳入文献均严格遵守文献质量评估量表,以确保纳入文献的质量,最高分7分,最低分6分,提示纳入文献质量高。对PD患者肠道内乳酸杆菌的定量分析以均数±标准差形式展示出来。因异质性较大(I2=77%),所以采用随机效应模型进行合并分析。结果显示:SMD=0.61,95%CI:0.23~0.99,P=0.001。即PD患者粪便内的乳酸杆菌的量要高于对照组(见图2)。
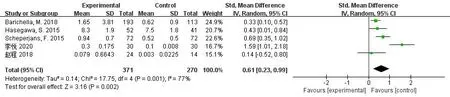
图2 PD患者粪便乳酸杆菌的Meta分析森林图
Meta分析异质性大,可能与原始研究质量的异质性有关,通常可以采用亚组分析处理。考虑到国内外饮食结构对乳酸杆菌的影响[12],我们将5个原始研究分为2组。中国组SMD=0.88,95%CI:-0.55~2.30,国外组SMD=0.46,95%CI:0.24~0.28,I2=30%。两组95%CI之间有重叠,表明很可能不存在交互作用。图3显示,国外组P=0.24>0.05,我们认为同质性较好,且样本量较大,结果准确性较高;国内组P<0.05,横线、菱形与垂直线相交,表明结果可能无统计学差异。 即国外组PD患者粪便内乳酸杆菌量比对照组高,差异有统计学意义;国内组未见差异。
2.4 纳入文献偏倚分析 我们对每一个纳入文献均进行了偏倚评估,结果见图4、图5,结果显示:未见明显偏倚。因纳入文献少于10篇,发表偏倚漏斗图无意义,因此,本研究未做偏倚漏斗图。
3 讨论
PD是仅次于阿尔茨海默病(AD)的第二大神经退行性病变,主要有两大病理特征,一是黑质多巴胺能神经元及其他含色素的神经元大量变性丢失,尤以黑质致密区多巴胺能神经元丢失最为显著,出现临床症状时,至少减少50%以上;二是残留神经元胞浆内出现嗜酸性包涵体,即LB,此系由细胞质蛋白所组成的玻璃样团块,其中央有致密的核心,周围有细丝状晕圈。α突触核蛋白、泛素、热休克蛋白等是其形成的主要成分。在神经变性条件下,神经元中的组蛋白乙酰化水平总体下降。关于PD具体发病机制目前尚不十分清楚。有研究发现[13]:PD发病机制可能与乳酸杆菌有关。许多乳酸杆菌胞内有高浓度的锰元素,这些锰元素可沿着迷走神经入脑,避免了血脑屏障的阻碍作用,最先损害的是蓝斑,从而导致了PD、AD、自闭症等的发生[14]。因此,通过检测肠道乳酸杆菌量的多少,可能可以预测PD的发病情况。

图3 PD患者粪便乳酸杆菌的亚组分析

图4 偏倚风险图

图5 偏倚风险总结图
为了明确PD和肠道乳酸杆菌量的关系,我们对PubMed、Embase、Cochrane、Clinicalkey、中国知网、万方等数据库中公开发表的文献进行了Meta分析。亚组分析结果显示:粪便内乳酸杆菌量的增加,可能与PD发病相关,这与Samsel A等[14]的研究结果一致。近年来,学界提出了“微生物-脑-肠轴”的概念,可能是肠道菌群引起PD的机制之一[3]。最初对“微生物-脑-肠轴”的研究,多见于肠易激综合征、炎症性肠病[15]。“微生物-脑-肠轴”包括中枢神经系统,内分泌免疫系统,下丘脑-垂体-肾上腺轴(HPA),自主神经系统,肠神经系统和肠道微生物群[16]。这是一条双向轴,大脑控制胃肠道的神经、分泌和免疫的同时,也接受来自胃肠道的反馈信息。肠道菌群对神经系统的作用途径,除了“微生物-脑-肠轴”这一通路,也可以经过以下方式:如免疫系统,肥大细胞-微生物群-神经细胞;内分泌系统,神经内分泌-下丘脑-垂体-肾上腺轴[3];以及通过改变溶酶体清除机制、线粒体自噬等程序性死亡的方式引起PD[17]。有学者[3]认为PD是一种炎症性疾病,神经炎症可引起α突触核蛋白的聚集。肠道炎症免疫系统的信号分子、细胞因子、趋化因子等都经过迷走神经或外周器官[18],从肠神经系统分阶段传播至中枢神经系统[19],导致后者发生一系列的炎症反应,最终引起PD[3]。然而,迷走神经在PD发病中的作用还有争论。Liu BJ等[20]的临床试验结果证明:迷走神经切断术与PD患病风险无关。这与Svensson E等[21]的队列研究结果(完全截断迷走神经可以降低PD的发病率)相悖。
早在2011年,Nair AT等[3]就证明了PD患者肠道通透性的改变、氧化应激与α突触核蛋白有关。这些学者倾向于:除了肠道的炎症,应激反应也导致了α突触核蛋白在脑部的聚集。局部的肠道炎症可因氧化应激、线粒体功能障碍、能量产生等原因,使其通透性增加、肠道屏障作用减弱,损伤部位的细菌产物、炎症介质可入血[3]。如:在啮齿动物模型中,使用神经毒素1-甲基-4苯基 -1,2,3,6四氢吡啶 (MPTP),后者可在体内转换为其生物活性形式1-甲基-4-苯基吡啶离子(MPP+),MPP+可在神经胶质细胞内的单胺氧化酶(MAO-B)、多巴胺转运蛋白(DAT)的作用下进入多巴胺神经元,最终,导致其氧化应激的发生、线粒体功能障碍[22]。在一项母体分离的婴儿恒河猴肠道菌群完整性的试验中,也证明了乳酸杆菌与应激反应相关[23]。在最近的研究中发现[24],PD患者肠道内乳酸杆菌量的增加,也可能是体内的一种重要保护防御机制。乳酸杆菌可以下调PD患者的IL-1、IL-8和TNF-α、抑制肥大细胞脱颗粒,也可以调节其它共生微生物、并抑制病原体黏附于肠壁[25],还可以促进Th1细胞的转换[26],从而发挥其抗炎效应。此外,在表达α-Syn Y39C的小鼠实验中,已经证实微生物的产物,如,丁酸钠和苯基丁酸钠等丁酸盐,可减少α-Syn寡聚化、LB形成,从而改善运动和认知功能[27],也可减少纹状体的神经炎症反应和氧化应激反应,并且可以提高纹状体的多巴胺(DA)、脑源性神经营养因子、组蛋白的乙酰化[28],具有保护PD等神经保护性大脑活动。然而,也有人认为:丁酸盐可促进小胶质细胞介导的免疫反应和增加α-突触核蛋白的聚集,进而导致运动异常[29]。
综上所述,PD患者肠道内乳酸杆菌量的改变既可以是保护因素,也可以是患PD的危险因素。我们考虑,这可能和乳酸杆菌的复杂种类有关。在乳酸杆菌属中,每种属的细菌,作用不尽相同。例如:德式乳杆菌,可增加IL-10、IL-4的浓度,在嗜酸乳杆菌中,观察到IL-2、IL-12增加,这二者均可导致炎症反应;香肠乳杆菌可以抑制应激反应、降低下丘脑(HPA)的高反应性而使肠道通透性降低[30],从而起到保护性作用。
总之,PD患者乳酸杆菌的含量增高,提示该菌参与了PD的发生和发展过程。需要区分乳酸杆菌的各个属,才能判断乳酸杆菌量的增加到底是PD的保护因素还是危险因素。本文尚存在一些缺陷。由于纳入的研究数量偏少,因而未能进行漏斗图分析。

