阿帕替尼诱导肝癌细胞凋亡的作用研究
程洁胡韵陆军王章桂
(1. 安徽理工大学医学院,安徽 淮南 232001;2. 安徽省第二人民医院,安徽 合肥 230001)
肝细胞肝癌(hepatocellular carcinoma,HCC)是东亚地区的常见肿瘤,从全世界范围来看其发病率和死亡率居高不下(分别排第四位和第三位)[1]。由于肝癌自身的病因学发展影响因素众多,因此HCC 是目前医学上治疗的难点,也是研究的重点领域[2]。小分子药物索拉非尼、乐伐替尼均获批于晚期肝癌的一线治疗,但是其有效时间短(中位无进展生存时间分别为2.7个月和7.4个月)、价格昂贵、可及性、不良反应等问题阻碍了其临床应用[3-4]。阿帕替尼是一种口服的靶向药物,主要的作用靶点是血管内皮生长因子受体2。根据Ⅲ期研究结果,国家药品监督管理局(National Medical Products Administration,NMPA)批准阿帕替尼用于接受过两种化疗方案后的晚期胃癌患者的治疗,在一项针对进展期胃癌的研究中也已经观察到显著的临床疗效[5-6]。临床研究表明,阿帕替尼二线治疗晚期肝癌表现出一定的临床疗效[7]。本研究试图探讨阿帕替尼体外对人肝癌细胞株HepG2的作用。
1 材料和方法
1.1 材料 主要材料包括:HepG2细胞、DMEM培养基、胎牛血清(FBS)、MTS、Annexin V -FITC细胞凋亡检测试剂盒(上海碧云天C1062M)、Bax(CST,14796S)、Bcl-2(CST,3498S)、Cleaved-Caspase-3(CST,9661s)、VEGFR-2(CST,9698s)、GAPDH(CST,2118S)和HRP标记的羊抗兔IgG抗体(CST,A0208)、ECL发光试剂盒分别来源于中科院上海细胞库、杭州四季青、上海碧云天和Cell Signal Technology等公司;阿帕替尼 (Apatinib)由恒瑞医药公司生产。
1.2 方法
1.2.1 阿帕替尼溶液配制及分组 阿帕替尼分子量为639。将阿帕替尼10 mg溶于1 ml二甲基亚砜(DMSO)中,配制成浓度为20 mmol/L的母液,储存于-80℃冰箱。使用时,用1%的FBS进行梯度稀释至指定浓度(0 μmol/L、1.25 μmol/L、 2.5 μmol/L、5 μmol/L和10 μmol/L) 。分组:0 μmol/L浓度组、1.25 μmol/L浓度组、2.5 μmol/L浓度组、5 μmol/L浓度组、10 μmol/L浓度组、空白对照组(只含有培养基而无细胞)、阴性对照组(加入0.4%的DMSO)。
1.2.2 细胞培养 肝癌细胞HepG2常规培养。将肝癌细胞置于含有10%胎牛血清的高糖DMEM培养基中。然后置于CO2浓度为5%,温度为37℃的培养箱中。
1.2.3 细胞增殖检测[8]同我们前期检测方法类似,采用MTS法。实验步骤概述如下:①选择处于对数生长期的细胞于96孔板中,使得细胞数约为1×104个/毫升;②给予一定浓度的阿帕替尼处理后过夜;③处理指定时间(24 h、48 h和72 h)后,根据实验说明书加入MTS检测试剂;④将分光光度计波长设为490 nm,上机检测OD值,每隔15 min再测1次,反复3次。抑制率(inhibitor rate,IR)=(1-实验组A值/细胞组A值)×100%。数据结果导入GraphPad,制作增殖曲线,计算抑制率和半数抑制浓度(IC50)。
1.2.4 流式细胞仪检测细胞凋亡率 将HepG2细胞接种于6孔板,使得每孔细胞数约为3×105个细胞。培养24 h后,加入10 μmol/L浓度的阿帕替尼培养液培养72 h后,按照说明提前配制试剂,然后采用漂洗、消化、离心等步骤,将细胞收集至15 ml 离心管,分别加入指定试剂后避光保存,流式细胞仪检测。每次实验设3个复孔,重复3次。
1.2.5 免疫印迹分析 将细胞移植至6孔板中,过夜后加入阿帕替尼,浓度为0 μmol/L、1.25 μmol/L、 2.5 μmol/L、5 μmol/L和10 μmol/L。 48 h后按操作说明收集蛋白。蛋白定量采用BCA法;后续步骤按SDS PAGE电泳说明进行电泳、转膜、脱脂奶粉封闭;前述步骤完成后分别将目标抗体Caspase-3(1∶400)、VEGFR(1∶200)、Bcl-2(1∶200)、Bax(1∶200)、GAPDH(1∶1000)加入。过夜后再加入HRP标记的二抗(1∶1000),采用 ECL发光试剂上机显像,保存文件。

2 结果
2.1 阿帕替尼抑制肝癌细胞增殖 MTS实验结果表明HepG2细胞在阿帕替尼处理后的增殖受到明显的抑制。HepG2细胞在多种阿帕替尼浓度(0 μmol/L、1.25 μmol/L、2.5 μmol/L、5 μmol/L和10 μmol/L)下均表现出一定的被抑制作用;阿帕替尼处理72 h后的抑制率分别为:0%、(17.25±0.34)%、(32.42±5.25)%、(52.13±7.31)%、(65.48±9.02)%,同不加阿帕替尼药物的阴性对照组(不含药物,仅给予0.4% DMSO) 相比差异有统计学意义(P<0.05)。半数抑制浓度为(5.36±0.27) μmol/L。这表明阿帕替尼具有抑制肝癌细胞增殖作用,这种抑制作用与浓度和时间呈剂量依赖性,见图1。
2.2 阿帕替尼诱导肝癌细胞凋亡 为了检测阿帕替尼抑制肝癌细胞增殖是否与凋亡相关,分别采用流式细胞仪检测凋亡率,Western blot检测天冬氨酸特异性的半胱氨酸蛋白水解酶-3(Caspase-3)表达情况。实验结果表现为:阿帕替尼在10 μmol/L时,HepG2细胞的凋亡率为(44.37±3.48)%,而对照组为(8.42±0.31)%。Western blot结果表明阿帕替尼作用于HepG2细胞48 h后,Cleaved-Caspase-3表达上调,这些结果表明阿帕替尼诱导肝癌细胞凋亡,见图2。

图1 不同浓度阿帕替尼对HepG2细胞增殖的影响

注:A为FCM检测凋亡率;B为Western blot检测Caspase-3表达。
2.3 阿帕替尼诱导凋亡的作用机制 Western blot结果表明阿帕替尼给药48 h后,HepG2细胞中VEGFR、Bcl-2的表达在高剂量时下降最为明显;相反,Bax的表达在高剂量时最为明显,随着阿帕替尼的药物浓度的升高其表达逐步增加(见图3A);蛋白定量表明在GAPDH表达稳定的情况下,VEGFR-2、Bcl-2表现出逐步的降低,而Bax表现出逐步的升高(见图3B)。
3 讨论
晚期肝癌目前的主要治疗策略是经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)联合索拉非尼或索拉非尼或乐伐替尼单药口服。Atezolizumab是一种以PD-L1为靶点的免疫检查点抑制剂,联合抗血管生成药物贝伐单抗已经被批准用于晚期肝癌的一线治疗[9]。其作用机制可能在于抗血管生成从而改善了肿瘤微环境,使得免疫治疗药物更容易进入肝癌细胞而发挥作用。阿帕替尼主要作用靶点是VEGFR-2胞内段的酪氨酸激酶区域,除了批准用于胃癌治疗外,目前已经获批用于一线治疗后进展的晚期肝癌的二线治疗。临床前研究表明阿帕替尼在包括肝癌在内的多种实体瘤中表现出显著的抗肿瘤活性和可耐受的毒性反应[10-11],但是其具体作用机制还不清楚。传统观点认为靶向药物主要是通过调节细胞生长过程中的信号通路,从而抑制细胞增殖作用。本研究发现阿帕替尼可以显著地抑制肝癌细胞的增殖,这种增殖抑制作用在高剂量时最为明显。这与临床上观察到的现象相一致,也就是患者在接受阿帕替尼治疗后表现为肿块的快速退缩,并且疗效与剂量相关[12]。
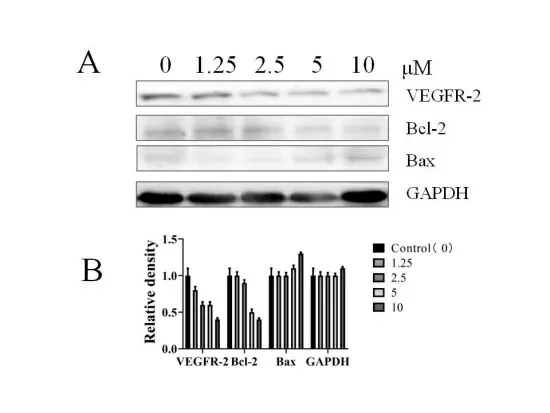
注:A为Western blot检测相关蛋白表达;B为Image J软件浓度分析。
恶性肿瘤的死亡方式包括凋亡、自噬、铁死亡等。诱导凋亡是传统中药、分子靶向治疗药物、micoRNA等作用于肝癌细胞的方式之一[13-14]。细胞凋亡可以分为受体依赖性凋亡和非受体依赖性凋亡,其中Caspase活性是检测细胞凋亡的重要手段,Caspase-3活化后导致线粒体细胞色素C释放。在本研究中观察到阿帕替尼高剂量组凋亡率达到了(44.37±3.48)%,进一步采用免疫印迹也证实了这一结果,免疫印迹表明活化的Caspase-3表达在高剂量组表达最为显著,这些结果表明阿帕替尼诱导凋亡。本课题组一直从事凋亡、自噬、铁死亡研究,虽然阿帕替尼诱导凋亡,但是自噬、铁死亡等死亡方式是否参与了这一过程以及在这一过程中的具体作用还有待进一步观察。
Liao JB等[15]报道在肝癌的基础实验中阿帕替尼通过抑制PI3K/Akt通路而发挥放疗增敏作用。本研究中发现,阿帕替尼可以抑制VEGFR-2的表达,其抑制作用在高剂量时最为显著;与VEGFR-2表达相一致的是凋亡相关蛋白Bcl-2表达降低,在高剂量组最为明显;而Bax的表达随着阿帕替尼浓度的增加而升高;这些结果表明与Cleaved-caspase-3表达相一致;尽管临床前研究表明[16]阿帕替尼主要的作用靶点是VEGFR-2,本研究也证实阿帕替尼抑制VEGFR-2的表达,但是阿帕替尼是否通过抑制下游PI3K/Akt、Mek/Erk等信号通路而抑制Bcl-2和促进Bax表达进而诱导凋亡还并不清楚。在后续研究中,我们需要通过上调或下调VEGFR-2的表达后再观察凋亡相关分子的表达情况。
阿帕替尼是一种新的分子靶向治疗药物,其作用机制目前还不清楚,深入理解其作用机制有助于临床选择优势人群,并为可能的耐药寻找新的治疗策略。总之,本研究表明抗血管生成药物阿帕替尼在体外可以诱导肝癌细胞凋亡,这种作用与剂量浓度有关,其作用机制可能与调节VEGFR-2、Bcl-2、Bax表达有关。进一步的功能分析和联合免疫治疗药物的作用及机制正在研究中。

