miR-144-3p 对卵巢癌细胞增殖、迁移和侵袭的影响及机制
乔素青,李涵,曹妍,邢辉,郭红,奉泽锦
1中国人民解放军联勤保障部队第九八一医院,河北承德067000;
2湖北文理学院附属医院(襄阳市中心医院);3广元市中心医院
卵巢癌是女性生殖系统常见的恶性肿瘤,其病死率居妇科恶性肿瘤第一位[1]。尽管手术、放化疗、分子靶向等治疗方法已使卵巢癌患者的生存得到明显改善,但中国卵巢癌的发病率和病死率仍居高不下。卵巢癌发病早期缺乏明显的症状且缺乏特异性肿瘤标记物,多数患者确诊时已处于中晚期[2]。卵巢癌的复发率、转移率极高,是卵巢癌患者死亡的主要原因。目前,其复发和转移的具体机制尚未阐明[3]。微小RNA(miRNA)是一类小分子非编码单链RNA,在转录后水平抑制靶mRNA 的翻译或降解mRNA,参与调控细胞的增殖、分化、凋亡等生物学行为[4]。研究显示,miR-144-3p 可抑制胰腺癌、胃癌、甲状腺乳头状癌等肿瘤细胞的增殖、迁移和侵袭,参与肿瘤的发生发展[5-7]。卵巢癌组织中miR-144-3p 低表达,与患者病理分期、淋巴结转移、分化程度等临床病理特征密切相关[8]。但目前,miR-144-3p 对卵巢癌细胞生物学行为的影响尚不明确。2018 年12 月—2019 年10 月,我们探讨miR-144-3p对卵巢癌细胞增殖、迁移和侵袭的影响及作用机制,以期为卵巢癌的分子靶向治疗提供新靶点。
1 材料与方法
1.1 材 料 收 集35 例2016 年5 月—2018 年10 月于四川省广元市中心医院手术切除的卵巢癌组织及对应的癌旁组织(距离癌组织>3 cm,且病理检测未发现癌细胞)。卵巢癌患者年龄37~61(53.28 ±6.47)岁,经术后病理诊断确诊。根据国际妇产科联盟(FIGO)2006 年的分期标准,Ⅰ~Ⅱ期19例,Ⅲ~Ⅳ期16 例;病理类型:低级别浆液性癌(LGSC)3 例,高级别浆液性癌(HGSC)16例,黏液性癌10例,子宫内膜样癌6 例。所有患者临床资料完整,术前未进行放、化疗等治疗。本研究经四川省广元市中心医院伦理医学委员会批准同意,患者自愿签署知情同意书。卵巢癌ES-2 细胞购自中国科学院上海细胞所;胎牛血清(FBS)和RPMI 1640 培养基购自Gibco 公司;胰蛋白酶和MTT 购自美国Sigma 公司;TRIzol 试剂、逆转录试剂盒和PCR 试剂盒购自美国Fermentas公司;CyclinD1、MMP2 和MMP9 多克隆抗体购自美国Abcam 公司;p-PI3K、p-Akt 和p-mTOR 多克隆抗体购自美国CST公司;LipofectamineTM2000试剂盒购自美国Invitrogen 公司;miR-144-3p 模拟物(mimics)及阴性对照、GREM1 过表达载体、突变型(MUT)和野生型(WT)GREM1 的3'-非翻译区(3'UTR)荧光素酶报告载体购自上海吉凯基因公司包装合成;双荧光素酶活性检测试剂盒购自美国Promega 公司;BCA蛋白测定试剂盒购自北京索莱宝公司。
1.2 卵巢癌和癌旁组织中miR-144-3p、GREM1 mRNA表达检测 采用qRT-PCR法。在液氮保护下,研磨卵巢癌组织和癌旁组织,采用TRIzol试剂提取组织中总RNA。经核酸仪检测RNA 纯度和浓度之后,参照逆转录试剂盒操作说明,将其逆转录为cDNA。然后以cDNA为模板进行扩增。扩增条件:95 ℃预变性1 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共45 个 循 环。采 用2-ΔΔCt法 计 算miR-144-3p 和GREM1 mRNA的相对表达量。
1.3 ES-2 细胞培养和分组转染 从液氮罐中取出ES-2细胞,快速溶解后,转移至15 mL离心管中。预冷的PBS 清洗后,加入含10%FBS 的RPMI1640 培养基,转至25 cm2培养瓶中,置于37 ℃、5%CO2、97%湿度的培养箱中培养。每2~3 天更换1 次新鲜的培养基,待细胞融合至80%时,0.25%胰蛋白溶液消化,进行传代培养。取对数生长期的ES-2细胞,以2.5×105个/mL 的浓度接种于24 孔板中。细胞融合至60%时,参照LipofectamineTM2000 试剂盒说明书分组转染。miR-144-3p 组转染miR-144-3p 模拟物(mimics);miR-con 组转染模拟阴性对照物;antimiR-144-3p 组转染miR-144-3p 抑制剂;anti-miR-con组转染抑制剂阴性对照;si-GREM1 组转染GREM1的小干扰RNA;si-con 组转染非特异性小干扰RNA;miR-144-3p+pcDNA-GREM1 组共转染miR-144-3p mimics 和GREM1 过表达载体;miR-144-3p+pcDNAcon 组共转染miR-144-3p mimics 和空载体。转染后12 h,更换新鲜培养基,继续培养至48 h,收集细胞,用于后续实验。同时设置对照组(NC组):细胞正常培养。
1.4 ES-2 细胞增殖活性检测 采用MTT 法。取各组转染后的细胞,以2.5×104/mL的浓度接种于96孔板中,每孔200 μL,每组设置3个复孔。分别于培养箱中培养24、48、72 h 后,加入20 μL 浓度为5 g/L 的MTT溶液。培养箱中继续孵育4 h,弃上清液。每孔加入150 μL的二甲基亚砜,充分振荡溶解结晶紫,混匀后于酶标仪490 nm处测定OD值。实验重复3次。
1.5 ES-2 细胞迁移和侵袭能力检测 采用Tran‑swell 实验。用无血清的RPMI1640 培养基重悬各组转染后的细胞,调整细胞浓度为2.5×105个/mL。细胞迁移实验:取100 μL 细胞悬液加至Transwell 上室,500 μL 含10%FBS 的RPMI 1640 培养基加至下室。培养24 h后,吸弃培养液,取出小室。4%多聚甲醛固定25 min、结晶紫染色10 min后,PBS清洗,显微镜观察。随机选取5个视野计数。细胞侵袭实验:在Transwell 上室加入细胞悬液之前,先在上室铺设Matrigel 基质胶(Matrigel 与RPMI1640 培养基以1∶8比例稀释),自然晾干。剩余操作同细胞迁移实验。
1.6 细胞周期蛋白D1(CyclinD1)、基质金属蛋白酶2(MMP-2)和MMP-9蛋白表达检测 采用Western blot‑ting法。加入蛋白裂解液,置于冰上充分裂解30 min,4 ℃、12 000 r/min离心10 min,离心半径3 cm。上清液为提取蛋白,BCA试剂盒检测蛋白含量。取适量蛋白变性后,每孔30 μg蛋白进行聚丙烯酰胺凝胶电泳。电泳后,将分离的蛋白经湿转至PVDF膜,置于5%脱脂牛奶中封闭1 h。分别加入CyclinD1、MMP-2和MMP-9一抗,4 ℃孵育过夜。TBST洗膜3次,每次5 min,然后加入辣根过氧化酶标记的二抗,室温孵育1 h。TBST洗膜3次,每次5 min,加入ELC显影液显影。凝胶成像系统曝光拍照,Image J软件分析蛋白条带灰度值。
1.7 miR-144-3p和GREM1靶向关系验证 采用双荧光素酶报告基因实验验证。TargetScan在线软件预测显示,GREM1的3′UTR存在miR-144-3p的结合位点。PCR扩增含有miR-144-3p结合位点的GREM1 3’UTR,构建GREM1 野生型(GREM1-WT)质粒和突变型(GREM1-MUT)质粒。调整卵巢癌ES-2细胞调整浓度为2.5×105个/mL,每孔2 mL接种于6孔板中。待细胞融合至60%时,分别共转染GREM1-WT 与miR-144-3p mimics 或miR-con、GREM1-MUT 与miR-144-3p mimics或miR-con。转染12 h后,更换培养基。再培养24 h,收集细胞。参照双荧光素酶活性检测试剂盒操作说明书,检测每组的荧光素酶活性。
1.8 统计学方法 采用SPSS22.0 统计软件。计量数据以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-144-3p和GREM1在卵巢癌及其对应癌旁组织中表达比较 卵巢癌及其对应癌旁组织中miR-144-3p 相对表达量分别为1.45 ± 0.13、0.51 ±0.05,GREM1 mRNA相对表达量分别为0.24 ±0.02、0.68 ± 0.06。与癌旁组织相比,卵巢癌组织中miR-144-3p表达降低(t=39.926,P<0.05),GREM1 mRNA表达升高(t=41.158,P<0.05)。
2.2 各组ES-2细胞中miR-144-3p和GREM1蛋白表达比较 各组细胞中miR-144-3p和GREM1蛋白表达见表1。与NC组相比,miR-144-3p组miR-144-3p表达升高,GREM1 蛋白表达降低(P<0.05),si-GREM1 组GREM1蛋白表达降低(P<0.05),而si-con组GREM1蛋白表达差异无统计学意义(P>0.05)。与miR-144-3p组或miR-144-3p+pcDNA-con组相比,miR-144-3p+pcD‑NA-GREM1组GREM1蛋白表达升高(P均<0.05)。
表1 各组ES-2细胞中miR-144-3p和GREM1蛋白表达比较( ± s)
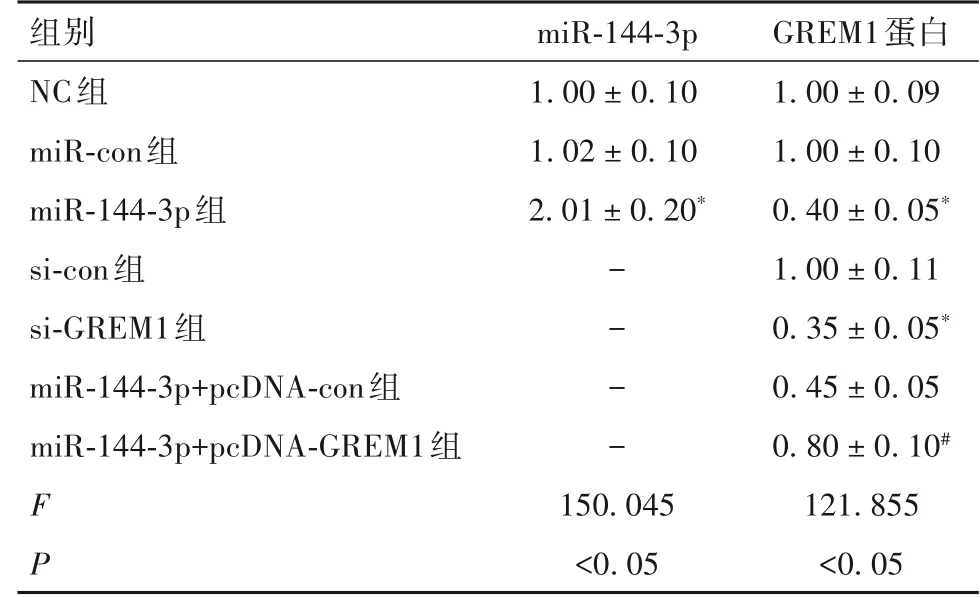
表1 各组ES-2细胞中miR-144-3p和GREM1蛋白表达比较( ± s)
注:与NC 组相比,*P<0.05;与miR-144-3p+pcDNA-con 组相比,#P<0.05。
GREM1蛋白1.00±0.09 1.00±0.10 0.40±0.05*1.00±0.11 0.35±0.05*0.45±0.05 0.80±0.10#121.855<0.05组别NC组miR-con组miR-144-3p组si-con组si-GREM1组miR-144-3p+pcDNA-con组miR-144-3p+pcDNA-GREM1组miR-144-3p 1.00±0.10 1.02±0.10 2.01±0.20*----F P 150.045<0.05
2.3 各组ES-2细胞增殖活性比较 NC组、miR-con组、miR-144-3p 组、si-con 组、si-GREM1 组、miR-144-3p+pcDNA-con 组 和miR-144-3p+pcDNA-GREM1 组ES-2 细 胞 存 活 率 分 别 为(100.12 ± 10.01)%、(101.10 ± 10.11)%、(50.15 ± 5.01)%、(103.11 ±10.30)%、(61.05 ± 6.10)%、(50.78 ± 0.51)%、(90.04 ± 9.01)%。与NC 组相比,miR-144-3p 组和si-GREM1 组ES-2 细胞存活率降低(P 均<0.05),而miR-con 组和si-con 组细胞存活率差异无统计学意义(P 均>0.05)。与miR-144-3p 组或miR-144-3p+pcDNA-con 组 相 比,miR-144-3p+pcDNA-GREM1 组ES-2细胞存活率升高(P<0.05)。
2.4 各组ES-2细胞迁移和侵袭能力比较 各组细胞迁移数和侵袭数见表2。与NC组相比,miR-144-3p组和si-GREM1 组ES-2 细胞迁移和侵袭数降低(P 均<0.05),而miR-con组和si-con组ES-2细胞迁移和侵袭数差异无统计学意义(P均>0.05)。与miR-144-3p组或miR-144-3p+pcDNA-con组相比,miR-144-3p+pcDNAGREM1组ES-2细胞迁移和侵袭数升高(P均<0.05)。
2.5 各组ES-2 细胞中CyclinD1、MMP2 和MMP9 蛋白表达水平比较 与NC 组相比,miR-144-3p 组和si-GREM1 组ES-2 细胞中CyclinD1、MMP2 和MMP9蛋白表达降低(P 均<0.05),而miR-con 组和si-con组细胞中CyclinD1、MMP2和MMP9蛋白表达差异无统计学意义(P 均>0.05)。与miR-144-3p 组或miR-144-3p+pcDNA-con 组 相 比,miR-144-3p+pcDNAGREM1 组ES-2 细胞中CyclinD1、MMP2 和MMP9 蛋白表达升高(P均<0.05)。见表3。
表2 各组ES-2细胞迁移和侵袭数比较(个, ± s)
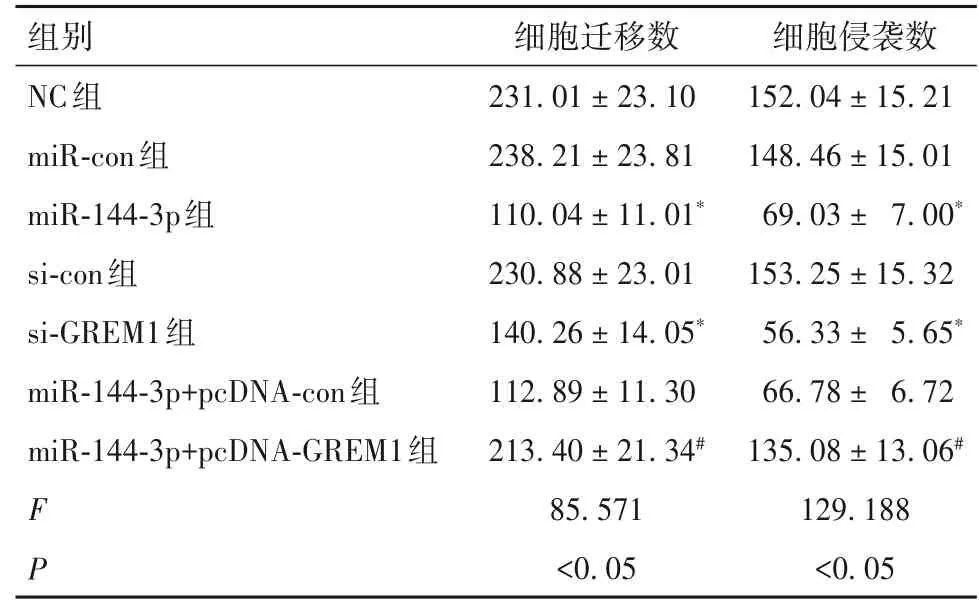
表2 各组ES-2细胞迁移和侵袭数比较(个, ± s)
注:与NC 组相比,*P<0.05;与miR-144-3p+pcDNA-con 组相比,#P<0.05。
细胞侵袭数152.04±15.21 148.46±15.01 69.03± 7.00*153.25±15.32 56.33± 5.65*66.78± 6.72 135.08±13.06#129.188<0.05组别NC组miR-con组miR-144-3p组si-con组si-GREM1组miR-144-3p+pcDNA-con组miR-144-3p+pcDNA-GREM1组F P细胞迁移数231.01±23.10 238.21±23.81 110.04±11.01*230.88±23.01 140.26±14.05*112.89±11.30 213.40±21.34#85.571<0.05
2.6 miR-144-3p 靶 向 调 控GREM1 表 达 Tar‑getScan 在线软件预测显示,GREM1 的3′UTR 存在miR-144-3p 的结合位点。miR-144-3p+GREM1-WT共转染组、miR-con+GREM1-WT 共转染组的荧光素酶活性分别为0.40 ± 0.05、1.00 ± 0.10,两组比较差异有统计学意义(t=16.100,P<0.05);miR-144-3p+GREM1-MUT 共 转染 组、miR-con+GREM1-MUT组的荧光素酶活性分别为1.05 ± 0.10、1.00 ±0.10,两组比较比较差异无统计学意义(t=1.061,P=0.305),miR-144-3p组、miR-con组GREM1蛋白相对表达量分别为0.45 ± 0.05、1.00 ± 0.10,两组比较差异有统计学意义(t=14.758,P<0.05),anti-miR-144-3p 组、anti-miR-con 组GREM1 蛋白相对表达量分别为1.45 ± 0.15、1.10 ± 0.11,两组比较差异有统计学意义(t=5.645,P<0.05)。
3 讨论
miRNA在真核生物体内广泛存在,其通过参与细胞生长、分化、炎症反应等过程对约60%的人类基因进行监管[9]。近年来,随着对miRNA 研究的深入,发现miRNA参与肿瘤的发生发展,其类似于癌基因或抑癌基因的作用[10]。研究表明miR-144-3p在宫颈癌组织中表达下调,过表达miR-144-3p通过靶向MAPK6抑制宫颈癌细胞的生长和转移,可作为宫颈癌的新型治疗靶标[11]。本研究结果显示,miR-144-3p在卵巢癌组织中表达降低,与相关研究报道结果一致[12],提示miR-144-3p 参与卵巢癌的发生发展。miR-144-3p mimics转染卵巢癌ES-2细胞,抑制了ES-2细胞的增殖、迁移和侵袭能力,说明miR-144-3p是卵巢癌治疗的潜在分子靶点,其作用机制有待进一步探讨。
GREM1是一种分泌性蛋白,属于骨形态拮抗剂家族成员,对胚胎发育、生长和细胞分化具有调节作用[13]。研究显示,GREM1过表达可促进胶质瘤细胞的增殖和迁移[14],沉默GREM1表达可抑制结肠癌细胞的增殖和迁移[15]。本研究结果显示,GREM1在卵巢癌组织中高表达,抑制GREM1表达可降低卵巢癌ES-2 细胞的增殖、迁移和侵袭能力,表明GREM1 在卵巢癌中作为促癌基因发挥作用。MIAO 等[16]研究表明,上调miR-137 表达通过负调节GREM1 来阻断TGF-β/smad通路,从而抑制CC细胞的增殖、集落形成、迁移和侵袭。为了进一步探讨miR-144-3p 抑制卵巢癌ES-2 细胞的增殖、迁移和侵袭能力的调控机制,本研究使用TargetScan 在线软件预测显示,GREM1 可能是miR-144-3p 的靶基因。双荧光素酶报告基因证实miR-144-3p 可与GREM1 的3′UTR 靶向结合。上调ES-2 细胞中miR-144-3p 表达后,GREM1蛋白表达降低,而下调ES-2细胞中miR-144-3p 表达后GREM1 蛋白表达升高,说明miR-144-3p靶向负调控GREM1表达。GREM1过表达逆转了高表达miR-144-3p 对ES-2 细胞增殖、迁移和侵袭的抑制作用,提示miR-144-3p 通过靶向下调GREM1 表达抑制ES-2细胞的增殖、迁移和侵袭。
综上所述,miR-144-3p 在卵巢癌组织中呈低表达,高表达miR-144-3p 可抑制卵巢癌细胞的增殖、迁移和侵袭,其可能通过下调GREM1表达进而抑制PI3K/Akt/mTOR信号通路的激活发挥作用。
表3 各组ES-2细胞中CyclinD1、MMP2和MMP9蛋白表达比较( ± s)

表3 各组ES-2细胞中CyclinD1、MMP2和MMP9蛋白表达比较( ± s)
注:与NC组相比,*P<0.05;与miR-144-3p+pcDNA-con组相比,#P<0.05。
组别NC组miR-con组miR-144-3p组si-con组si-GREM1组miR-144-3p+pcDNA-con组miR-144-3p+pcDNA-GREM1组F P MMP9 0.72±0.07 0.75±0.07 0.30±0.05*0.75±0.07 0.36±0.05*0.30±0.05 0.60±0.09#94.188<0.05 CyclinD1 1.00±0.10 1.05±0.10 0.35±0.05*1.05±0.10 0.35±0.05*0.40±0.05 0.88±0.08#166.893<0.05 MMP2 0.80±0.08 0.85±0.08 0.15±0.02*0.82±0.08 0.40±0.05*0.18±0.03 0.65±0.06#206.575<0.01

