血浆miR-127、IL-32 水平对急性肺损伤患者预后的预测价值
张永军,吕会礼,廖玉峰,刘俊宏,谭勇平,文军
郴州市第一人民医院,湖南郴州423000
急性肺损伤(ALI)是由非心源性因素损伤肺毛细血管内皮细胞和肺泡上皮细胞,导致的弥漫性肺间质和肺泡水肿,其起病急、进展快,若不及时给予有效治疗,可发展为急性呼吸窘迫综合症[1]。目前临床主要通过临床体征、症状、结合病史判断,ALI诊断及预后预测尚缺乏特定生物标志物。近年研究表明[2-3],炎症反应在ALI发生发展中发挥重要作用。微小RNA(miRNA)是一类新型的基因调控分子,参与调控细胞多种生物学功能。研究[4]发现,miR-127可通过影响靶基因表达进而调控免疫和炎症反应,参与肺部炎症反应。白细胞介素-32(IL-32)是近年来新发现的一种白细胞介素,能诱导多种炎性细胞因子和巨噬细胞炎性蛋白2 表达,与多种炎症性疾病有密切关系[5]。本研究检测ALI 患者血浆miR-127、IL-32水平,探讨其意义。
1 资料与方法
1.1 临床资料 选取我院2019 年1 月—2020 年6月收治的233 例ALI 患者为观察组,均表现为不同程度通气/血液比例失调、肺容量减少、肺顺应性下降,根据患者死亡或痊愈出院分为两组,死亡组87例,其 中 男58 例,女29 例;年龄46~78(58.93 ±5.57)岁;BMI 19~27(23.16 ± 2.38)kg/m2;病因:胰腺炎5 例,创伤24 例,感染56 例,其他2 例;冠心病史10 例,高血压史27 例,糖尿病史13 例。存活组146 例,其中男92 例,女54 例;年龄44~76(57.25 ±5.26)岁;BMI 19~27(23.51 ± 2.29)kg/m2。病因:胰腺炎10 例,创伤31 例,感染98 例,其他7 例;冠心病史11 例,高血压史35 例,糖尿病史26 例。纳入标准:①经临床体征、症状、结合病史确诊;②符合《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[6]中ALI 诊断标准;③临床资料完整;④患者及家属均知情同意;⑤无精神疾病;排除标准:①支气管哮喘;②肺结核;③自身免疫性疾病者;④恶性肿瘤。另选取58 例体检健康者为对照组,其中男37 例,女21 例;年龄43~76(57.52 ± 9.67)岁;BMI 19~27(23.20± 2.17)kg/m2。三组性别、年龄、BMI、病因、既往史比较差异无统计学意义(P 均>0.05)。本研究经医院伦理委员会批准。
1.2 血浆miR-127、IL-32水平测定 抽取观察组入院当天和对照组体检日空腹静脉血3 mL,EDTA-K2抗凝,3 000 r/min 离心8 min,离心半径8 cm,分离血浆,置于-80 ℃环境中保存,TRIzol 总RNA 抽提试剂(上海碧云天生物技术有限公司,产品编号:R0016,规格:100 mL)提取血浆总RNA,加入反应液,TaKa‑Ra 反转录试剂盒(北京田根生化科技有限公司,产品编号:FP314,规格:50 μL)转录合成cDNA,加入miR-127 正 向 引 物:5′-GCGGCTCGGATCCGTCT‑GAGCT-3',反向引物5'-GTGCAGGGTCCGAGGT-3';RT-PCR 扩增,条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸30 s,循环45 次,各管设置3 个复孔,以U6 做内参校正,正向引物5'-CTC‑GCTTCGGCAGCACA-3',反向引物5'-AACGCTTCAC‑GAATTTGCG-3',反应结束后得到各反应管Ct,2-ΔΔCt法计算血浆miR-127 相对表达量。酶联免疫吸附法测定血浆IL-32 水平,所有操作严格按照试剂盒(上海赫澎生物科技有公司,规格:48T/96T)说明书进行。
1.3 观察指标 收集ALI 患者一般资料,包括性别、年龄、BMI、病因、病史、心率(HR)、呼吸频率、鱼跃YE660A 型血压测量仪测定收缩压(SBP)和舒张压(DBP)、超声心动图(迈瑞DCN2S 型彩色多普勒超声诊断仪)测定平均动脉压(MAP)、西门子EPOC型血气分析仪测定呼气末正压(PEEP)、动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)。
1.4 统计学方法 采用SPSS26.0 统计软件。计量资料以±s表示,组间比较采用t 检验;计数资料比较采用χ2检验;采用多因素Logistic 回归分析ALI 患者死亡危险因素;采用受试者工作特征(ROC)曲线判断血浆miR-127、IL-32 水平对ALI 患者死亡的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组血浆miR-127、IL-32 水平比较 观察组血浆miR-127、IL-32 水平分别为1.42 ±0.93、(95.89 ± 22.54)ng/L,对照组血浆miR-127、IL-32水平分别为0.53±0.36、(52.15±18.72)ng/L,观察组血浆miR-127、IL-32 水平高于对照组(t 分别为7.148、13.648,P均<0.05)。
2.2 存活组和死亡组临床资料对比 死亡组与存活组血浆miR-127 水平分别为2.42 ± 0.71、0.82 ±0.37,IL-32 水平分别为(115.91±19.06)、(83.96±14.62)ng/L,死亡组MAP 低于存活组,PEEP 和血浆miR-127、IL-32 水平高于存活组(P 均<0.05),见表1。
2.3 ALI患者死亡危险因素的多因素Logistics回归分析 以MAP(≥73.20 mmHg=2,<73.20 mmHg=1)、PEEP(≥9.76 cmH2O=2,<9.76 cmH2O=1)、miR-127、IL-32 为自变量,ALI 患者生存状态为因变量(死亡=1,存活=0),多因素Logistic回归分析显示,高水平miR-127 和IL-32 为ALI 患者死亡的独立危险因素(P均<0.05)。见表2。
表1 存活组和死亡组临床资料情况( ± s)
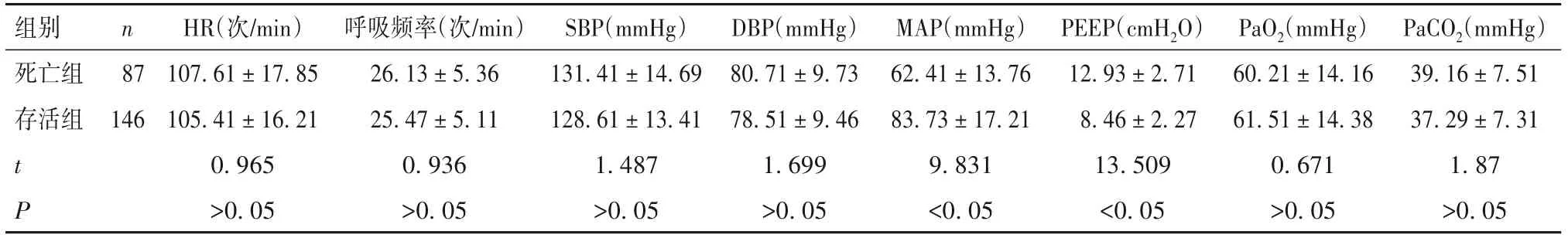
表1 存活组和死亡组临床资料情况( ± s)
组别死亡组存活组n 87 146 t P HR(次/min)107.61±17.85 105.41±16.21 0.965>0.05呼吸频率(次/min)26.13±5.36 25.47±5.11 0.936>0.05 SBP(mmHg)131.41±14.69 128.61±13.41 1.487>0.05 DBP(mmHg)80.71±9.73 78.51±9.46 1.699>0.05 MAP(mmHg)62.41±13.76 83.73±17.21 9.831<0.05 PEEP(cmH2O)12.93±2.71 8.46±2.27 13.509<0.05 PaO2(mmHg)60.21±14.16 61.51±14.38 0.671>0.05 PaCO2(mmHg)39.16±7.51 37.29±7.31 1.87>0.05
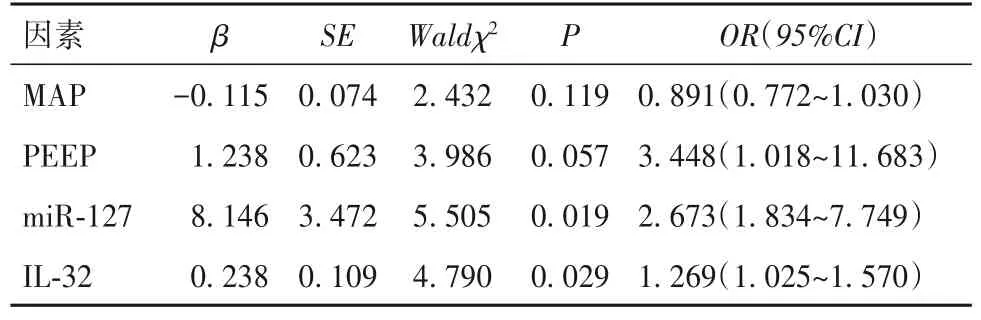
表2 ALI患者死亡危险因素的多因素Logistic回归分析
2.4 血浆miR-127、IL-32 水平对ALI 患者死亡的预测价值 ROC 曲线分析显示,血浆miR-127+IL-32 水平预测ALI 患者死亡的AUC 明显大于miR-127、IL-32 单独预测(Z 分别为3.909、3.743,P 均<0.05),灵敏度、特异度、准确度均高于各指标单独预测。见表3。

表3 血浆miR-127、IL-32水平对ALI患者死亡的预测价值
3 讨论
ALI 是临床常见急危重症,当严重肺损伤得不到及时有效控制时,可加重肺组织水肿,进一步损害肺功能,最终发展为急性呼吸窘迫综合症,总体病死率高达35%~50%[7]。目前临床尚缺乏ALI有效治疗方式,病死率极高,故如何早期预测患者病情严重程度和预后,对改善患者预后有重要意义。目前研究一致认为,肺内难以控制的炎症反应是ALI 发生重要原因,其机制可能是促炎因子诱导中性粒细胞迁移至肺泡腔,释放大量炎症递质代谢产物,并诱导多种炎症细胞聚集和释放,形成正反馈效应,加重肺毛细血管内皮细胞和肺泡上皮细胞损伤,导致ALI 发生,并促进其发展为急性呼吸窘迫综合症[8]。
miRNA 是一组长约22 个核苷酸的非编码RNA,可通过序列特异性碱基互补配对结合其靶miRNA 的3′-UTR,抑制靶miRNA 翻译在转录后水平调控基因表达,参与调节细胞增殖、分化、迁移、凋亡、自噬等多种生物学功能[9]。随着研究的进展,如今miRNA 已被广泛用于肿瘤和心血管疾病的诊断中。miR-127 位于人类基因染色体14q32.2,所属基因簇进化高度保守,具有抑制细胞增殖和促进细胞凋亡的作用[10]。2009 年BHASKARAN 等[11]研究发现,胎儿肺器官培养中过表达miR-127 能明显降低末期芽数,增加内芽和末期芽大小,导致肺部发育不当,故推测miR-127 在肺部发育中发挥重要作用。研究发现,肺损伤期间患者血浆miR-127 表达明显降低,通过体内肺损伤模型实验发现,过表达miR-127 会导致肺通透性降低,增加细胞因子和炎性细胞浸润,提示miR-127 与肺损伤有关[12]。为进一步探讨miR-127 与肺损伤的关系,ESSANDOH 等[13]研究发现,过表达miR-127 能促进M1 巨噬细胞和促炎细胞因子生成,并抑制抗炎因子表达,引起不可控炎症反应,参与肺部损伤。但LI 等[14]通过脂多糖处理巨噬细胞却发现,miR-127 能通过靶向免疫球蛋白G-Fc 片段受体Ⅰ缓解肺部炎症反应。同时CHUNG等[15]研究显示,miR-127 可促进信号传导与转录激活因子3磷酸化,参与细菌感染调控,增强宿主对细菌的清除能力,故认为miR-127 既可促进炎症反应,亦可调控宿主免疫。本研究结果显示,观察组血浆miR-127 水平高于对照组,说明ALI 患者血浆miR-127水平明显提升;死亡组血浆miR-127水平高于存活组,为ALI 患者死亡的独立危险因素,说明miR-127与ALI患者预后密切相关,随着其水平提升,ALI患者预后越差,其机制是过表达miR-127 激活c-Jun氨基末端激酶通路,调节巨噬细胞极化,促进肺部炎症和损伤[16]。同时过表达miR-127 还能激活p38 丝裂原活化蛋白激酶(p38 MAPK)和核因子-κB(NFκB),增加肺通透性和肺中性粒细胞浸润,诱导肺组织病理改变,促进ALI进展[17]。
IL-32 位于人类染色体16p13.3,由8 个编码区组成,具备多种前炎症细胞因子特性,可诱导巨噬细胞分泌肿瘤坏死因子-α(TNF-α),广泛分布于大脑、睾丸、卵巢、前列腺、结肠、小肠、胸腺、脾脏、胰腺等组织器官,由上皮细胞、单核细胞、NK 细胞、T 细胞等内源性细胞分泌,在机体内的作用主要体现在免疫调节和炎症反应两个方面[18]。DAMEN 等[19]研究发现,类风湿性关节炎患者病理组织中IL-32表达明显提升,可增强疾病炎症加剧损伤,与患者病情严重程度密切相关。但在疱疹性口炎病毒、单纯疱疹病毒、人类免疫缺陷病毒、甲型流感病毒等免疫性疾病中,IL-32 具有抗病毒和增强抗炎等作用[20]。RONG等[21]研究显示,慢性阻塞性肺疾病患者肺组织内IL-32 表达明显升高,可诱导并加速疾病发生发展。马莉等[22]研究发现,大鼠ALI后肺组织中IL-32 浓度明显升高,参与ALI的炎症反应。本研究结果显示,观察组血浆IL-32水平高于对照组,说明ALI患者血浆IL-32 水平升高;死亡组血浆IL-32 水平明显高于存活组,为ALI 患者死亡的独立危险因素,说明IL-32与ALI患者预后密切相关,随着其水平升高,IL-32患者预后越差,机制是过表达IL-32能激活含半胱氨酸的天冬氨酸蛋白水解酶-1、p38 MAPK 和NF-κB 依赖途径,诱导TNF-α、巨噬细胞炎症蛋白2、IL-1β、IL-6、IL-8等趋化因子和细胞因子产生,参与ALI炎症反应发展过程[23]。ROC 曲线结果显示,血浆miR-127+IL-32水平预测ALI患者死亡的AUC、灵敏度、特异度、准确度高于各指标单独预测,说明联合检测血浆miR-127、IL-32水平能提升ALI患者预后诊断价值。
综上所述,ALI 患者血浆miR-127、IL-32 水平升高,与预后不良密切相关,联合测定血浆miR-127、IL-32水平能提升对ALI患者预后的预测价值。

