急性脑梗死患者血清UCH-L1、Fibulin-5水平变化及意义
单海雷,焦光美,程曦,马征,高燕军,杨宁,窦志杰
承德医学院附属医院,河北承德067000
急性脑梗死(ACI)是一种严重危害中老年人健康的慢性疾病,在全球有较高的发病率和病死率,多数幸存者可遗留不同程度功能缺失,患者生理和心理负担重[1]。脑缺血缺氧诱发的神经组织损伤是ACI 发病的主要病理基础之一,神经损伤相关指标与ACI 病情严重程度和临床转归均存在密切关系。泛素羧基末端水解酶-1(UCH-L1)是调节脑蛋白质代谢的重要蛋白质,UCH-L1 活性丧失和蛋白病变功能增强与帕金森病、阿尔茨海默病、创伤性脑损伤、缺血性脑卒中、儿童缺氧缺血性脑病、癫痫等神经退行性变有关,是颇具前途的神经源性生物标志物[2-3]。衰老关键蛋白抗原-5(Fibulin-5)是参与细胞黏附的细胞外基质蛋白,在维护血管稳定和血脑屏障功能方面有重要作用[4]。UCH-L1、Fibulin-5 对ACI的临床转归影响尚不清楚,目前相关报道较少。本研究追踪138例ACI患者临床结局,探讨ACI患者血清UCH-L1、Fibulin-5水平变化及意义。
1 资料与方法
1.1 临床资料 选择2017 年2 月-2019 年9 月承德医学院附属医院神经内科收治的138 例ACI 患者(ACI 组),纳入标准:①经颅脑CT 或磁共振成像确诊,符合《中国急性缺血性脑卒中诊治指南2014》中ACI的诊断标准[5];②临床资料完整,无中途转院者;③入院前未接受任何形式的治疗。排除标准:①合并严重感染;②合并恶性肿瘤、免疫系统、血液系统疾病;③肝、肾功能障碍;④合并精神性疾病。ACI组男81 例,女57 例;年龄40~65(53.3±6.5)岁;文化程度:初中或中专35例,高中或大专64例,本科及以上39例;发病至入院时间1~8(5.12±0.36)h;合并糖尿病72 例、合并高血压95 例、合并高脂血症56例、梗死面积:大梗死(直径>3.00 cm 并累及2 个脑解剖部位)31 例,小梗死(直径1.50~3.00 cm)49例,腔隙性梗死(直径<1.50 cm)58例[6];神经缺损程度:轻度损伤[美国国立卫生院神经功能缺损评分(NIHSS)评分≤6 分]61 例、中度损伤组(7 分≤NIHSS评分≤14 分)42 例、重度损伤组(NIHSS 评分≥15 分)35 例[7];认知功能:认知功能正常[简易智能精神状态检查(MMSE)评分[8]和蒙特利尔认知评估(Mo‑CA)量表评分≥26 分[9]]92 例,认知功能异常(MMSE评分<26 分)46 例;51 例给予静脉溶栓治疗,87 例给予抗血小板治疗。另选择同期于我院门诊体检健康的志愿者100例为对照组,均排除心脑血管疾病、恶性肿瘤、免疫性疾病等,男69 例,女31 例;年龄46~69(54.1 ± 5.9)岁,文化程度:初中或中专29 例,高中或大专46例,本科及以上25例;基础疾病:高血压27 例,糖尿病29 例,高脂血症23 例。两组年龄、性别、文化程度比较差异均无统计学意义(P 均>0.05),ACI组合并高血压、糖尿病、高脂血症比例高于对照组(P 均<0.05)。本研究获得我院伦理委员会批准,研究对象或其家属均签署知情同意书。
1.2 血清UCH-L1、Fibulin-5 水平检测 受试者均于入院后24 h 内采集清晨空腹12 h 以上静脉血5~10 mL,注入促凝试管待血液凝固取上层液于离心管(排除乳糜血标本),置于TDZ4-WS 低速自动平衡离心机(长沙湘智离心机仪器有限公司)4 ℃3 000 r/min离心15 min(离心半径10 cm),取血浆保存于-70 ℃低温冰箱(日本三洋电器股份有限公司),48 h内完成待检。双抗体夹心化学发光法检测血清UCH-L1、Fib‑ulin-5 水平,仪器为美国雅培公司生产的AxSYM 化学发光分析仪,试剂盒购自美国R&D 公司。本研究检验项目均由我院检验中心完成,板内、板间变异系数<10.00%,实验室操作均按说明书流程进行。
1.3 临床转归评价 采用改良Rankin量表(mRS)[10]评估患者发病后90 d 临床转归,0 分表明无功能受限和遗留症状;1分为有症状,无明显功能障碍;2分为轻度残疾,但生活能自理;3分为中度残疾;4分为中重度残疾;5 分为重度残疾;6 分为死亡。0~2 分为临床转归良好,3 分及以上为临床转归不良。本组转归良好104例,转归不良34例。
1.4 统计学方法 采用SPSS25.0 统计软件。计量资料以±s表示,比较采用单因素方差分析,组间两两对比采用LSD-t 检验,两组间比较采用独立样本t 检验。计数资料以率(%)表示,比较采用χ2检验。采用Pearson 相关性分析血清UCH-L1、Fibulin-5 与梗死面积、NIHSS、MMSE、mRS 评分的相关性,单因素和多因素Logistic 回归分析UCH-L1、Fibulin-5 与ACI 患者不良临床转归的关系。采用受试者工作特征(ROC)曲线分析UCH-L1、Fibulin-5 预测ACI患者不良临床转归的价值。P<0.05 为差异有统计学意义。
2 结果
2.1 ACI 组与对照组血清UCH-L1、Fibulin-5 水平比较 ACI 组与对照组血清UCH-L1 水平分别为(0.63 ± 0.21)、(0.21 ± 0.06)μg/L,血清Fibulin-5水平分别为(90.07 ± 15.93)、(21.35 ± 6.05)μg/L,两组血清UCH-L1、Fibulin-5水平比较,P均<0.05。
2.2 ACI患者血清UCH-L1、Fibulin-5 水平变化 血清UCH-L1、Fibulin-5 水平随ACI 患者梗死面积增加、神经缺损程度加重而升高(P 均<0.05),认知功能异常者血清UCH-L1 水平高于认知功能正常者(P<0.05),临床转归不良者血清UCH-L1、Fibulin-5水平高于临床转归良好者(P均<0.05),见表2。
表2 ACI患者血清UCH-L1、Fibulin-5水平比较(μg/L, ± s)

表2 ACI患者血清UCH-L1、Fibulin-5水平比较(μg/L, ± s)
注:与腔隙性梗死/轻度损伤相比,aP<0.05;与小梗死/中度损伤相比,bP<0.05;与认知功能正常/转归良好相比,cP<0.05。
临床参数梗死面积腔隙性梗死小梗死大梗死病情程度轻度损伤中度损伤重度损伤认知功能正常异常临床转归良好不良n UCH-L1images/BZ_7_329_2477_352_2517.png ± s F/t 40.984 P Fibulin-5images/BZ_7_329_2477_352_2517.png ± s P<0.01 F/t 52.166<0.01 58 49 31 0.48±0.13 0.63±0.21a 0.91±0.32ab 76.25±12.09 92.34±16.18a 112.35±21.35ab 51.511<0.01 39.695<0.01 61 42 35 0.43±0.11 0.69±0.25a 0.91±0.33ab 77.15±13.14 93.24±16.49a 108.79±22.61ab 9.205<0.01 0.893>0.05 92 46 0.51±0.16 0.87±0.30c 89.24±15.42 91.74±15.67 9.246<0.01 9.606<0.01 104 34 0.52±0.19 0.96±0.37c 82.49±13.95 113.26±23.61c
2.3 血清UCH-L1、Fibulin-5与相关指标的相关性ACI患者血清UCH-L1水平与梗死面积、NIHSS、mRS评分呈正相关(r 分别为0.513、0.416、0.591,P 均<0.05),与MMSE 评分呈负相关(r=-0.506,P<0.05)。ACI患者血清Fibulin-5水平与梗死面积、NIHSS、mRS评分呈正相关(r 分别为0.526、0.492、0.601,P 均<0.05),与MMSE评分无关(r=-0.117,P>0.05)。
2.4 影响ACI不良临床转归的单因素和多因素Lo‑gistic 回归分析 以ACI 患者临床转归为因变量,年龄(连续性变量)、性别(赋值:1=男,2=女)、合并糖尿病(赋值:0=无,1=有)、合并高血压(赋值:0=无,1=有)、合并高脂血症(赋值:0=无,1=有)、梗死面积(赋值:1=腔隙性梗死,2=小梗死,3=大梗死)、NHISS评分(连续性变量)、MMSE 评分(连续性变量)、UCH-L1(连续性变量)、Fibulin-5(连续性变量)为自变量,单因素Logistic 回归分析显示,合并糖尿病、合并高血压、梗死面积、NHISS评分、UCH-L1、Fibulin-5与ACI 患者不良临床转归相关(P 均<0.05),进一步校正年龄、性别混杂因素,多因素Logistic 回归分析显示,梗死面积、NHISS 评分、UCH-L1、Fibulin-5 水平与ACI 不良临床转归的发生独立相关(P 均<0.01),见表3、4。
2.5 UCH-L1、Fibulin-5 水平预测ACI 不良临床转归的ROC 曲线分析 单变量ROC 曲线分析结果显示,UCH-L1、Fibulin-5 水平预测ACI 不良临床转归的 最 佳 截 断 值(cut-off)为0.76 μg/L(灵 敏 度82.35%,特异度85.58%)、101.46 μg/L(灵敏度70.59%,特异度76.92%),预测ACI 不良临床转归的ROC曲线下面积(AUC)为0.860(95%CI:0.781~0.940,P<0.001)、0.741(95%CI:0.639~0.944,P<0.001)。二元Logistic回归分析显示,UCH-L1、Fibu‑lin-5 联合预测ACI 不良临床转归的AUC 为0.947(95%CI:0.924~0.989,P<0.001),灵 敏 度 为97.44%,特异度为99.04%,UCH-L1、Fibulin-5 联合预测ACI 不良临床转归的AUC 均大于UCH-L1、Fib‑ulin-5(Z分别为2.671、3.462,P均<0.05),见图1。
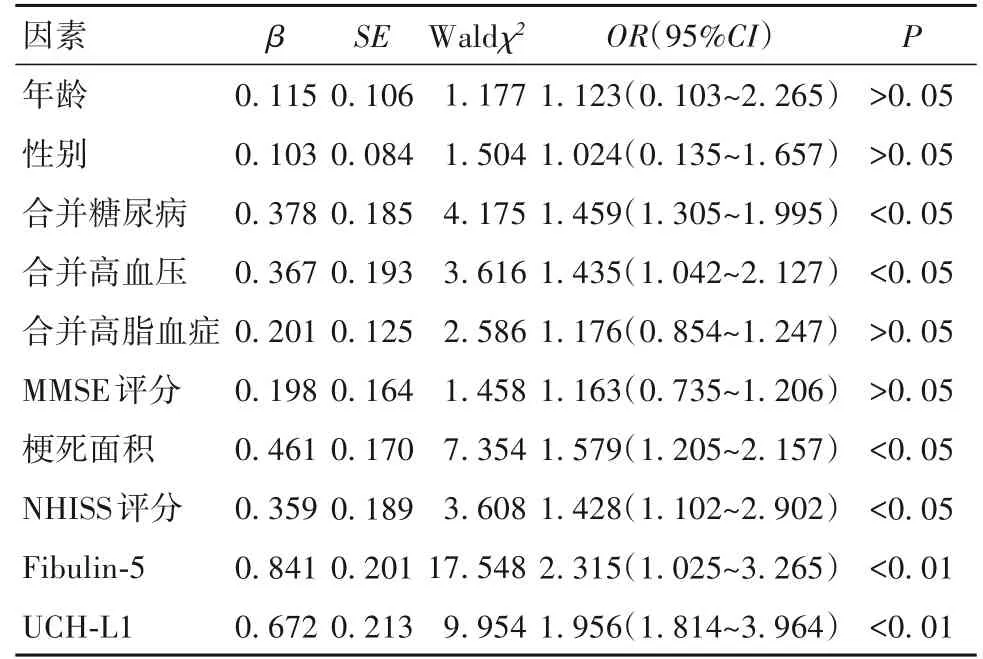
表3 影响ACI不良临床转归的单因素Logistic回归分析

表4 影响ACI不良临床转归的多因素Logistic回归分析
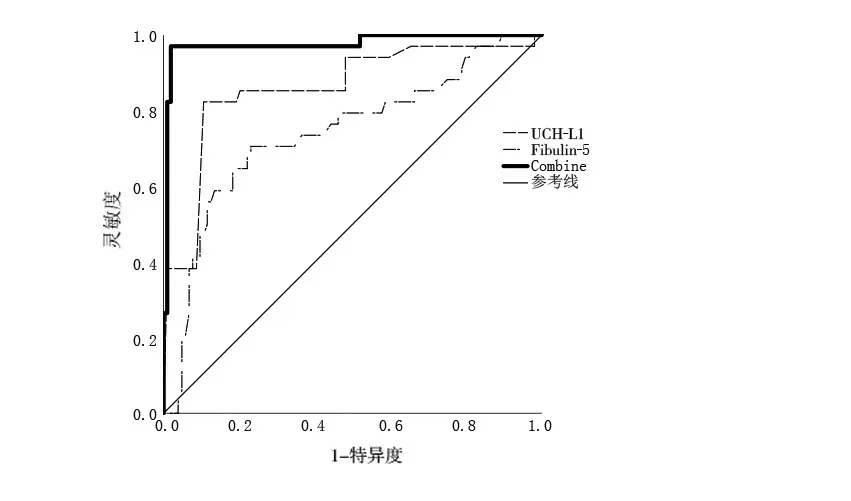
图1 UCH-L1、Fibulin-5、UCH-L1与Fibulin-5联合预测ACI不良临床转归的ROC曲线
3 讨论
ACI 是临床最常见的脑血管疾病类型,病残率、病死率高,幸存者中约75%遗留不同程度残疾或肢体功能障碍[11]。ACI 发病早期开通栓塞血管,挽救缺血半暗带,可显著降低致残率和病死率,但受时间窗限制,病情严重程度不同,临床疗效和预后不尽相同。探讨与ACI临床转归相关的关键生物标志物有助于识别高危人群,更好的指导临床治疗,改善患者预后。ACI发病涉及动脉粥样硬化、炎性反应、细胞外基质重建等多种机制,其中脑缺血缺氧相关神经组织损伤是基础病理机制,因此与神经损伤相关指标可能对ACI临床转归有重要影响。
UCH-L1 是一种特异性神经元蛋白产物,神经系统中UCH-L1 含量丰富,占神经元总蛋白的1%~5%[12]。UCH-L1 具有去泛素化、稳定细胞内泛素单体的作用,参与细胞增殖、分化、凋亡过程,对维持神经轴突完整性有重要意义,在神经退行性疾病、脑损伤、脑出血等多种疾病中有重要作用[13]。刘萍[14]报道显示,ACI 患者血清UCH-L1 水平明显升高,且其水平随着梗死病灶增大和神经功能缺损程度加重而升高,说明脑组织缺血面积越大,神经功能损伤越重,神经系统释放的UCH-L1 越多,UCH-L1 可敏感反映ACI 患者病情程度。本研究除观察到UCH-L1与ACI 脑梗死面积、NHISS 评分存在一定关系外,发现ACI 患者血清UCH-L1 水平在不同认知功能患者中差异有统计学意义,认知功能异常者UCH-L1 水平较高,说明UCH-L1 可反映脑卒中后认知功能损伤程度。UCH-L1 在突触可塑性和学习记忆调节中发挥重要作用,UCH-L1 是海马依赖性记忆调节的潜在靶点,UCH-L1介导TrkB泛素化在突触可塑性和学习记忆调节中发挥重要作用,外周血清UCH-L1水平升高提示神经系统UCH-L1 缺失,TrkB 降解增加,TrkB 及其下游信号通路活性降低,导致认知功能降低[15]。UCH-L1 是否可以预测ACI 患者临床转归尚不清楚,本研究观察临床转归不良者血清UCH-L1水平明显高于转归良好者,UCH-L1 水平与mRS 评分呈正相关,UCH-L1水平升高是ACI不良临床转归的危险因素之一,证实UCH-L1与ACI患者不良转归有关。UCH-L1 在ACI 不良临床转归的发病机制尚不清楚,推测可能原因:脑组织缺血缺氧可导致神经细胞坏死、凋亡,大量UCH-L1 被释放,通过脑脊液循环回收入血或通过受损血脑屏障进入外周血循环,导致外周血液UCH-L1 水平迅速升高。UCH-L1对神经元弥漫性病变敏感,神经元轴突损伤越大,UCH-L1 水平越高,而缺血灶范围、神经缺损程度与不良临床转归均存在密切关系,因此UCH-L1 水平可反映ACI病情进展和不良临床转归。
Fibulin-5 是一种相对分子质量为66 kD 的糖蛋白,由血管平滑肌细胞、成纤维细胞和内皮细胞等多种血管细胞分泌,Fibulin-5通过与整合素结合,促使细胞外基质和内皮细胞黏附,促使紧密连接蛋白表达,起到稳定血管、保护血脑屏障的作用[16]。目前Fibulin-5 在恶性肿瘤中有着广泛研究,但对脑缺血再灌注损伤的影响报道较少。本研究结果显示,ACI 患者血清Fibulin-5 水平明显升高,Fibulin-5 水平与梗死面积、NHISS评分均呈正相关,与文献[17]结果一致。Fibulin-5 参与ACI 的机制尚不十分清楚,可能有以下几点:脑组织缺氧条件下,缺氧因子1α释放,上调Fibulin-5表达,Fibulin-5持续升高可抑制紧密连接蛋白降解,发挥修复血脑屏障,稳定血管内皮细胞,保护缺氧脑细胞作用[18]。Fibulin-5 过表达可通过激活Rac-1 途径降低活性氧表达,降低脑缺血再灌注后细胞凋亡和血脑屏障通透性。Fibulin-5能减轻脑水肿,改善神经功能[16]。研究显示,大鼠大脑中动脉闭塞模型Fibulin-5 表达上调,这可能通过激活PI3K/Akt 通路实现,Fibulin-5 参与大鼠脑缺血再灌注损伤过程[19]。目前相关报道均缺乏Fibulin-5在ACI临床转归的相关报道,本研究发现,不良转归患者血清Fibulin-5 水平升高,Fibulin-5 水平与mRS评分呈正相关,Fibulin-5 水平升高与ACI 不良临床转归的发生独立相关。
本研究ROC曲线分析结果示,UCH-L1、Fibulin-5预测ACI 不良临床转归均有一定价值,但是灵敏度和特异度均不满意,鉴于UCH-L1、Fibulin-5 在ACI发病和病情进展中的作用,UCH-L1、Fibulin-5 联合检测可弥补单独诊断的不足和弊端,为预后判断提供更为丰富的信息和依据。本研究UCH-L1、Fibulin-5联合预测ACI 临床转归AUC 均大于单独诊断,提示UCH-L1、Fibulin-5 联合检测可用于ACI 临床转归的评估,对于UCH-L1、Fibulin-5 均升高患者应警惕严重后遗症的发生。本研究多因素Logistic 回归分析结果显示,除UCH-L1、Fibulin-5 外,梗死面积、NI‑HSS 评分与ACI 患者不良临床转归存在相关性,即梗死面积越大,神经受损程度越重,患者不良转归风险越大,提示对于合并UCH-L1、Fibulin-5 升高的高危患者应警惕遗留残疾和死亡的风险,加强临床干预,改善患者预后。
综上所述,ACI 患者血清UCH-L1、Fibulin-5 水平升高,且随病情加重逐渐升高,UCH-L1、Fibulin-5水平与ACI 患者梗死面积、神经缺损程度和临床转归均有关,UCH-L1水平还与ACI患者认知功能受损有关;联合检测血清UCH-L1、Fibulin-5 有助于ACI患者危险分层和预后评估。

