细胞铁死亡发生机制及其敏感性对肿瘤的影响
罗春英,刘发煇,侯婉云,苏国强
近年来人们对细胞死亡形式、特征的认识和研究逐渐从形态学变化深入到生物化学的分子改变。铁死亡(ferroptosis)是一种新的细胞程序性死亡形式。诱导癌细胞铁死亡也逐渐成为某些肿瘤的治疗策略。本文现对细胞死亡常见类型、铁死亡发生机制及其敏感性影响因素作一简要综述。
1 细胞死亡的类型
细胞死亡根据其发生机制和形态学变化分为多种类型,其中较常见和研究较多的有细胞凋亡、坏死性凋亡、铁死亡、细胞焦亡、线粒体通透性过度性坏死、自噬依赖性细胞死亡。这些细胞死亡类型有其特定的生化、形态特征和发生机制(表1),它们在疾病发展过程中可以独立发生,也可某几种类型同时或先后发生[1-2]。
2 细胞铁死亡特征及其发生机制
铁死亡是铁依赖的、细胞内脂质活性氧堆积引发的细胞膜磷脂过氧化损伤而发生的一种不同于凋亡的细胞死亡形式,于2012年由Dixon等[3]报道并命名。细胞铁死亡过程伴随大量铁离子的累积和脂质过氧化,可以被铁螯合剂、抗氧化剂等抑制,但不能被细胞凋亡抑制剂抑制[4-5],因此铁死亡是铁依赖性、以脂质活性氧异常增多为特征的一种独立细胞死亡类型。铁死亡的发生涉及脂质代谢、活性氧的生成与清除、铁离子代谢异常等。目前研究显示其发生机制主要涉及两条通路:(1)谷胱甘肽(glutataione, GSH)的消耗、谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)的活性降低,即GSH/GPX4通路[1,3];(2)铁死亡抑制蛋白1(ferroptosis suppressor protein1, FSP1)活性降低,CoQ10消耗,即FSP1/CoQ/NADPH通路[3,6-7]。
2.1 GSH/GPX4通路细胞中含磷脂的多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)发生过氧化反应生成磷脂氢过氧化物(phospholipid hydroperoxide, PLOOH),如果PLOOH不被抑制或转化,可引发铁依赖的、自我放大的自由基连锁反应,即Fenton反应,最终导致细胞铁死亡的发生[8]。GPX4具有高效还原磷脂过氧化物和抑制花生四烯酸活化的功能,是哺乳动物细胞中唯一负责PLOOH还原的酶,故GPX4在保护细胞免受氧化损伤方面起到至关重要的作用。GSH是GPX4必需的辅助因子,细胞内GSH的消耗会显著降低GPX4酶的活性,并升高细胞内脂质活性氧水平,从而降低细胞抗氧化能力,脂质活性氧堆积,细胞膜氧化损伤,细胞发生铁死亡。因此抑制GPX4和消耗细胞中GSH的方法被视为潜在的抗癌策略[9]。
2.2 FSP1/CoQ/NADPH通路Bersuker等[6]和Doll等[7]发现除GSH/GPX4通路之外的抑制细胞铁死亡的FSP1/CoQ/NADPH通路。FSP1之前被称为线粒体相关凋亡诱导因子2(apoptosis-inducing factor mitochondria-associated 2, AIFM2)。两个团队均发现FSP1具有NADPH依赖的辅酶Q氧化还原酶的作用,可依赖NAD(P)H催化CoQ10再生。CoQ10的还原形式泛素醇可捕获脂质过氧化自由基,阻止质膜发生过氧化损伤。FSP1保护细胞的作用正是通过催化CoQ10的持续再生,提高自由基捕获能力来抑制铁死亡的发生[10]。故FSP1是一种催化亲脂性自由基诱捕剂产生的氧化还原酶,对GPX4缺失引起的铁死亡具有保护作用。
目前认为FSP1/NAD(P)H/CoQ10通路是一个独立的平衡系统,即使在没有GPX4的情况下,FSP1/CoQ/NADPHGSH.谷胱甘肽;GPX4.谷胱甘肽过氧化物酶4;MLKL.假激酶;CYPD.亲环素D;LC3-Ⅱ.蛋白轻链3;RIPK3.蛋白激酶3;FSP1.铁死亡抑制蛋白1通路也可保护细胞,避免发生铁死亡[9]。进一步深入研究FSP1/NAD(P)H/CoQ10通路将对认识肿瘤细胞铁死亡的发生机制及其影响因素具有重要的科学研究意义。
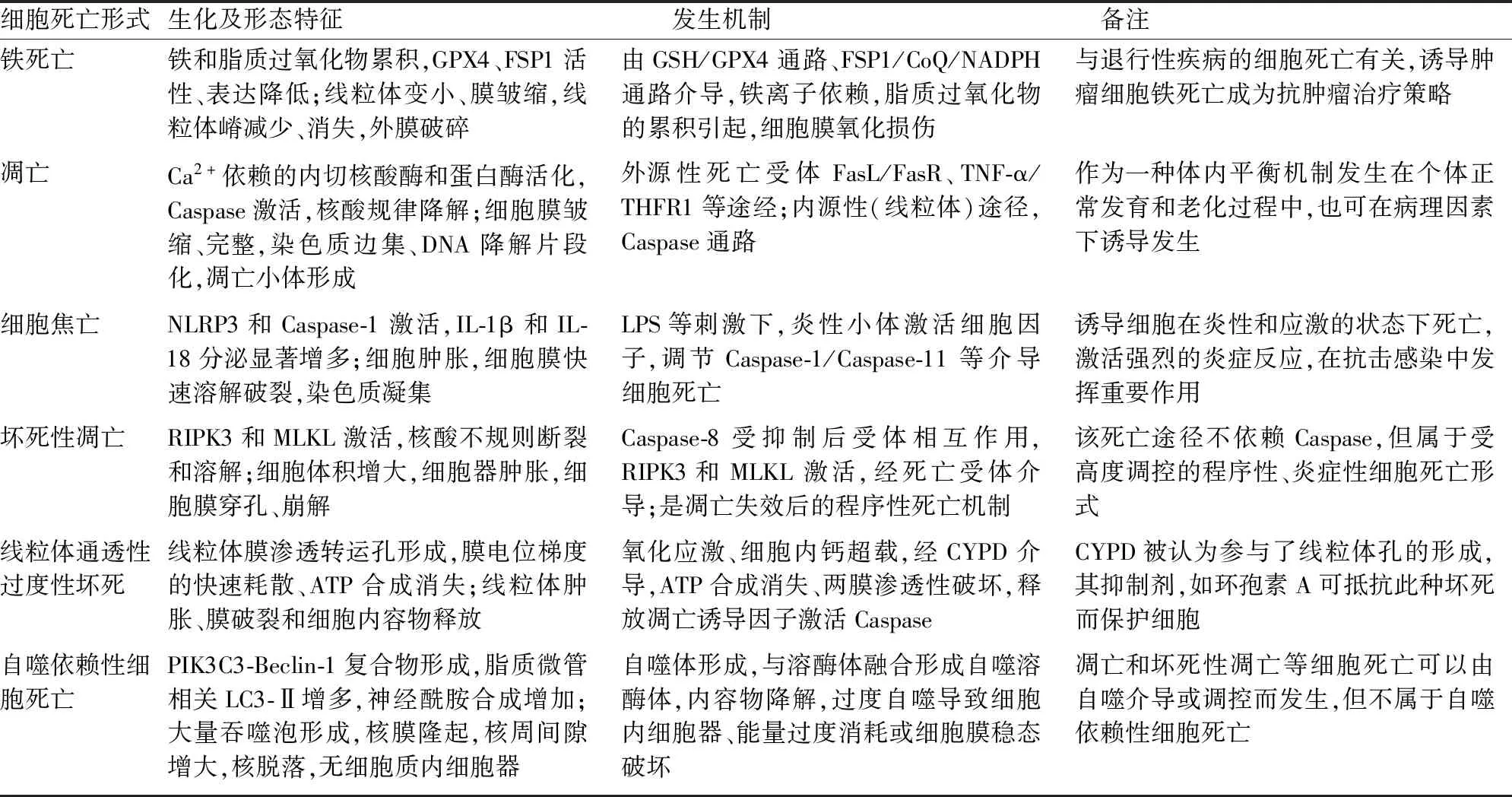
表1 常见细胞死亡形式及特征
3 细胞铁死亡敏感性影响因素
由于肿瘤细胞内活性氧水平比正常细胞高,故诱导肿瘤细胞发生铁死亡成为恶性肿瘤的治疗策略。临床上常用索拉非尼诱导肿瘤细胞铁死亡来治疗晚期肝癌及其他肿瘤患者,然而临床发现某些肿瘤及病例存在索拉非尼耐药问题,表明不同肿瘤类型及肿瘤患者有不同的铁死亡敏感性。目前细胞铁死亡敏感性问题已成为研究的热点。进一步研究影响癌细胞铁死亡敏感性的因素及其过程,将有助于完善诱导癌细胞铁死亡的肿瘤治疗策略。
3.1 胱氨酸-谷氨酸反转运受体(SystemXc-)SystemXc-是细胞膜上由SLC7A11和SLC3A2组成的异二聚体,是胱氨酸和谷氨酸进出细胞的通道。SystemXc-将细胞外的胱氨酸转运至细胞内[11],这些胱氨酸随后被转化为半胱氨酸,成为GSH的合成原料。由于GSH是GPX4酶分解过氧化物反应必需的辅助因子,故SystemXc-通过影响细胞内胱氨酸的代谢,经GSH/GPX4通路而影响细胞铁死亡的敏感性,抑制SystemXc-,尤其是SLC7A11表达,可增强细胞对铁死亡的敏感性[1]。铁死亡诱导剂erastin的作用机制即是通过抑制SystemXc-,阻碍胱氨酸的吸收,降低GSH的含量,导致GPX4活性降低,进而清除有害的过氧化物能力降低,致使脂质过氧化连锁反应持续进行,脂质活性氧堆积,引起细胞膜结构和功能破坏,从而引起细胞发生铁死亡[12]。
3.2 肿瘤抑制基因p53是与肿瘤关系最密切的肿瘤抑制基因。其不仅可以引起细胞凋亡,也能诱导细胞发生铁死亡。p53可通过抑制SLC7A11的转录而抑制SystemXc-吸收胱氨酸[12-13],致使GSH/GPX4通路受抑制,导致细胞抗氧化能力降低,细胞脂质活性氧堆积,细胞易发生铁死亡。Jiang等[14]证实SLC7A11是p53基因新的调控靶点。p53与SLC7A11启动子的特异性结合而抑制其转录,从而抑制SystemXc-吸收胱氨酸。此外,p53缺失可显著上调甲羟戊酸途径基因的表达,并改变脂质代谢[15];p53对铁死亡敏感性的影响是否存在组织特异性值得进一步分析。
3.3 GPX4GPX4能够降解脂质过氧化物,是铁死亡发生GSH/GPX4通路的核心蛋白酶,在细胞膜保护中扮演重要的角色。促进GPX4活性及其表达的因素均会使细胞对铁死亡不敏感,凡是能抑制GPX4活性及其表达的因素则使细胞对铁死亡更敏感。故能影响GPX4活性及其表达的因素均是影响细胞铁死亡敏感性的因素。研究发现RSL3、DPI7和DPI10等GPX4抑制剂能够直接抑制细胞活性,使细胞抗氧化能力下降,脂质活性氧堆积,对铁死亡敏感[16]。
3.4 FSP1Bersuker等[6]和Doll等[7]研究发现FSP1介导了肺癌细胞和小鼠移植瘤对铁死亡的抵抗,其表达水平与数百种癌细胞的铁死亡抵抗呈正相关。这提示抑制FSP1表达可能成为增强癌细胞铁死亡敏感性的一种治疗策略,而提高FSP1活性的方法可能对由铁死亡引起的退行性疾病有治疗意义。因此寻找影响FSP1活性和表达的因素对铁死亡敏感性的研究具有重要的临床和科学意义。
3.5 铁离子其是铁死亡发生的必要条件,细胞内铁离子超额,联合活性氧增多,通过Fenton反应氧化成PLOOH,诱导细胞发生铁死亡[17]。影响细胞内铁含量的因素,如转铁蛋白、血红素加氧酶-1(heme oxygenase-1, HO-1)、转铁蛋白受体等参与了铁死亡的调节过程。此外,CISD2和CISD1是新发现的一类铁硫蛋白,是参与调节线粒体中离子和活性氧的重要应激反应蛋白,在调节细胞内离子和活性氧稳态、保护线粒体膜中具有重要作用[18-19]。铁螯合剂可通过阻断铁向氧化物传递电子、抑制活性氧的生成而抑制铁死亡。
3.6 缺氧诱导因子有研究发现乳腺癌中抑制SystemXc-系统可以同时促进细胞铁死亡的敏感性和HIF-1α的积累[20]。在三阴型乳腺癌中发现抑制SystemXc-已成为最难治疗的三阴型乳腺癌的治疗靶点[21]。以上研究提示缺氧诱导因子可能是影响癌细胞铁死亡敏感性的因素之一。
3.7 肿瘤上皮-间质转化有研究发现,在具有上皮-间质转化相关基因表达的细胞中存在GPX4活性高的特性。使用一线化疗药物治疗黑色素瘤、乳腺癌和肺癌细胞系时,发现残余的耐药癌细胞,具有干细胞样特征、间充质样基因表达特征和GPX4依赖特征[22]。
4 铁死亡与肿瘤免疫
GPX4的活性不仅对癌细胞的存活很重要,对免疫细胞存活也同样重要。对T细胞的研究表明[23],GPX4缺失的抗原特异性CD8+和CD4+T细胞不能扩散。来自髓系的细胞GPX4缺失会增加脓毒症的发生,敲除髓系细胞中的GPX4可通过ROS的积累增加肠上皮细胞的基因突变刺激肠道肿瘤的发生和侵袭[24];提示GPX4在炎症和免疫过程中具有重要作用,调节某些免疫细胞铁死亡敏感性可能影响抗肿瘤免疫和肿瘤炎症微环境。
发生铁死亡的癌细胞可能具有免疫调节作用[10],如同发生细胞焦亡的细胞会释放一些物质一样[25],发生铁死亡的癌细胞也可能会释放一些信号物质。目前还不太清楚铁死亡癌细胞释放信号物质的类型与具体作用。有研究发现,发生铁死亡的癌细胞在体外被巨噬细胞有效吞噬,这支持了这种信号物质的存在[26]。有研究显示铁死亡癌细胞释放的氧化产物可能起到调节抗肿瘤免疫的作用[27]。铁死亡癌细胞还可以通过自噬依赖的方式释放高迁移率族蛋白B1(high mobility group protein B1, HMGB1)[28]。HMGB1属于细胞内称为损伤相关分子模式(damageassociated molecular patterns, DAMP)分子家族,一旦释放到细胞外,它们就获得免疫刺激特性和作为佐剂的功能,从而通过与模式识别受体结合促进先天和适应性免疫系统的激活,提示铁死亡癌细胞可能具有免疫原性。
5 小结
大量关于细胞死亡的研究让我们对细胞死亡的发生机制及特征以及诱导细胞死亡发生在肿瘤治疗上的作用有了进一步的认识。但铁死亡的发生机制、肿瘤细胞对铁死亡的敏感性及诱导肿瘤细胞发生铁死亡对免疫系统和肿瘤的影响等问题还在不断的研究、更新和提出更多问题。癌细胞铁死亡可能是把双刃剑[10],一方面可能通过牺牲一部分癌细胞发生铁死亡,同时释放一些信号分子抑制肿瘤免疫细胞,让某些肿瘤细胞逃脱免疫监视继续生长,另一方面可能释放一些如HMGB1之类的具有免疫原性的物质,激活免疫系统,从而抑制肿瘤生长。因此,进一步研究控制铁死亡的分子机制及其对机体微环境的影响具有重要的生理和病理意义。

