屠宰血液废弃物分解菌的筛选和鉴定
陶志东,王致远,甘 雨,马娜娜,马海锐,冉 权,李富贵,马 俊,丁功涛,铁文军,谢雕雕
(1. 西北民族大学生命科学与工程学院,甘肃兰州 730000;2. 西北民族大学生物医学研究中心,甘肃兰州 730000;3. 临夏市俊林清真肉制品有限责任公司,甘肃临夏 731100;4. 甘肃绿能农业科技股份有限公司,甘肃天祝 733200)
0 引言
我国是畜禽生产大国,根据国家统计局统计数据,2018 年中国牛、羊、猪、鸡的畜禽屠宰数分别为4 397.4 万头,31 010.4 万只,69 382 万头,790 000 万羽。据估算,牛、羊、猪、鸡的屠宰血液量分别为 8 6.7 万 t ,65.6 万 t ,499 万 t ,169 万 t 。畜禽屠宰后的血液,除极少数用作工业原料及制成蛋白饲料外,大部分的血液作为废弃物被排放,造成了屠宰场周围土壤和空气的污染,产生了巨大的环境压力;传统血液通过蒸煮、压榨、烘干后粉碎的方法加工,得到的产品吸收利用率低、生物安全性差,其中的血液蛋白没有得到有效利用且造成资源的浪费。因此,如何有效地处理屠宰场的血液废弃物成为了迫切解决的问题。
畜禽废弃血液的微生物降解是解决污染与蛋白有效利用的途径,能实现对血液蛋白的综合利用及提高产品的附加值,有效增加动物源性蛋白原料的供给和提高利用率。由于投入成本低、能源消耗少,蛋白质多肽和氨基酸含量较高[1],有降解蛋白废弃物以制备氨基酸水溶肥的潜力。
目前,研究的血液蛋白降解菌株主要有金黄色节杆菌(Arthobacter aurescens)、蜡样芽孢杆菌(Bacilluscereus)、米曲霉(Aspergillus oryzae)、短小芽孢杆菌 (Bacillus pumilus) 和枯草芽孢杆菌(Bacillus subtilis) 等[2-9]。这些筛选的菌株的蛋白降解率为20.25%~75.00%,测得的酶活力约为14~1 220.6 U/mL,酶解后的酶解液中可溶性蛋白质含量约为2.69%~290.00%,游离氨基酸含量约为0.98%~3.07%;在培养基上生长的透明圈DC 值范围为1.65~14.00[2-9]。研究的目标菌株均对屠宰血液废弃物有一定的分解作用,目前对屠宰废弃血液研究的方向更多是制作动物蛋白饲料,对微生物发酵生产氨基酸水溶肥方面研究较少。
国内外对牦牛血液蛋白降解菌的分离筛选研究较少,从屠宰场血液废弃物中分离出高效降解牦牛血液蛋白的菌株,并对其进行酶活力测定和分子生物学鉴定,旨在为畜禽废弃血液资源的合理利用、发酵生产氨基酸水溶肥提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集
菌株分离基质采自西藏日喀则市江孜县英雄路6 号屠宰场土壤,E89°60′92.18″, N28°91′00.74″。
1.1.2 试剂
蛋白胨、牛肉膏、琼脂粉、福林酚试剂,博精索拉博科技有限公司提供;NaCl、CaCl2,天津市大茂化学试剂厂提供;酵母提取物、胰蛋白胨,北京双旋微生物培养基制品厂提供;葡萄糖,国药集团化学试剂有限公司提供;MgSO4、KH2PO4、FeSO4,天津市百世化工有限公司提供;Na2HPO4,天津市北辰方正试剂厂提供;新生牛血清,兰州民海生物工程有限公司提供;ZnCL2,天津市风船化学试剂科技有限公司提供。
1.1.3 培养基
基础培养基。牛肉膏蛋白胨琼脂培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂10 g/L,血清 3%,pH 值 7.2~7.4。
富集培养基。LB 液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 值7.5。
蛋白筛选培养基。哥伦比亚血琼脂平板培养基:酪蛋白胰酶消化物、玉米淀粉、琼脂、新胰酶消化物、酵母浸出物、氯化钠、肉胃酶消化物、脱纤维羊血、蒸馏水,pH 值7.5。
酪蛋白培养基:KH2PO40.3 g/L,MgSO40.5 g/L,ZnCl20.014 g/L, NaCl 0.6 g/L, CaCl20.002 g/L,Na2HPO4·7H2O 1.07 g/L,FeSO40.002 g/L,酪蛋白4 g/L,胰蛋白胨0.05 g/L,琼脂15 g/L,pH 值6.5~7.0。
1.1.4 仪器设备
SW-CJ-1F 型超净工作台,苏州安泰空气技术有限公司产品;YXQ-LS 型立式压力蒸汽灭菌器,上海博讯医疗生物仪器股份有限公司产品; PCR 扩增仪,德国Biometra 公司产品;IS-ROV1 型立式恒温振荡器,上海智城分析仪器制造有限公司产品;DK-S24 型恒温水浴锅,上海精宏实验设备有限公司产品;Pico17 型高速离心机,热电发光二级管有限公司产品;1800PC 型紫外可见分光光度计,北京普析通用仪器有限责任公司产品;DYY-6D 型电泳仪电源,广东格兰仕微波生活电器制造有限公司产品;CKX53 型生物倒置显微镜,奥林巴斯产品;MJ-25OF-1 型霉菌培养箱,上海一恒科学仪器公司产品。
1.2 试验方法
1.2.1 分离纯化
取5 g 土样加入到装有无菌水的锥形瓶中,于恒温振荡器中以转速120 r/min 于37 ℃下培养12 h。
取培养上清液5 mL 加入到LB 液体培养基中进行富集培养,于振荡器中以转速150 r/min 37 ℃下培养24 h。培养结束时可用肉眼观察液体培养基是否变混浊,初步判断菌株是否发生增殖。
(1) 分离培养。吸取1 mL 富集培养液溶于9 mL无菌水中配成10-1菌悬液,再逐步稀释至10-6级数的菌悬液,取50 μL 加入到基础培养基的平皿上,采用稀释涂布法将菌液均匀涂布,于恒温培养箱中37 ℃下培养24 h。培养结束后观察培养平皿上菌落的种类和数量。
(2) 划线分离培养(初筛)。从培养后的平皿中挑取单个菌落,在基础培养基上采用划线分离培养法进行纯化培养,于恒温培养箱中37 ℃下培养24 h,观察其生长情况。纯化操作可重复3~5 次,直到其能在基础培养基上分散成单个菌落生长。将纯化后的菌株参考文献[10]方法进行保藏,并选出菌落直径较大的菌株,进行下一步菌株的测定。
1.2.2 蛋白降解效果测定
(1) 酪蛋白分解能力(复筛)。取在基础培养基上培养明显的单个菌落,用无菌接种环蘸取少量菌落接种于LB 液体培养基中进行扩大培养,置于恒温振荡器中,以转速150 r/min 在37 ℃下培养24 h。
采用打孔法在酪蛋白培养基上均匀打孔,取部分培养后的菌液,以每孔50 微升用移液枪进行加样,于恒温培养箱中37 ℃下培养24 h,观察菌种透明圈比值大小,初步判断菌株对蛋白质的分解能力,以确定该菌是否是所需的目标菌株。
(2) 血红蛋白降解能力。采用相同的方法在血琼脂平板上均匀打孔后加入适量菌液,于37 ℃培养箱中培养24 h,观察菌种透明圈比值大小。经培养后培养基上的水解透明圈直径越大,说明产酶能力越好且酶活力越高[9-11]。
1.2.3 形态学鉴定
选择在血琼脂平板培养基上透明圈明显的单个菌落进行观察,观察菌落的大小、形态、颜色、边缘、透明度和隆起程度,同时取部分菌落进行革兰氏染色后镜检,在光学显微镜的油镜下观察菌落细胞的形态和染色情况[12]。
1.2.4 生理生化鉴定
将在血琼脂平板上纯化后得到的单个菌落接种于斜面固体培养基活化,对活化后的菌株进行生理生化鉴定,主要从菌株对碳源和氮源的利用、硝酸还原、枸橼酸盐利用、氨基酸生成、硫化氢产生等方面来进行分析,根据分析所得结果,对照《常见细菌系统鉴定手册》[13]进行种属鉴定。
1.2.5 分子生物学鉴定
微生物菌株的16SrDNA 序列片段是鉴定物种的一个重要指标,通过使用试剂盒对菌株的总DNA 的抽提和引物的设计,将该菌成功进行PCR 扩增,并有效回收凝胶片段,送入生物公司完成测序。
(1) PCR 模板的制备。菌株 NwMcc01910045 的总DNA 提取和16SrRNA 的扩增方法参照文献[14]。试验采用的引物为27F:5-AGAGTTTGATCCTGGCT CAG-3'; 1492R: 5 GGTTACCTTGTTACGACTT-3'。将试剂盒中合成的引物干粉经离心加无菌水后制成引物的工作液。
(2) PCR 反应体系的配制。
PCR 反应体系见表1。

表1 PCR 反应体系
PCR 反应条件:94 ℃ 预变性4 min;94 ℃变性30 s;56 ℃退火 30 s,72 ℃延伸 3 min,共 30 次循环;最后72 ℃延伸10 min。
(3) PCR 产物电泳及测序。配置质量分数为0.8%的琼脂糖凝胶块,取2~3 μL PCR 产物在120 V电泳15~20 min,观察溴酚蓝指示剂在胶块中的位置。电泳结束后,取出凝胶块并在紫外线成像仪下观察各PCR 扩增产物在胶块中的位置,参照DNA Marker 确定各产物的分子大小。
将电泳结果正确(16SrDNA 全长为1 500 bp 左右) 的孔道所对应的PCR 样品送入相应的生物测序公司进行测序,将测序送回的序列经拼接后使用。
(4) 建立系统发育树。将拼接好的16S rRNA 全长序列在NCBI 的Nucleotide 数据库中进行BLAST 序列比对,与Genebank 中已知的16S rDNA 进行同源性比较。将分离菌株的16S rDNA 核酸序列和BLAST结果中的序列通过软件MEGA7.0 进行多重比对并采用Neighbor-Joining 方法构建系统发育树。
1.2.6 蛋白酶活力测定
粗酶液制备。将分离纯化后所得的单菌落,用接种环取少量至富集培养基中活化,于振荡器中37 ℃下以转速150 r/min 培养18~20 h;取活化后的菌液2 mL 于离心机中以转速10 000 r/min 离心10 min,弃去沉淀所得的上清液即为所需的粗酶液。
蛋白酶活力的测定。采用GB/T 23527—2009《蛋白酶制剂》法[15]。设置试验组和空白组,分别反应后采用紫外- 可见分光光度计于波长660 nm 处测定吸光度。
蛋白酶活力。采用福林酚法,在40 ℃,pH 值7.5 下水解酪蛋白以产生1 μg 酪氨酸所需的酶量被定义为一种蛋白酶活性单位。
计算:
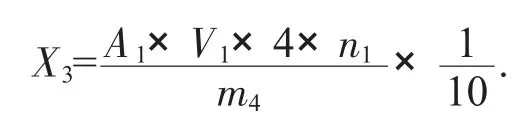
式中:X3——样品的酶活力,μ/g;
A1——由标准曲线得出的样品最终稀释液的活力,μ/mL;
V1——溶液样品所使用的容量瓶的体积,mL;
4——反应试剂的总体积,mL;
n1——样品的稀释倍数;
m4——样品的质量,g;
1/10——反应时间10 min,以1 min 计。
2 结果与分析
2.1 蛋白分解菌分离和筛选结果
菌株的分离筛选:初步获得1 株纯化菌株编号为NwMcc01910045。
酪蛋白筛选得到的透明圈见图1。
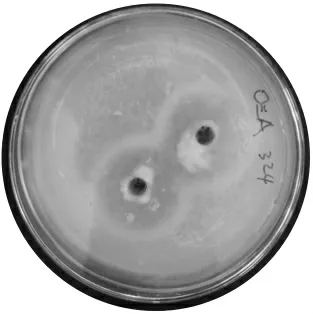
图1 酪蛋白筛选得到的透明圈
由图1 可知,菌株在酪蛋白培养基上生长良好且在菌落旁形成较大透明圈,证明该菌具备一定蛋白质的降解能力。
哥伦比亚血平板筛选得到的透明圈见图2。

图2 哥伦比亚血平板筛选得到的透明圈
蛋白质水解圈大小是衡量菌株产蛋白酶及降解血红蛋白能力的一个重要指标。蛋白质水解圈越大,说明该菌株所产蛋白酶的活力越高,降解血红蛋白的能力也就越强[16]。
2.2 菌株鉴定
2.2.1 形态学鉴定
菌落形态呈椭圆型,表面光滑潮湿,菌落呈黄色且不透明,边缘呈颗粒状半透明,长于培养基表面,菌落大小为1.8~2.4 mm。
通过革兰氏染色法,编号为NwMCC01910045 的菌株呈红色短杆状。
菌株NwMCC01910045 革兰氏染色结果见图3。
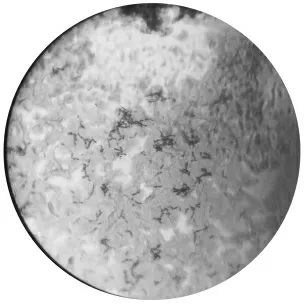
图3 菌株NwMCC01910045 革兰氏染色结果
2.2.2 生理生化特性
生化性质见表2。
根据菌株NwMCC01910045 的菌落形态、生理生化反应及革兰氏染色结果,按《常见细菌系统鉴定手册》初步鉴定为吉氏库特菌属(Kurthia sp.)。
2.2.3 分子生物学鉴定
(1) PCR 扩增电泳图。将分离纯化后的革兰氏阴性菌的菌液直接进行PCR 扩增反应。
PCR 扩增产物见图4。
由图4 可知,最左边依次为Marker 的条带组成,电泳方向从上往下。扩增结果表明菌株NwMcc01910045扩增的目的条带大小为1 500 bp 左右。

表2 生化性质

图4 PCR 扩增产物
(2) 系统发育分析。将菌株NwMcc01910045 送样分析后得到的16S rDNA 序列,在NCBI 上使用BLAST 软件将该序列与Genebank 数据库中已报道的16S rDNA 序列进行同源性比较。结果显示,菌株NwMcc01910045 与吉氏库特菌菌属(Kurthia sp.) 的序列同源性较高。将获得的NwMcc01910045 菌株和BLAST 结果中的15 条核酸序列,使用MEGA7.0 进行多重比对并绘制了系统进化树。
菌株NwMcc01910045 的系统进化树见图5。

图5 菌株NwMcc01910045 的系统进化树
由图5 可知,NwMcc01910045 与吉氏库特菌位于同一个分支上,同源性达到99.9%,具有较近的遗传距离,在生理生化鉴定时可基本断定其为吉氏库特菌。再根据革兰氏染色和生理生化鉴定等试验结果进行综合分析,确定将NwMcc01910045 菌株归属于吉氏库特菌菌属(Kurthia sp.)。
2.3 蛋白酶活力测定
酪氨酸标准曲线见图6。
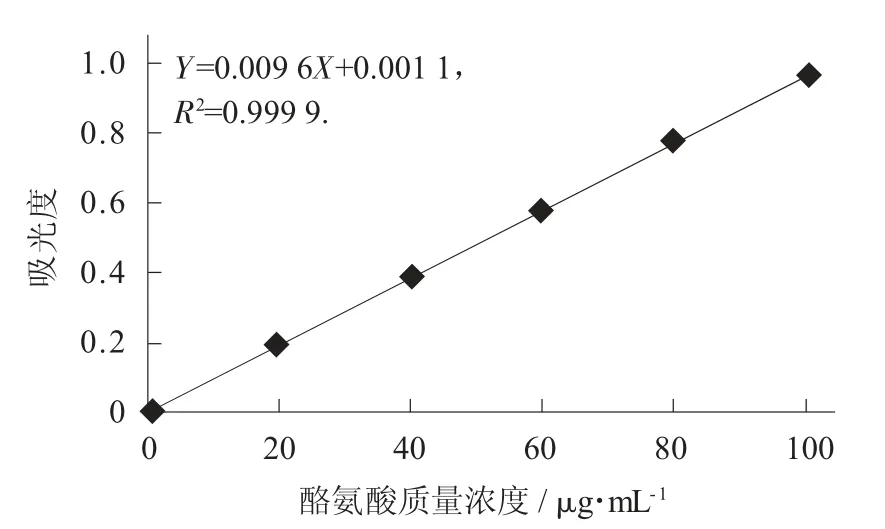
图6 酪氨酸标准曲线
2.4 蛋白酶活力
经试验测定得,菌株NwMcc01910044 的蛋白酶活力测定结果为88.69 U/mL。
3 结论
通过对屠宰场血液废弃物的分离纯化,从样品中筛选出1 株能在蛋白质培养基上良好生长的菌株,编号为NwMCC01910045,保藏于西北微生物菌种保藏中心。该菌表面光滑潮湿,菌落呈黄色不透明,边缘呈颗粒状半透明。通过生理生化鉴定该菌对糖降解没有反应,可产生DNA 酶,硝酸盐未还原,枸橼酸盐阳性,硫化氢阴性,对赖氨酸和鸟氨酸反应。经系统发育分析发现,菌株NwMCC01910045 与吉氏库特菌(Kurthia sp.) 的16S rRNA 的同源性较高,结合生理生化鉴定和菌落形态初步认定该菌为吉氏库特菌。酶活力大小为88.69 U/mL,是一株能高效降解蛋白质的菌株。
目前,对吉氏库特菌的研究较少,已知吉氏库特菌对头孢拉啶等27 种药物高度敏感[17];对微囊藻毒素降解范围为24.5%~62.2%[18];相比于NO1 菌株、B3 菌株分别于添加羽毛粉、猪血粉的培养基上生长,酶活力分别为 14 U/mL,1 220.6 U/mL[8-9];试验NwMCC01910045 菌株于添加血液蛋白的血琼脂平板上生长,酶活力比NO1 菌株高74.69 U/mL,而比B3菌株低1 131.91 U/mL。证明试验分离纯化得到的吉氏库特菌,具有降解屠宰血液废弃物以制备氨基酸水溶肥的潜力。
现有对蛋白降解菌株的研究已涉及基因工程、细胞工程等方向的新型生物技术手段,旨在提供一种可行的实验室分离纯化方法,从屠宰场的土壤中分离纯化得到对蛋白质具有降解能力的菌株。试验未对菌株的致病性、药物敏感性等生物安全性方面进行评价,尚且停留在实验室研究的初级阶段。项目后续将开展菌株NwMCC01910045 对土壤血污中血红蛋白的降解特性、降解产物氨基酸分析及降解工艺优化试验。

