拟穴青蟹细丝蛋白C的生物信息学分析及重组表达
何欣蓉,杨 阳,张永霞,刘 红,曹敏杰,刘光明
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;3.厦门市海洋功能食品重点实验室,福建 厦门 361021)
0 引言
蟹类作为一种营养价值高、肉质鲜美的水产品,广受消费者喜爱。但是,蟹类引起的食物过敏发病率却持续上升,成为了人们广泛关注的食品安全问题之一[1]。目前,拟穴青蟹(Scyllaparamamosain)中已有多种致敏原被发现并鉴定[2-8]。细丝蛋白是3种肌动蛋白交联蛋白,迄今已发现3种细丝蛋白亚型,即细丝蛋白A、细丝蛋白B和细丝蛋白C(filamin C,FLN c)[9-12]。3种亚型之间具有60%~80%同源性,仅两个铰链区差别较大。FLN c在克氏原螯虾(Procambarusclarkii)及拟穴青蟹中被分离鉴定为新型过敏原,且在克氏原螯虾中,FLN c与磷酸丙糖异构酶间具有免疫交叉反应[13]。FLN c作为拟穴青蟹的新型致敏原,YANG等[8]通过噬菌体展示技术淘选得到了7个线性表位及6个构象表位。目前,抗原表位与FLN c结构之间构效关系不明确,也未有相关晶体结构报道。天然FLN c纯化步骤繁琐,成本较高,得率较低,使得相关研究难以深入。在无法获得蛋白质的情况下,生物信息学分析[14-16]为蛋白质的理化性质及空间结构的分析提供了理论依据,它把基因组DNA序列信息分析作为源头,在获得蛋白质编码区的信息后进行蛋白质空间结构模拟和预测[17-18]。
蛋白质结构预测研究现状还不能完全满足实际需要,真正地解决这一问题还得从蛋白质自身入手,因此,获得大量纯化的蛋白质显得尤为重要。原核表达能够短时间内获得基因表达产物,而且所需的成本相对比较低廉,方法简单,可以表达的蛋白质也比较多。麦芽糖结合蛋白(maltose binding protein,MBP)标签可以促进蛋白质的可溶性和正确折叠,增加蛋白质表达量和稳定性,并且可实现简单亲和纯化,弥补了原核表达常以包涵体形式表达而导致产物纯化困难和蛋白质稳定性差的缺陷[19-20]。但由于FLN c具有较大的相对分子质量(90 ku),利用原核表达系统获得正确折叠的蛋白质难度较大,难以获得完整晶体,使得FLN c结构解析相关研究进展缓慢。本文通过生物信息学分析确定拟穴青蟹FLN c分段重组表达的区域,纯化鉴定出带有MBP标签的重组表达蛋白,并进行IgE结合能力分析,定位拟穴青蟹FLN c的抗原表位区域,获得的分段表达蛋白也可用于晶体学研究,并为过敏组分诊断提供理论依据。
1 材料与方法
1.1 原料与试剂
鲜活的拟穴青蟹购自厦门市集美新华都购物广场,取蟹脚与蟹钳部分肌肉组织,其中80 g用于纯化天然FLN c,100 mg用于提取RNA,其余置于-80 ℃保存备用。
甲壳类过敏患者血清(编号分别为 982509、879857、859809、892787、739647、722791)由厦门大学附属妇女儿童医院提供(伦理审查编号:KY-2019-014),所有血清分装后于-30 ℃冰箱保存备用(实验所用血清均为血清池)。SDS-PAGE所用的标准蛋白购自Fermentas公司,Western-blotting所用的预染标准蛋白购自New England Biolab公司,硝酸纤维素膜购自Amersham公司,羊抗兔HRP-IgG购自Dako公司,羊抗人HRP-IgE购自KPL公司,牛血清白蛋白购自Sigma公司,化学发光试剂购自Alpha Innotech公司,兔抗拟穴青蟹FLN c多克隆抗体由本实验室制备,其他试剂均为分析纯。
1.2 方法
1.2.1 生物信息学分析
利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)在线服务器分析拟穴青蟹FLN c的二级结构;利用SMART(http://smart.embl-heidelberg.de/)及NCBI Conserved Domain Search(https://www.ncbi.nlm.nih.gov/)确定拟穴青蟹FLN c的结构域,并于蛋白质数据库(protein data bank,PDB,http://www.rcsb.org/)中选择同源性较高的模板,在SWISS-MODEL(https://www.swissmodel.expasy.org/)上进行同源建模,并将输出的PDB模型在PyMOL软件上进行分析。预测结果中,全球模型质量评估(global model quality estimate,GMQE)可信度范围为0~1,定性模型能量分析(qualitative model energy analysis,QMEAN)可信度范围为-4~0。
1.2.2 拟穴青蟹总RNA提取和RT-PCR扩增目的基因片段
RNA提取步骤参考总RNA提取试剂盒说明书进行,检测提取的RNA浓度及纯度后,将其在-70 ℃保存备用。cDNA按PrimeScript TM Ⅱ 1st Strand cDNA合成试剂盒说明书合成[21]。
1.2.3 拟穴青蟹FLN c引物设计及合成
根据Genbank中检索的拟穴青蟹FLN c基因序列(编号 MK747241.1),并结合生物信息学分析,利用 Primer 5.0软件设计分段表达引物,确定3对PCR反应引物(FLN c1、FLN c2、FLN c3)及 3 对带有SalⅠ/NotⅠ酶切位点及保护碱基的表达引物(rFLN c1、rFLN c2、rFLN c3),实验所用引物由上海铂瑞生物技术有限公司合成,如表1所示。

表1 FLN c引物序列
1.2.4 拟穴青蟹FLN c的重组表达
构建FLN c分段克隆载体pEASY-T1-FLN c-1、pEASY-T1-FLN c-2、pEASY-T1-FLN c-3,将测序正确的质粒、带有MBP标签及6个His标签的V29H载体质粒分别用SalⅠ/NotⅠ双酶切处理,用T4 DNA连接酶将目的基因片段与载体酶切产物于16 ℃连接18 h以上,并转化到大肠杆菌BL21感受态细胞中。重组蛋白表达方法参考文献[22],收集所得全菌液、上清液及沉淀,利用SDS-PAGE(以空载体诱导物作为对照)鉴定诱导表达结果。
1.2.5 重组蛋白的鉴定及纯化
Western-blotting 采用林江伟等[23]的方法,以兔抗拟穴青蟹FLN c抗体(1∶50 000稀释)作为一抗孵育2 h,羊抗兔HRP-IgG(1∶2 000稀释)作为二抗孵育1 h,天然拟穴青蟹FLN c作为阳性对照,化学发光法显色。将鉴定结果正确的阳性转化子大量表达,由于重组蛋白带有His标签,因此将破碎离心所得上清液上样于镍柱纯化,收集目的蛋白后,将咪唑缓冲液置换为20 mmol/L Tris-HCl缓冲液。
1.2.6 重组蛋白的IgE结合活性分析
以蟹类过敏患者血清池(1∶4 稀释)作为一抗,羊抗人HRP-IgE(1∶2 000 稀释)作为二抗,利用Western-blotting分析重组蛋白与甲壳类过敏患者血清IgE结合情况,阳性对照为天然拟穴青蟹FLN c,阴性对照为牛血清蛋白(蛋白质质量浓度均为0.5 g/L,缓冲液浓度均为20 mmol/L Tris-HCl)。以非过敏患者血清池作为对照组。
2 结果与分析
2.1 拟穴青蟹FLN c的二级结构及结构域分析
通过分析拟穴青蟹天然FLN c一级结构,利用在线分析软件对FLN c二级结构进行预测分析,结果如图1所示。由图1可见,拟穴青蟹FLN c的二级结构元件主要有β-折叠(52.4%)和无规则卷曲(42.6%),α-螺旋的含量极少。蛋白质结构域是在较大的蛋白质分子中,由于多肽链上相邻的超二级结构紧密联系,故形成两个或多个在空间上可以明显区别的局部区域。结构域是介于二级和三级结构之间的一种结构层次,是蛋白质三级结构的基本结构单位。由于FLN c较大的分子质量,难以确定抗原表位及关键氨基酸位置,因此,通过划分结构域来了解该蛋白质的三维结构。利用SMART及NCBI Conserved Domain Search确定拟穴青蟹FLN c的结构域组成分布情况,结果如表2所示,两种软件预测结构域分布相似,因此可判断FLN c由9个结构域组成。

2.2 拟穴青蟹FLN c的三级结构分析
由于未有相关细丝蛋白完整晶体结构的报道,因此在掌握蛋白质一级结构前提下,可以利用SWISS-MODEL在线同源建模和PyMOL软件对三级模型进行分析。基于FLN c结构域的组成,将FLN c分为9部分(Domain 1~9),在PDB中使用同源性较高的人FLN a(ID:2K7P、2K7Q、4P3W)及人FLN c(ID:1V05)的X射线晶体结构分别作为模板生成拟穴青蟹FLN c的同源模型结构。PyMOL软件的输出图如图2所示。
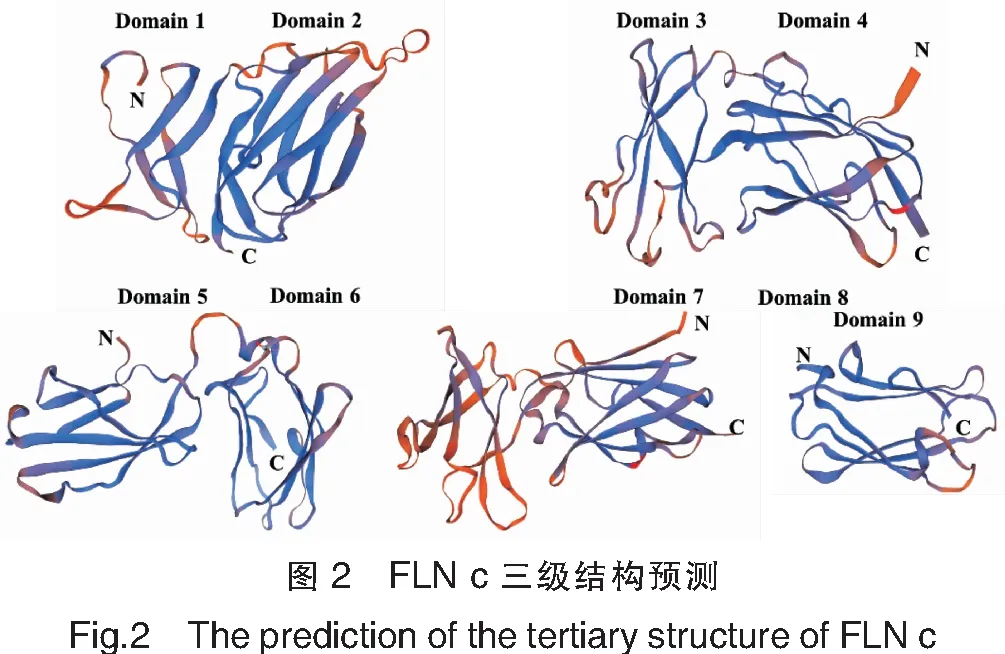

表2 FLN c的结构域预测Tab.2 Domain prediction of FLN c结构域Domain氨基酸位置Amino acid positionSMARTConserverd domain search12-482-52255-15258-1513155-240181-2344244-335245-3345340-433377-4266437-528438-5287531-623530-6178626-716627-7159756-845757-844
由图2可见,拟穴青蟹FLN c的3部分的三级结构均是由首尾相连的结构域组成的单体,每个单体由一个位于N末端的肌动蛋白结合域和一个由许多重复片段组成的C末端杆状结构域组成。杆状区的每一个重复序列由约100个残基组成,形成免疫球蛋白样折叠,具有典型的细丝蛋白家族特征。在X射线结构包含的区域中,拟穴青蟹FLN c的核心结构域与模板氨基酸序列同一性,EMQE与QMEAN可信度如表3所示,EMQE可信度与QMEAN可信度均在理想范围内,表明同源模型结构质量良好。

表3 FLN c的同源建模数据分析
2.3 拟穴青蟹FLN c的分段表达及产物鉴定
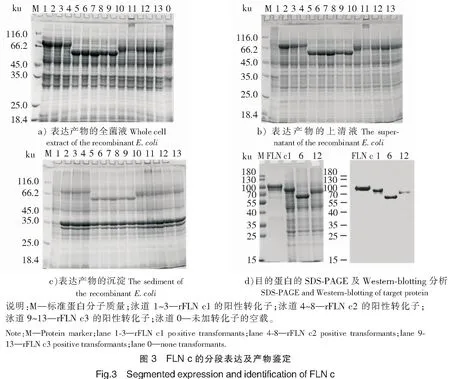
对FLN c一系列的生物信息学分析,并根据氨基酸数目将FLN c分为3部分进行分段重组表达(Domain 1~4、Domain 5~6、Domain 7~9),定位FLN c抗原表位优势区。将测序正确的阳性转化子于37 ℃诱导表达4 h,结果如图3a所示,阳性转化子均可在上清液中表达,表观相对分子质量分别为77,63,75 ku。为了鉴定重组蛋白,分别挑选表达量较高的1、6、12号阳性转化子的重组蛋白上清液与拟穴青蟹FLN c多克隆抗体结合,结果如图3b所示,重组蛋白上清液均能与抗体特异性结合,说明表达的重组蛋白即为拟穴青蟹rFLN c1、rFLN c2、rFLN c3。
2.4 表达蛋白的纯化及IgE结合活性分析
为了测定FLN c的分段表达产物致敏性差异,定位抗原表位所在结构域,将rFLN c1、rFLN c2、rFLN c3分别进行纯化,并用蟹类过敏患者血清验证其IgE结合活性,结果如图4所示。由图4a、图4b、图4c、图4d可见,重组蛋白均能用镍柱纯化后得到单一蛋白条带。纯化蛋白的血清学分析如图4e所示,根据箭头分别指出的重组蛋白的免疫印迹可知,rFLN c2的血清比rFLN c1、rFLN c3有较强的IgE结合能力,即rFLN c2的致敏性最强,rFLN c1的致敏性最弱,而非过敏患者血清池与重组蛋白未发生反应(见图4f)。

3 讨论
本研究首先通过一系列生物信息学分析手段,预测了拟穴青蟹FLN c的二级结构,结果与克氏原螯虾天然FLN c二级结构相似。通过预测拟穴青蟹FLN c结构域组成,发现其具有9个结构域。由于数据库缺乏细丝蛋白家族的完整晶体结构数据,因此通过其结构域组成将拟穴青蟹FLN c以人FLN a、FLN c的不同结构域的晶体结构同源建模,分别模拟了FLN c的空间结构。结果显示,拟穴青蟹FLN c的模拟三级结构均是由首尾相连的结构域组成的单体,结构相似且Domain 1与Domain 2、Domain 3与Domain 4、Domain 5与Domain 6、Domain 7与Domain 8之间紧密连接,对FLN c的三维结构研究提供一定的理论参考。由于缺少甲壳类水产品FLN c相关模板,利用人细丝蛋白家族作为模板与拟穴青蟹FLN c物种同源性差异较大,导致难以精准预测拟穴青蟹FLN c的三级结构,无法实现其抗原表位的定位[7,24]。然而,天然FLN c热稳定性弱,容易降解,且较难通过原核表达使得重组FLN c正确折叠,目前尚未得到适用于晶体学分析的蛋白质。
为了获得表达量大、可溶性强的FLN c重组蛋白,通过其关键致敏区域定位抗原表位优势区,基于FLN c空间结构预测等生物信息学分析,并参考氨基酸组成数量,将FLN c分为Domain 1~4、Domain 5~6及Domain7~9等3部分,对FLN c进行了分段重组表达。由于载体带有相对分子质量为40 ku的MBP融合蛋白,使得重组蛋白rFLN c1、rFLN c2、rFLN c3的表达量及溶解性明显增强[19-20],表达于上清液中证明蛋白质的正确折叠,同时导致目的蛋白的分子质量偏大。利用拟穴青蟹FLN c的多克隆抗体对目的蛋白鉴定,结果表明,特异性抗体均可识别目的蛋白,其中rFLN c3的IgG结合能力较弱,可能的原因是由于此结构域中IgG结合表位较少。另外,为了避免载体中杂蛋白对重组蛋白致敏性的影响,分别纯化得到了单一重组蛋白,并且纯化方法简单,得率高。血清学分析结果显示,rFLN c2与蟹过敏患者血清IgE结合能力最强,而之前所报道的抗原表位中rFLN c1含有1个线性表位及1个构象表位,rFLN c2含有3个线性表位及2个构象表位,rFLN c3含有3个线性表位及3个构象表位[8]。由于血液样本数量少,可能导致未淘选得到所有表位,且选用人体虱FLN c为模板,使得到的表位信息存在偏差。由此推测,rFLN c2可能含有更多表位,并且在FLN c构象表位淘选过程中,识别rFLN c2区域的构象表位的过敏患者血清IgE最多。综上,推断氨基酸336-531结构域中的抗原表位是蟹类过敏患者血清主要识别的表位区域。此外,rFLN c2与人FLN a空间结构的拟合度最高,均为单体,其分子质量较小且相关性质稳定,容易获得晶体,因此可以通过rFLN c2得到部分FLN c晶体,从而推测出FLN c的完整晶体结构。
4 结论
本研究通过生物信息学分析,预测了拟穴青蟹FLN c的高级结构,利用原核表达获得了rFLN c1、rFLN c2和rFLN c3,血清学实验表明,氨基酸336-531结构域可能是抗原表位优势区。另外,rFLN c2可用于FLN c的晶体学研究,为过敏组分诊断提供理论依据。

