溶血磷脂酸在甲状腺癌中的作用
范会利,薛刚,2,吴靖芳
(河北北方学院 1.形态学实验教学中心; 2.耳鼻咽喉头颈外科教研室,河北 张家口 075000)
近年来,甲状腺癌(thyroid cancer,TC)的发病率逐年上升,预计将成为全球第4大癌症类型,这归因于多个因素,包括对TC早期检测技术的提升、可改变的个人危险因素的患病率上升以及环境危险因素(例如碘水平)的增加等[1]。
TC虽属侵袭性相对较弱、预后较好而且5年及10年生存率均可高达90%以上的肿瘤,但在临床实践中发现,有不少患者在初诊时就出现大量淋巴结转移,并具有较高的侵袭性[2]。有研究表明在卵巢癌、恶性黑色素瘤、TC中溶血磷脂酸(lysophosphatidic acid,LPA)能够协同癌基因的激活来维持细胞增殖,促进细胞存活、侵袭和转移。由于LPA有很复杂的代谢网络和多方面的病理生理活动与生理功能交织,以及不同个体、不同疾病LPA受体介导的复杂和甚至相反的功能以及LPA检测技术瓶颈,是LPA在癌症诊断、治疗时面临巨大的挑战。
1 LPA
1.1 LPA合成
LPA即1-酰基-2-羟基-3-磷酸甘油,为430~480 Da的简单天然磷脂之一,属于甘油基溶血磷脂家族,是一种多功能的“磷脂信使”。由甘油主链、磷酸头基和不同长度饱和度酰基链的单尾组成。与大多数磷脂不同,因其甘油骨架上3位碳原子上含有磷酸基,2位碳原子上含羟基使其具有水溶性,因此它是水溶性的。LPA可以由血小板、成纤维细胞、癌细胞和脂肪细胞分泌,从多种类型的细胞释放。细胞外LPA有细胞来源和非细胞来源两种途径。首先,细胞内或细胞膜途径,是通过磷脂酶A1(PLA1)和磷脂酶A2(PLA2)水解来自膜衍生磷脂酸(PA)的脂肪酸部分,细胞内LPA是磷脂和三酰甘油合成的中间产物。LPA 非细胞来源途径是溶血磷脂酰胆碱 (lysophosphatidylcholine,LPC) 和溶血磷脂酰丝氨酸 (lysophosphatidylserine,LPS)等溶血磷脂中的胆碱和丝氨酸部分被溶血磷脂酰化酶D剪切、清除,该途径是血液LPA的主要来源[3-4]。LPA在血浆中被一类磷酸脂酶迅速翻转,使LPA去磷酸化,减少了LPA与受体结合和激活的作用[5]。当LPA的产生和降解这个平衡被打破后,就会产生高水平的LPA,导致一些病理变化。
1.2 自分泌运动因子(autotaxin,ATX)
Autotaxin(ATX) 又名作磷酸二酯酶Iα,一种分泌型糖蛋白,发现于人类黑色素瘤A2058细胞释放的一种自分泌运动刺激因子,ATX是外核苷酸焦磷酸酶/磷酸二酯酶家族中唯一具有溶血磷脂酶D活性的磷脂酶和磷酸二酯酶,它存在于组织和循环中,可以把LPC水解成溶血磷脂酸,发挥生物学效应[6]。因此,常把ATX-LPA看作生物轴发挥作用[7]。血清和血浆中生物活性LPA主要由ATX产生。 ATX+/-小鼠血清中的LPA水平降低了一半,支持了ATX作为产生细胞外循环LPA的主导合成酶的作用。ATX mRNA广泛表达,但其蛋白表达仅限于脂肪细胞、少突胶质细胞、脉络丛和支气管上皮细胞[8]。此外,人肠道内分泌细胞、脾脏B细胞也表达ATX,但通过免疫印迹或免疫组织化学方法,在癌细胞中的ATX表达相对较低或检测不到。ATX以一种前体酶的形式表达,继而经N-末端信号肽切除和弗林蛋白酶的裂解,通过经典的内质网-高尔基体途径以活化糖蛋白的形式分泌到细胞外[9]。分泌的ATX与细胞表面的整合素或硫酸乙酰肝素结合,使ATX在靶细胞上定位[10]。由于LPA的半衰期很短,约为3 min,ATX与细胞表面分子的这种相互作用提供了一种接近其同源受体的LPA局部产生的方法[11]。
1.3 细胞外代谢及LPA失活
生理浓度的LPA不仅存在于血清中,还存在于恶性肿瘤渗出液、唾液、卵泡液、精浆等。在血清、炎性渗出液或肿瘤细胞渗出液中,LPA可高达10 μM。有研究称在恶性液体中外泌体数量升高,可能是导致癌症患者中LPA异常生成增多的原因[12]。卵巢癌患者腹腔积液中含有大量的肿瘤和免疫细胞,它们相互作用产生具有促进转移和免疫抑制特性的多种介质,其中,LPA起着非常重要的作用,肿瘤相关巨噬细胞能在无脂培养基中产生20∶4的酰基LPA[13]。
LPA失活是通过磷脂磷酸水解酶家族(lipid phosphate phosphatase,LPPs)水解细胞外LPA的方式抑制LPA受体及其信号传导通路,阻断LPA的多种生物学效应;调控细胞内外活性磷酸脂类水平,维持细胞的正常生长、增殖过程。LPP-1可通过内皮分化基因受体2(endothelial differentiation gene 2,EDG-2)信号调控LPA的去磷酸化抑制细胞信号传导[14]。LPPs在卵巢癌细胞中的过度表达能降低集落形成,促进细胞凋亡,并减缓了体内外肿瘤的生长[15]。因此,LPA信号持续时间和强度可能少部分取决于LPP的表达水平。而在卵巢癌中LPP的表达降低[16]。因此,提高LPP活性将是一种有前景的治疗方案。
2 ATX-LPA信号轴的生物学功能
2.1 ATX-LPA信号轴功能概述
LPA与适当的受体结合后,激活磷脂酶C和MAPK、PI3K和RhoA途径,并参与各种细胞过程[17]。LPA受体是一种G蛋白偶联受体。至少有6个LPA受体,1996年鉴定并克隆了第一个LPA受体,发现了LPA1、LPA2和LPA3,它们都是GPCRs家族中EDG的成员。随后也鉴定了嘌呤能G蛋白偶联受体P2Y9(P2Y9/GPR23、LPAR5/GPR92和LPAR6/P2Y5)。另外有一些G蛋白偶联受体也被证明是公认的LPA受体,包括GPR87、GPR35和P2Y10[18]。
ATX-LPA信号轴在伤口愈合、正常妊娠植入、分娩、胎儿神经和血管发育等生理过程中至关重要,对机体主要起有益的保护作用[19-21]。多种生活方式和治疗因素会导致慢性炎症和与肥胖、高脂肪饮食、肿瘤细胞因子和DNA损伤致ATX-LPA信号失调[22]。反之,ATX-LPA升高可导致慢性炎症,导致人类疾病,包括心血管疾病、类风湿关节炎和其他自身免疫性疾病、神经病理性疼痛、先兆子痫和其他妊娠并发症、特发性肺纤维化、癌症以及对化疗和放疗的反应等[23](图1)。
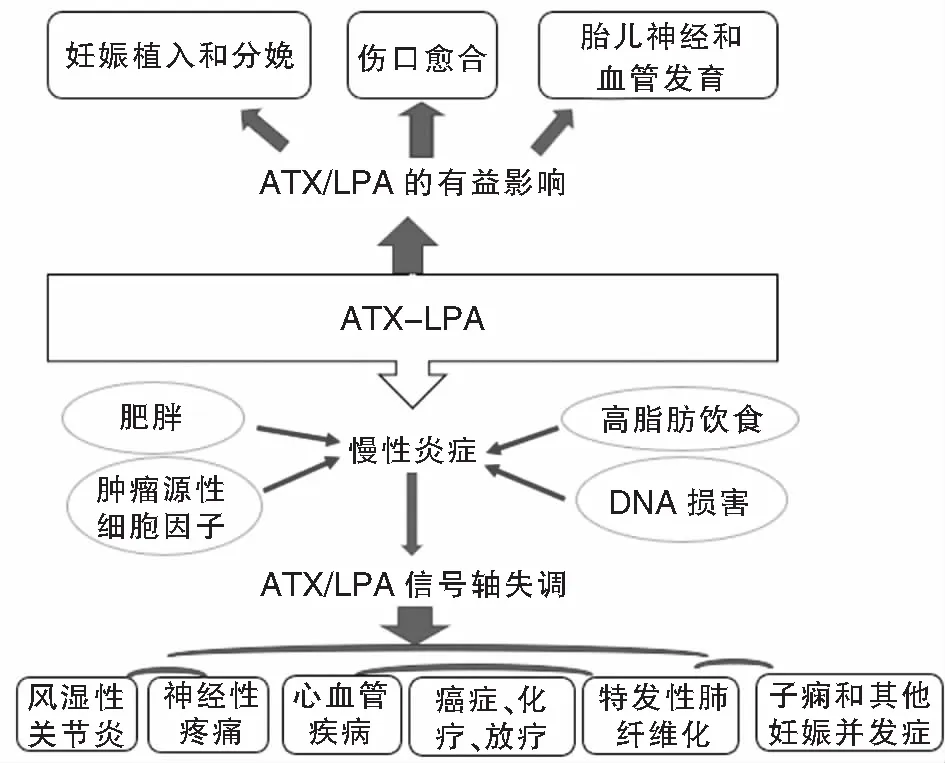
图1 ATX/LPA信号轴的功能
2.2 ATX-LPA信号轴与癌症
2.2.1 肿瘤细胞的增殖、浸润、转移 在多种不同细胞类型的癌症如神经母细胞瘤,LPA能够促进细胞的存活和增殖[24]。特异性LPA受体在肿瘤细胞转移中的作用也已被充分证实,LPA作为信号分子激活G蛋白偶联受体LPA1,LPA2和LPA3导致细胞增殖并促进肿瘤发生。LPA通过MAPK(ERK1/2,JNK1/2),Egr-1,AP-1和NF-κB信号轴诱导上调了 酪氨酸激酶受体表达,进而促进了膀胱癌T24细胞的细胞侵袭[25]。LPA促进了肺癌A549细胞系的迁移,增殖和集落形成。LPA1和LPA3在A549细胞中优先表达,并且Ki16425(LPA1和LPA3拮抗剂)和ono7300243(LPA1拮抗剂)都完全阻断了LPA诱导的作用。在动物模型中,LPA1过表达显着增加了A549细胞衍生的肿瘤体积,LPA1敲低显着降低了A549细胞衍生的肿瘤体积,表明LPA1是体内肿瘤形成的调节剂。LPA1 / Gi / MAP激酶/NF-κB途径与LPA诱导的A549细胞致癌作用有关。因此,靶向LPA1可能是治疗肺癌的新策略[26]。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)细胞通过与胰腺星状细胞转分化为活化的癌症相关成纤维细胞共同作用产生 LPA,通过ATX-LPA轴促进PDAC细胞增殖,迁移和AKT活化,ATX抑制剂抑制了PDAC在体内的生长[27]。最新研究表明,ATX-LPA轴与肿瘤进展有关,作为神经系统常驻巨噬细胞的小胶质细胞表达高水平ATX,神经胶质母细胞瘤与小胶质细胞共培养,可以促进神经胶质母细胞瘤细胞的转移、存活和增殖且该作用被LPA1抑制剂阻断[28]。在肿瘤微环境中小胶质细胞产生的LPA以自分泌或旁分泌途径作用于LPAR 1促进肿瘤细胞的转移、存活和增殖。
2.2.2 ATX-LP A受体轴在癌干细胞中的作用 肿瘤细胞的遗传不稳定性导致肿瘤细胞群的异质性。癌干细胞(cancer stem cells,CSC)在自我更新、侵袭、转移等方面具有独特特性,CSC与其子细胞之间存在着另一种异质性[29]。随着原发性肿瘤成功根除,靶向CSC和肿瘤转移的治疗越来越受到重视。ATX-LPA信号轴在CSC的生长、侵袭、转移和TME的重编程中起着重要作用。Ray 等[30]研究表明LPA因其促进上皮-间质转化(epithelial-mesenchymal transition,EMT)的能力是CSC侵袭和转移能力发展的关键步骤。ATX上调是伴随EMT的事件ATX-LPA激活了驱动EMT的信号通路,如PI3K/AKT/mTOR/Skp2/p27[31]。ATX抑制剂剂量依赖性地降低4T1小鼠乳腺癌乳腺球的生存能力[32]。ATX-LPA轴是乳腺癌CSC生长和进展的主要调控系统[33]。在羊膜上皮细胞体外EMT模型研究中发现LPA合成和降解酶在调节EMT中具有相反的作用[34]。
2.2.3 在肿瘤微环境中的作用 肿瘤微环境(the tumor microenvironment,TME)是指癌细胞与多种基质成分(如细胞外基质ECM)、肿瘤细胞周围基质中的与肿瘤相关的成纤维细胞、内皮细胞、周细胞、脂肪细胞、间充质干细胞和免疫系统细胞(B淋巴细胞、T 淋巴细胞、髓源性细胞、单核细胞、肿瘤相关巨噬细胞)相互作用构成的促肿瘤生长微环境。LPA是癌细胞与TME交互的核心,并且LPA和ATX在许多癌症的表达都是上调的。LPA通过促进血管生成、增殖、生存、侵袭和转移来促进肿瘤的进展。
TME中的基质细胞和肿瘤细胞通过旁分泌或细胞-细胞间的直接作用,诱发肿瘤细胞代谢发生重编程。即肿瘤细胞根据自身所处环境的变化而选择适合自己的代谢方式来满足自身增殖,这种改变肿瘤能量代谢方式的适应性称为能量代谢重编程[35]。最近的证据表明,在某些类型的癌症如前列腺癌中,细胞增殖的启动更依赖于脂质代谢而不是糖酵解[36]。靶向抑制脂肪酸合成可以削弱细胞增殖和存活的能力,其机制与限制脂质膜的产生,以及阻断线粒体中脂肪酸的β-氧化有关。目前,针对于脂肪酸合成的靶点主要有ATP 柠檬酸裂解酶和脂肪酸合成酶。除了癌细胞外,TME也是ATX和LPA的重要来源。乳腺富含脂肪细胞的基质为乳腺癌的生长和进展提供了丰富的LPA来源,ATX-LPA轴可使TME的基质成分产生大量促炎介质,并在癌症的进展和转移扩散中具有重要的意义[37]。ATX-LPA轴介导癌症治疗抵抗的一个主要调节系统,Akt激酶-NFkB转录因子在介导放疗和化疗耐药中的作用也已经明确[38]。
3 靶向ATX-LPA信号轴的治疗策略
靶向LPA及其信号通路和受体的治疗意义对多种疾病的病理生理过程有重要的意义。以LPA生物合成、代谢或信号通路为靶点的研究可能有助于多种疾病的治疗(图2)。如使用ATX抑制剂(GLPG1690,NCT02738801等)来减少LPA的生成;使用LPA单克隆抗体(Lpathomab)来降低LPA的水平;使用LPA受体拮抗剂(NCT01766817靶向LPAR1)来阻止LPA受体(LPAR)的激活从而阻止信号的启动;使用G蛋白抑制剂,β-阻滞剂和蛋白酪氨酸激酶受体(PTKRs)或丝氨酸/苏氨酸激酶受体(S/TKRs)阻断上游信号;而下游效应器抑制剂是LPA信号阻断的另一种选择[39]。
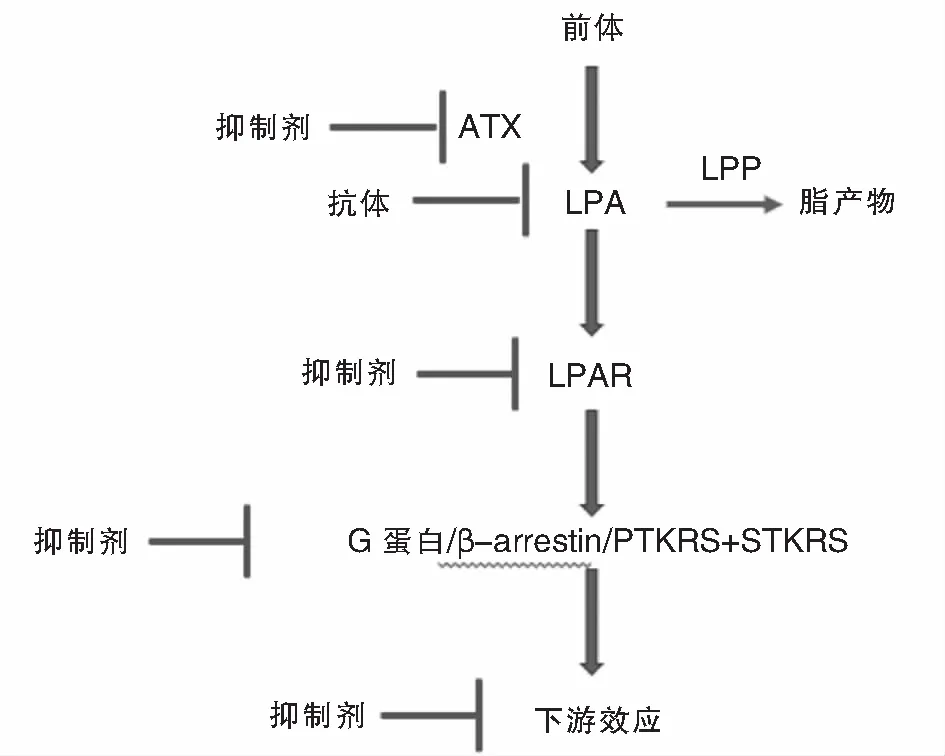
图2 针对LPA信号通路的潜在治疗靶点
4 ATX-LPA在TC中的作用
4.1 TC的诊断标志物
脂质不仅在膜结构的形成和能量存储中起着重要作用,而且在信号转导,细胞增殖和凋亡中也起着重要作用。据报道,癌细胞在脂质代谢中的变化影响许多细胞功能,并且在许多疾病中发现了脂质组成的变化。已经开发了几种脂质组学方法来发现潜在的癌症脂质生物标志物[40]。利用纳流超高效液相色谱-电喷雾电离-串联质谱(nUHPLC-ESI-MS/MS)对5种常见癌症(肝癌、肺癌、胃癌、结直肠癌和TC)患者血液进行了全面的脂质组学分析显示脂质种类与多种癌症显著相关。其中,溶血磷脂酰乙醇胺和血浆置换血浆蛋白原,在肝癌、肺癌、胃癌、结直肠癌中均明显偏低,而在TC中则较高。受试者工作曲线分析显示溶血磷脂酰肌醇是TC特有的脂质。这一结果为将来验证LPA作为TC的特异性脂质标志物提供了基础[41]。
4.2 ATX-LPA信号对TC生物学行的影响
Shin等[42]报道了不同类型TC中ATX-LPA信号相关的蛋白对复发和转移性TC的影响,显示髓样癌ATX表达水平最高,LPA1在低分化癌和间变癌较高,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)中LPA2、LPA3表达水平最高。传统PTC中ATX,LPA1,LPA2 水平高于滤泡变异型FVPTC,BRAFV600E突变型PTC中 ATX,LPA1,LPA2,LPA3高于无突变型 PTC,ATX 与LPA1 与PTC缩短得生存期呈正相关。Schulte等[43]研究表明正常甲状腺、甲状腺肿和乳头状或滤泡状TC表达2种高亲和力同源LPA受体EDG2和EDG4。乳头状癌和滤泡状癌的EDG4受体mRNA表达较正常甲状腺或甲状腺肿增加3倍。EDG2受体在恶性肿瘤中的总量无明显变化,但单个标本EDG2表达增高与淋巴结转移有关。高亲和力LPA受体EDG4的mRNA表达改变与分化型TC的发病机制有关。与细胞运动有关的甲状腺受体相互作用蛋白6(TRIP6)与LPA2受体结合,增强LPA诱导的细胞迁移能力,TRIP6的过表达增强了LPA诱导的细胞迁移;相反,TRIP6特异性小干扰RNA抑制内源性TRIP6的表达降低了SKOV3卵巢癌细胞的TRIP6表达,通过激活小G蛋白Rho及其下游效应物,诱导肌动蛋白重排、局部粘附和细胞迁移[44]。2005年Lai等[45]证实LPA通过调节c-Src介导的TRIP6 Tyr-55残基磷酸化水平诱导的TC细胞形态学改变和细胞迁移能力。Wu等[46]发现下调LPAR5表达通过P13K/AKT通路和EMT抑制剂PTC的进展。
Benesch 等[47]报道ATX在TC原发灶和转移灶上调4~10倍,在有炎细胞浸润的良性肿瘤中ATX也高表达;原代培养的TC细胞显示ATX通过LPA的形成增加了癌培养物中16种炎症介质的分泌。有研究认为ATX、LPA和炎症介质的高表达是甲状腺恶性疾病的特征。ATX抑制剂剥夺癌细胞的LPA和随之而来的大量炎性趋化因子和细胞因子的分泌,而这些炎性趋化因子和细胞因子会推动癌症的发展。到目前为止,还没有ATX抑制剂被引入临床实践。但有结果支持使用ATX抑制剂可作为一种潜在的新策略来对抗ATX-LPA炎症轴对TC的影响。
5 展望
此综述主要概述了LPA生物学特性以及ATX-LPA信号轴的功能和在癌症增殖,迁移等方面的作用。现在癌症发病机制尚不清楚,研究LPA对TC作用为未来更进一步的研究TC提供新的靶点。

