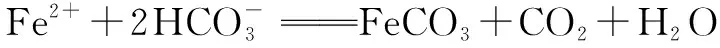善用平衡常数
——释疑难点
石乾坤
(江西省南康中学 341400)
问题情境:人教版选修5第32页图2-6:“乙炔的实验室制取及性质检验”装置图中,产生的气体先通入CuSO4溶液,其目的主要是除去H2S和PH3气体…
发生的反应之一是:

很学生提出该反应违背了“强酸制弱酸”的原理,能发生吗?
分析问题反应进行的程度与平衡常数(K)有关.一般地认为:K>1×105时,该反应进行得就基本完全了.K<1×10-5时,该反应不能发生.那么可以从这个角度来分析:
解决问题该反应的离子方程式为:

根据平衡常数表达式可知:
=1.47×1018≫1×105
因此,该反应可以彻底完成.
拓展与思考一定温度下反应

事实上实验室制H2S的原理是:

规律1.金属硫化物能否溶于非氧化性酸,关键是看Ksp是否足够小.
若Ksp<1×10-27,则不溶于非氧化性强酸(如H2SO4,HCl等).
2.判断一个反应的程度有多大或者能不能发生,可以用平衡常数来衡量:即一般地认为:K>1×105时,该反应进行得就基本完全了.K<1×10-5时,该反应不能发生.
例(2019年Ⅲ卷26年)高纯硫酸锰作为合成镍钴锰三元正极材料的原料.
写出“沉锰”的离子方程式____.


图1
点拨分析仍然可以从平衡常数的角度分析:
假设反应①:
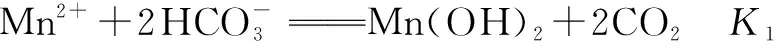
根据平衡常数表达式可知:
因为K1很小,所以得到的Mn(OH)2可以忽略.
假设反应②:
根据平衡常数表达式可知:
=4.77×106>1×105
因为K2>105,反应基本完全,所以反应②是主要的,即主要产物是MnCO3
建立模型:如图2所示
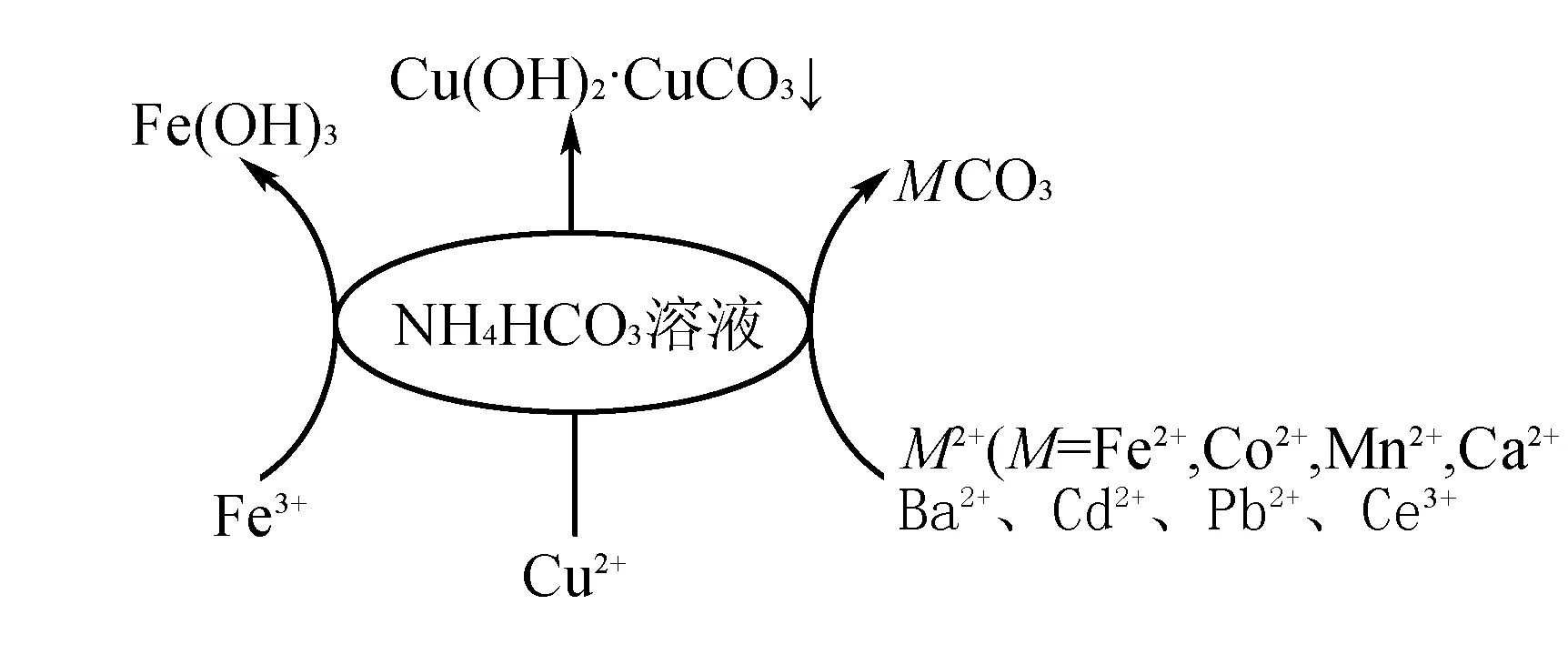
图2
用模:(对点练习)1.(沉铁)(2009年北京 28节选) FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液.请写出相关反应的离子方程式____.
2.(沉铝)(2020 安徽定远)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:

图3
已知:部分阳离子以氢氧化物形式沉淀时溶液的 pH 见表1.
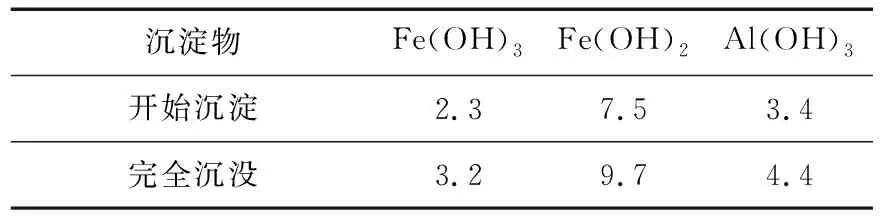
表1
加入少量 NaHCO3的目的是____.
3.(沉铁)(2020 山西实验)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备, 铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质.制备流程如图4所示:

图4
写出步骤7中涉及的离子方程式____.

(2)(2020 安徽定远)解析:废铁中有氧化铝杂质,所以加入 NaHCO3来调节 pH到弱碱性,来沉淀铝离子.
答案:调节 pH,使溶液中的 Al3+沉淀
(3)(2020 山西实验)