膜联蛋白A5对胶质瘤细胞侵袭和迁移的调节作用及机制
李传坤,梁 鹏,王 伟,姜海涛
(1. 西安交通大学第一附属医院神经外科,陕西西安 710061;2.西安交通大学第一附属医院医疗质量控制办公室,陕西西安 710061)
神经胶质瘤是一种常见的成人原发性脑肿瘤,目前神经胶质瘤的总体存活率仍然很低,并且仍未完全明确相关的发病机制[1]。先前的研究表明,重要基因的功能异常将影响患者预后。膜联蛋白是钙依赖性磷脂结合蛋白超家族的成员,膜联蛋白A5是人类中普遍存在且广泛表达的胞内蛋白,分子质量约为35.7 ku,其与许多膜相关事件有关[2]。膜联蛋白A5具有滋养细胞膜修复、抗凝、调节细胞信号转导等多种功能。最近研究表明,膜联蛋白A5与肺癌、结肠癌和前列腺癌的进展有关[3-4]。据报道,膜联蛋白A2和A5可以增加系统性红斑狼疮的细胞凋亡[5]。此外,膜联蛋白A5在子宫宫颈鳞状细胞癌(UCSCCs)中过表达,并且与分化程度显著相关[6]。目前,关于膜联蛋白A5在神经胶质瘤中的生物学作用尚不明确。有研究发现,与正常脑组织相比,胶质瘤脑组织中膜联蛋白A5的表达明显增加,提示膜联蛋白A5可能是一种恶性胶质瘤诊断的生物标志物。但是,膜联蛋白A5对胶质瘤患者预后及细胞生物学行为的影响与机制仍然有待进一步研究。本研究分析了膜联蛋白A5与神经胶质瘤患者临床病理特征的相关性,并观察膜联蛋白A5在体外和体内对肿瘤生长和转移的调控作用。
1 材料与方法
1.1 药品及试剂Dulbecco改良的Eagle培养基购自美国Gibco公司,TRIzol试剂购自美国Invitrogen公司,逆转录试剂盒购自日本TaKaRa公司,DAB显色试剂盒、MTT测定试剂盒购自英国Abcam公司,RIPA缓冲液购自碧云天生物技术研究所,膜联蛋白A5、Raf、p-Raf、MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2、c-Myc、E-Cadherin和GAPDH抗体均购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的的二抗、ECL检测试剂购自美国Santa Cruz公司,Lipofectamine 2000购自美国Invitrogen公司,膜联蛋白V(Annexin V)-FITC/碘化丙啶(PI)测定试剂盒购自江苏凯基生物技术股份有限公司,Hoechst 33258染色液购自北京索莱宝科技有限公司,Transwells购自美国Minipore公司,Matrigel购自美国BD Biosciences公司。
1.2 患者组织的收集选取西安交通大学第一附属医院2013-2018年确诊并经手术治疗的100例神经胶质瘤患者的胶质瘤标本,其中男性56例,女性44例,年龄26~77岁,平均(45.52±22.16)岁。根据2016年世界卫生组织(WHO)对中枢神经系统肿瘤的分类标准[1],将患者进行分级,其中Ⅰ级13例,Ⅱ级35例,Ⅲ级34例,Ⅳ级18例。患者手术前均未进行放化疗治疗。正常脑组织标本为我院保存的脑外伤患者伤后早期行颅内减压术中切取的、术后经病理诊断证明为正常脑组织的标本,共20份。本研究已获得患者的书面知情同意书并经医院机构审查委员会批准。
1.3 细胞培养正常人脑胶质细胞系(HEB)和人神经胶质瘤细胞系(U251)购自美国典型培养物保藏中心(ATCC)。将HEB和U251细胞在含有100 mL/L胎牛血清和5%青霉素/链霉素的Dulbecco改良的Eagle培养基中,于50 mL/L CO2、37 ℃的潮湿环境中培养。
1.4 免疫组化检测采用链霉素抗生物素蛋白-过氧化物酶(SP)免疫组化法检测胶质瘤组织中膜联蛋白A5的表达。滴加一抗(膜联蛋白A5,1∶500稀释)4 ℃孵育过夜,与对应的二抗(1∶100稀释)37 ℃孵育20 min,然后与链霉菌抗生物素蛋白-过氧化酶(1∶100稀释)37 ℃孵育20 min。DAB显色,苏木素复染。
阳性判定:阳性染色细胞呈棕黄色,在400×放大倍数下随机选择5个视野并计数阳性细胞数量。阳性细胞数量评分标准如下。≤4%为0分,4%~24%为1分,25%~49%为2分,50%~74%为3分,75%~100%为4分。染色强度评分标准如下。无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。阳性染色评分=阳性细胞数量评分×染色强度评分。阳性染色评分判定:0分为阴性(-)、1~2 分为弱阳性(+)、3~4分为中等阳性()、4分以上为强阳性()。
1.5 RNA提取和RT-PCR分析按照说明用Trizol试剂分别提取HEB和U251细胞及胶质瘤组织总RNA,逆转录试剂盒进行逆转录反应,美国Applied Biosystems ABI 7500荧光定量PCR仪进行RT-PCR。引物序列如下:膜联蛋白A5,正向 5′-TCGCAGAGATGTCCAGTCAG-3′,反向 5′-CCTGAAGAGTTCCTCCACCA-3′;β-actin,正向 5′-GATCATTGCTCCTCCTGAGC-3′,反向 5′-TGTGGACTTGGGAGAGGACT-3′。β-actin作为内参对照,计算2-ΔΔCt观察mRNA相对表达。实验重复至少3次。
1.6 蛋白印迹分析用含有蛋白酶/磷酸酶抑制剂的RIPA缓冲液从HEB和U251细胞及胶质瘤组织中分别提取总蛋白。将蛋白质上样至100 g/L SDS-PAGE进行电泳并转移到PVDF膜上后,将膜在50 g/L脱脂奶粉中封闭1 h,与一抗在4 ℃过夜孵育(稀释比分别为:膜联蛋白A5、c-Myc、E-Cadherin,1∶500;Raf、p-Raf、MEK1/2、p-MEK1/2及内参GAPDH均为1∶1 000;ERK1/2、p-ERK1/2为1∶2 000)。然后将膜与辣根过氧化物酶标记的的二抗在室温下孵育1 h。通过ECL检测溶液进行显影。
1.7 siRNA转染靶向膜联蛋白A5的小干扰RNA(siRNA)(si-Annexin A5)和阴性对照siRNA(si-NC)由上海吉玛制药技术有限公司合成。按说明用Lipofectamine 2000将siRNA分别转染U251细胞,孵育72 h后收集细胞,并用RT-PCR和蛋白印迹法测定膜联蛋白A5的表达。
1.8 MTT和集落形成实验MTT法检测细胞增殖。将U251细胞以1×104/孔接种于96孔板中。孵育24 h,加入50 μL的MTT再培养4 h后,弃去培养基,每孔加入150 μL二甲基亚砜并摇动10 min,并且在492 nm波长下读取每孔吸光度(A)值。
将500个U251细胞接种到6孔板(2 mL完全培养基,37 ℃培养箱),4 d更换1次培养基。14 d将细胞用40 g/L多聚甲醛固定,并用1 g/L结晶紫染色,显微镜下计数集落。
1.9 流式细胞仪分析用Annexin V-FITC/PI测定试剂盒检测细胞凋亡。将1×105个U251细胞用PBS洗涤3次,暗盒中重悬于含有10 μL Annexin V-FITC和5 μL PI的500 μL结合缓冲液中,孵育20 min后洗涤细胞,并通过德国BD公司流式细胞仪分析细胞凋亡。
1.10 Hoechst 33258染色将U251细胞在40 g/L多聚甲醛中固定20 min。吸出固定溶液,并在室温下加入预冷的无水乙醇并孵育20 min后,吸出乙醇,并用PBS冲洗3次。加入100 μL Hoechst稀释液并孵育10 min。使用荧光显微镜观察染色情况。
1.11 使用Matrigel Transwell实验评估细胞的侵袭能力将孔径为8 μm的24孔Transwells上室预先用Matrigel涂覆。然后将1×105个U251细胞加入含有10 mL/L FBS的200 μL DMEM中并添加至上室,将600 μL含有100 mL/L FBS的DMEM添加至下室。孵育24 h后,用棉签去除上室中的非侵袭细胞,用PBS洗涤2次后,用40 g/L多聚甲醛固定、结晶紫染色,在显微镜下以200倍放大倍数计数侵袭细胞的数目。
1.12 伤口愈合实验将U251细胞用无血清培养基重悬并调整密度为2.5×105/mL,然后取2 mL接种到6孔板中并于37 ℃、50 mL/L CO2环境中培养24 h。待细胞完全贴壁后用枪头划直线形成划痕。PBS清洗后加入无血清培养基。分别于0 h和24 h进行拍照。

2 结 果
2.1 不同级别胶质瘤组织中膜联蛋白A5的表达免疫组化分析显示,正常脑组织中膜联蛋白A5不表达或低表达,胶质瘤组织中的膜联蛋白A5主要在细胞膜和细胞质中表达,并且阳性染色强度与肿瘤级别有关(图1)。Pearson相关分析显示,随着肿瘤级别的升高,膜联蛋白A5阳性率逐渐升高,并且肿瘤级别与阳性率呈正相关(r=1.000,P<0.001,表1)。
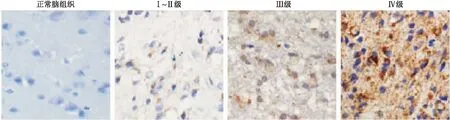
图1 不同级别胶质瘤组织中膜联蛋白A5的免疫组化染色结果Fig.1 Immunohistochemical staining of Annexin A5 in different grades of glioma tissues
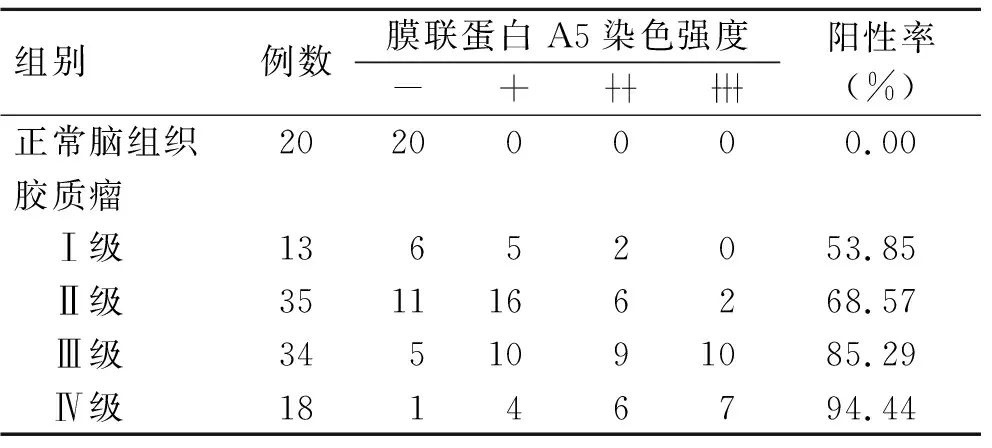
表1 不同级别胶质瘤组织中膜联蛋白A5的染色强度Tab.1 The staining intensity of Annexin A5 in different grades of glioma tissues
2.2 膜联蛋白A5在胶质瘤组织和细胞系中的表达通过RT-PCR和蛋白印迹分析显示,与正常脑组织相比,胶质瘤组织中的膜联蛋白A5的mRNA表达升高了2.45倍(t=25.860,P<0.001),蛋白表达升高了2.87倍(t=29.440,P<0.001)。此外,与HEB相比,U251中的膜联蛋白A5的mRNA表达升高了4.12倍(t=33.849,P<0.001),蛋白表达升高了2.75倍(t=27.001,P<0.001,图2)。
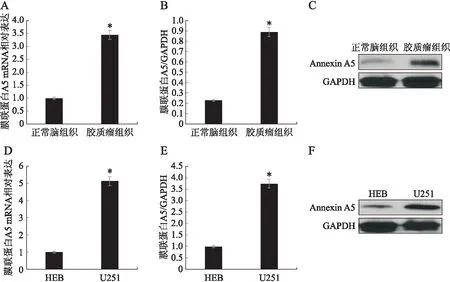
图2 胶质瘤组织和细胞系中膜联蛋白A5的mRNA和蛋白表达情况及比较Fig.2 Comparison of mRNA and protein expression of Annexin A5 in glioma tissues and cell linesA~C:脑组织中膜联蛋白A5的表达;D~F:细胞系中膜联蛋白A5的表达。与胶质瘤组织或HEB细胞相比,*P<0.001。
2.3 膜联蛋白A5对胶质瘤细胞增殖的影响转染靶向膜联蛋白A5的miRNA下调了U251细胞中的膜联蛋白A5的mRNA(下降了68.03%,F=239.537,P<0.001)和蛋白表达(下降了70.35%,F=247.947,P<0.001)。MTT实验显示,与对照组相比,si-Annexin A5组的U251细胞在培养 48 h(降低了29.46%,F=131.262,P<0.001)和72 h(降低了40.43%,F=175.900,P<0.001)后的细胞活力明显降低。集落形成实验显示,与对照组相比,si-Annexin A5组的集落形成率降低了68.58%(F=241.095,P<0.001,图3)。
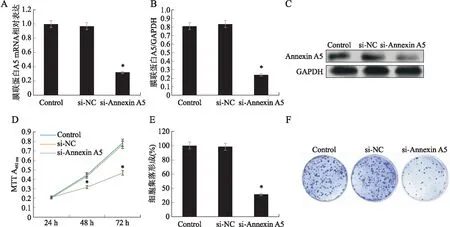
图3 下调膜联蛋白A5的表达对U251细胞增殖的影响Fig.3 The effect of downregulating annexin A5 expression on U251 cell proliferationA~C:转染miRNA下调了膜联蛋白A5的mRNA和蛋白表达;D:MTT实验;E和F:集落形成实验。与对照组(Control)相比,*P<0.001。
2.4 膜联蛋白A5对胶质瘤细胞凋亡的影响流式细胞仪分析显示,与对照组的细胞凋亡率(0.46±0.03)%相比,si-Annexin A5组的(11.23±0.66)%明显升高了23.41倍(F=231.016,P<0.001);Hoechst 33258染色也显示,si-Annexin A5组的Hoechst阳性细胞数明显增加(图4)。

图4 下调膜联蛋白A5对U251细胞凋亡的影响Fig.4 The effect of downregulation of Annexin A5 on apoptosis of U251 cellsA:流式细胞仪分析;B:Hoechst 33258染色。
2.5 膜联蛋白A5对胶质瘤细胞迁移和侵袭的影响侵袭测定显示,与对照组相比,si-Annexin A5组的迁移细胞率明显降低了65.35%(F=226.848,P<0.001);伤口愈合实验显示,与对照组相比, si-Annexin A5组的侵袭细胞率明显降低了68.80%(F=237.306,P<0.001,图5)。
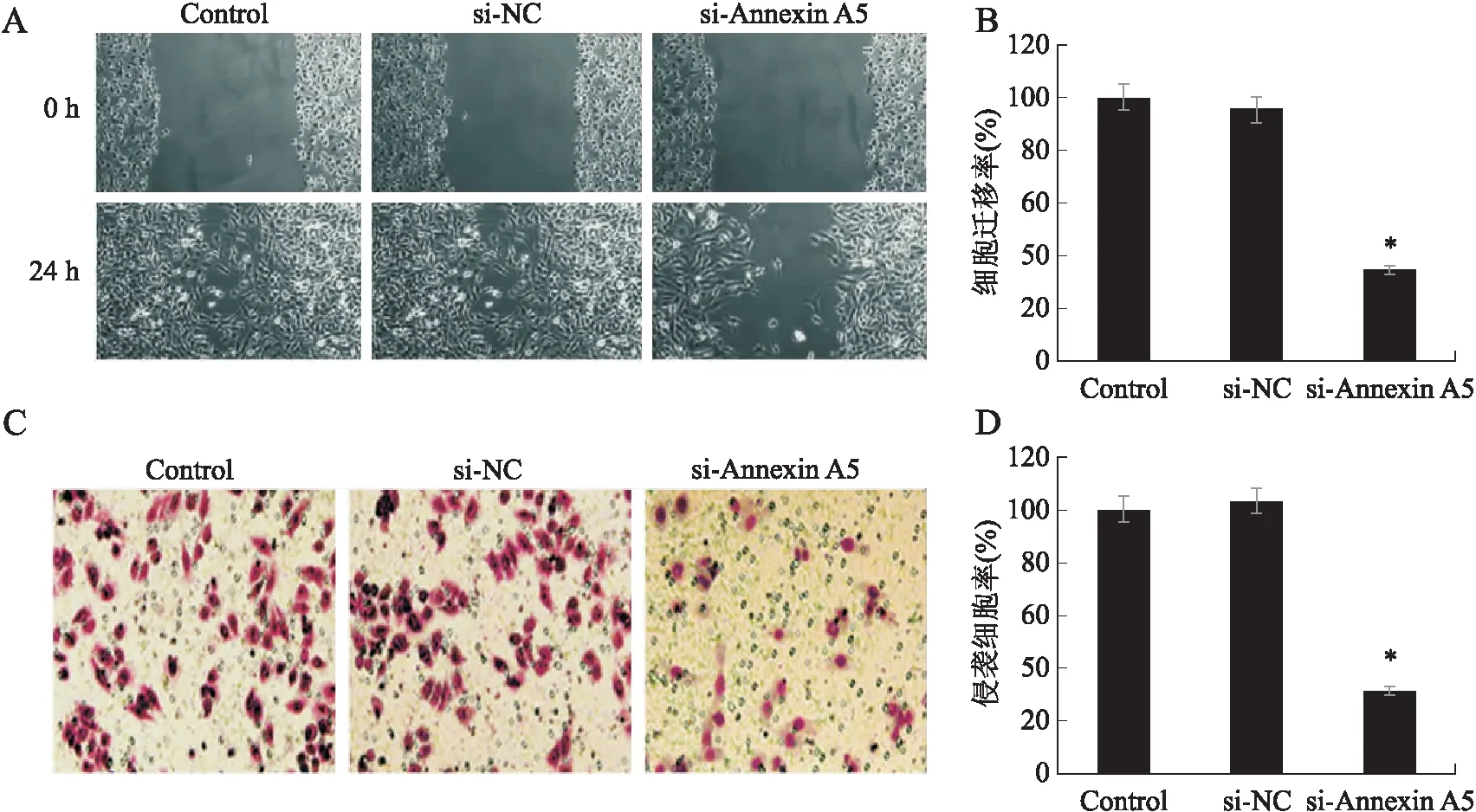
图5 下调膜联蛋白A5对U251细胞迁移和侵袭的影响Fig.5 The effect of downregulation of Annexin A5 on migration and invasion of U251 cellsA、B:伤口愈合实验;C、D:侵袭实验。与对照组(Control)相比,*P<0.001。
2.6 膜联蛋白A5对Raf/MEK/ERK信号通路及下游分子的影响蛋白印迹分析显示,各组间的p-Raf(F=198.240,P<0.001)、p-MEK1/2(F=237.956,P<0.001)、p-ERK1/2(F=194.218,P<0.001)和c-Myc(F=225.886,P<0.001)的蛋白表达有统计学差异;与对照组相比,si-Annexin A5组的p-Raf、p-MEK1/2、p-ERK1/2和c-Myc的蛋白表达均明显降低(依次降低了54.67%、70.37%、60.26%、54.95%),而E-Cadherin的蛋白表达水平升高了3.58倍(F=205.842,P<0.001,图6)。
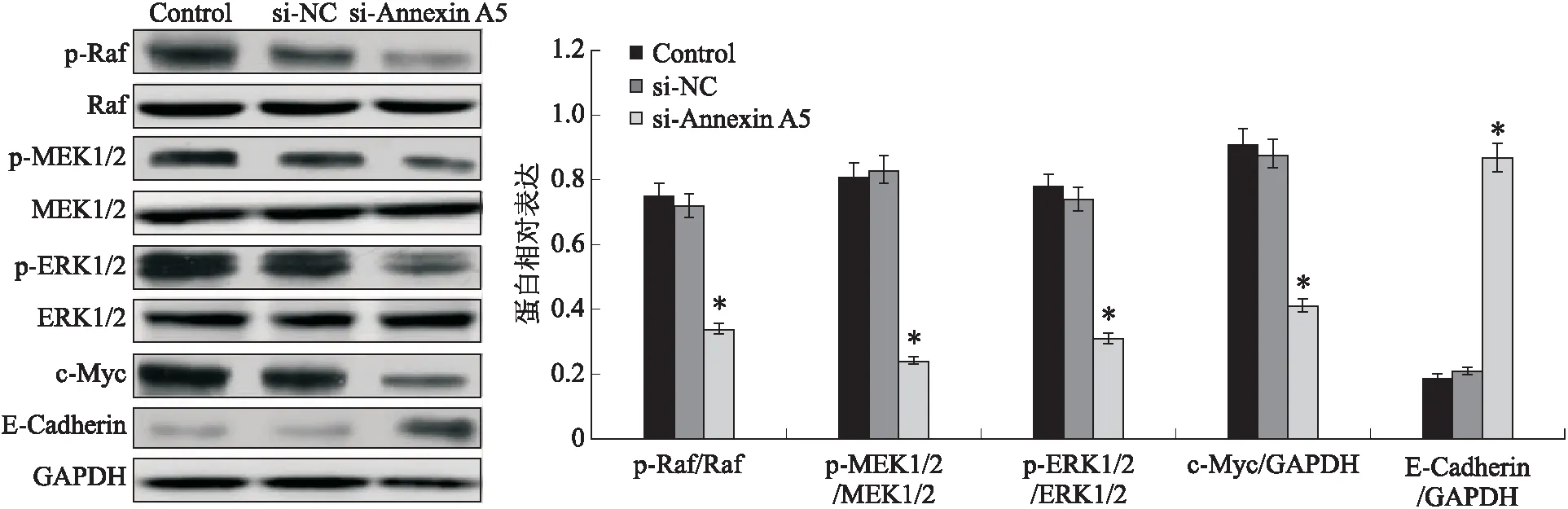
图6 下调膜联蛋白A5对U251细胞中p-Raf、Raf、p-MEK1/2、MEK1/2、p-ERK1/2、ERK1/2、c-Myc和E-Cadherin蛋白表达的影响Fig.6 The effect of downregulation of Annexin A5 on the protein expressions of p-Raf, Raf, p-MEK1/2, MEK1/2, p-ERK1/2, ERK1/2, c-Myc and E-Cadherin in U251 cells与对照组(Control)相比,*P<0.001。
3 讨 论
癌细胞的生长、转移、侵袭和耐药性等生物学活性受到多种功能蛋白的调控。膜联蛋白是一组具有以Ca2+依赖性方式与负电荷磷脂结合的胞质可溶性蛋白[7-8]。已证明膜联蛋白成员参与多种功能,包括细胞凋亡、膜修复过程、Ca2+通道形成、膜与细胞骨架的连接等。作为一种主要的细胞内Ca2+结合蛋白,膜联蛋白A5在许多类型的肿瘤中参与调控细胞周期、细胞增殖和侵袭[9-10]。研究发现,膜联蛋白A5在大多数肿瘤中均表现出上调,包括肝癌、乳腺癌、子宫颈癌、大肠腺癌、胃癌、胰腺癌、膀胱癌、鼻咽癌、前列腺癌、神经胶质瘤、甲状腺癌等,并且有助于肿瘤的进展、侵袭、转移和耐药性[11]。据报道,恶性神经胶质瘤的预后较差,平均生存时间为12~14个月。但是,尚未完全阐明膜联蛋白A5对神经胶质瘤细胞迁移和侵袭的影响及潜在机制。因此,本研究初步探讨了神经胶质瘤侵袭和转移的分子机制。
本研究发现,神经胶质瘤组织和细胞系中的膜联蛋白A5的表达水平明显上调。此外,本研究还考察了不同等级的神经胶质瘤组织中膜联蛋白A5的表达,发现随着神经胶质瘤级别的升高,膜联蛋白A5的表达水平也明显上调,并且两者具有正相关性。说明膜联蛋白A5参与胶质瘤的发生发展,并且与患者的预后有关。
有研究报道,膜联蛋白A5可增强多种恶性肿瘤的耐药性,并且也可以直接参与对肿瘤细胞凋亡的调控[12]。本研究通过对人神经胶质瘤细胞系(U251)转染靶向膜联蛋白A5的miRNA以下调细胞中膜联蛋白A5,研究发现,下调膜联蛋白A5明显抑制了U251细胞的增殖并诱导了细胞凋亡。另外,神经胶质瘤的转移性与血管生成和细胞侵袭能力密切相关。膜联蛋白A5在非血管生成肿瘤中平均增加2.1倍,在血管生成肿瘤中平均增加3.4倍[13]。本研究发现,下调膜联蛋白A5明显抑制了U251细胞的迁移和侵袭能力。提示胶质瘤的生长和转移与膜联蛋白A5的高表达具有直接关联。
膜联蛋白A5可能通过细胞间信号转导在血管生成性肿瘤中发挥功能,并可能增强肿瘤细胞之间或肿瘤与宿主细胞之间的串扰。膜联蛋白A5通过诱导新血管和促进肿瘤生长,增强肿瘤与宿主之间的相互作用,可能会导致血管生成表型肿瘤更好地适应其微环境。Raf/MEK/ERK信号通路在肿瘤细胞的生长和运动中具有重要作用[14-16]。本研究检测了Raf/MEK/ERK信号通路及下游关键分子的表达,发现下调膜联蛋白A5明显抑制了胶质瘤细胞中Raf、MEK1/2和ERK1/2的磷酸化,说明膜联蛋白A5表达下调抑制了Raf/MEK/ERK信号通路的活性。
本研究还检测了神经胶质瘤细胞中c-Myc 和E-Cadherin的表达。已知c-Myc转录因子是由c-Myc原癌基因编码的蛋白质[17],c-Myc通过与启动子和增强子结合而调控基因转录,进而调节细胞增殖[18]。沉默c-Myc可明显抑制癌细胞株增殖[19]。本研究发现,下调膜联蛋白A5抑制了胶质瘤细胞中c-Myc的表达。由于 c-Myc是Raf/MEK/ERK信号通路的下游效应分子,因此,膜联蛋白A5可能通过Raf/MEK/ERK/c-Myc通路调控胶质瘤细胞的增殖。E-Cadherin是介导细胞与细胞间黏附的Ca2+依赖的黏附分子,而细胞间连接结构的破坏是肿瘤细胞转移的重要事件,E-Cadherin的下调可导致肿瘤细胞间连接作用减弱,从而导致肿瘤细胞更容易从肿瘤组织中脱离[20-21]。因此,E-Cadherin的丧失可促进肿瘤细胞的迁移和侵袭[22]。本研究发现,下调膜联蛋白A5明显升高了胶质瘤细胞中E-Cadherin的表达。有研究报道, E-Cadherin是ERK信号通路的下游靶标,并且参与调控乳腺癌细胞的迁移[23]。因此,本研究推测,膜联蛋白A5可能通过Raf/MEK/ERK/E-Cadherin通路调控神经胶质瘤细胞的迁移和侵袭能力。
综上所述,本研究表明,膜联蛋白A5在神经胶质瘤组织和细胞中异常高表达,并且与肿瘤级别有关,下调膜联蛋白A5可明显抑制胶质瘤细胞的生长和运动能力,并诱导细胞凋亡。此外,下调膜联蛋白A5明显抑制Raf/MEK/ERK信号通路及下游分子c-Myc和E-Cadherin的表达。本研究推测,膜联蛋白A5可能部分通过调控Raf/MEK/ERK信号通路在神经胶质瘤细胞中发挥病理生理作用。总之,靶向膜联蛋白A5进行神经胶质瘤治疗,将具有较高的潜在应用价值。

