鸡源鸭疫里默杆菌的分离鉴定及ompA基因遗传进化分析
李富祥,赵文华,宋建领,朱建波,杨仕标
(云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
里默杆菌属于黄杆菌纲(Flavobacteriia)、黄杆菌目(Flavobacteriaceae)、黄杆菌科(Flavobacteriales)、里默杆菌属(Riemerella),该属包括鸭疫里默杆菌(Riemerellaanatipestifer,RA)和鸽里默杆菌(Riemerellacolumbina,RC)、鸽咽喉里默杆菌(Riemerellacolumbipharyngis)3个种。其中,RA呈世界性分布,主要感染鸭,鹅、火鸡和其他鸟类感染较少见[1-2],鸡RA感染十分罕见[3]。RA感染又称新鸭病、鸭败血症、鸭疫综合征、鸭疫败血症和传染性浆膜炎,该病广泛分布于世界各国。我国郭玉璞等[4]于1982年首次分离到鸭源RA,之后诸多省份均有RA感的报道,给养鸭业造成严重的经济损失。近年来,我国福建[5]、江苏[6]和广东[7-8]等省份均有鹅源RA分离鉴定的报道。到目前为止,未见我国鸡源RA分离鉴定的报道。
2020年1月,云南省昆明市某养鸡场仔鸡(铁脚麻)发生一种临床症状以精神沉郁、呼吸困难、咳嗽、打喷嚏、鼻腔有大量黏液性分泌物为特征,病理变化以严重腹水、心包炎和肝周炎为特征的病例。该病发病率为15.0%,病死率为46.7%,给养殖场造成较大的经济损失。为查明病因,我们对该病例进行细菌学诊断,从病死鸡肝脏分离到8株革兰阴性多形杆菌,经形态学和16S rDNA分析鉴定为RA。本试验还对8株鸡源RA分离株ompA基因(outer membrane protein A gene,ompA)及其推导的蛋白(outer membrane protein A,OmpA)序列遗传进化特征进行分析,为我国鸡源RA感染的防制研究提供参考。
1 材料与方法
1.1 主要试剂营养琼脂、麦康凯琼脂购自北京奥博星生物技术有限公司;细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;2×EasyTaq PCR SuperMix和Trans 2k DNA Marker购自北京全式金生物技术有限公司;青霉素、阿莫西林克拉维酸钾、头孢噻吩、头孢克罗、头孢噻肟、卡那霉素片、庆大霉素、氧氟沙星、磺胺甲噁唑药敏纸片购自北京天坛药物生物技术开发公司;氟苯尼考药敏纸片购自英国OXOID公司。
1.2 菌株10株云南鸭源RA分离株RA-1、RA-2、RA-3、RA-10、RA-22、RA-23、RA-33、RA-36、RA-37和RA-39由云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室保藏。
1.3 引物设计细菌16S rDNA上游引物27F(A) 和下游引物1492R(T)按参考文献[9]设计;ompA基因上游引物Pf和下游引物Pr按参考文献[10]设计;2对引物均由北京擎科生物科技有限公司昆明分公司合成。
1.4 病理剖检将病死鸡剖检,观察心脏、肝脏、脾脏、肺脏、输卵管等病理变化,同时采集肝脏样品,4℃ 保存,用于细菌分离鉴定。
1.5 细菌分离取肝脏划线接种营养琼脂平板,37℃、5%CO2培养过夜,挑单菌落进行纯培养,挑取菌落制作涂片,革兰染色镜检,观察菌体形态。同时将分离株接种麦康凯琼脂平板,37℃、5%CO2培养过夜,观察生长特性。
1.6 16S rDNA和ompA基因测序用细菌基因组提取试剂盒分别提取各鸡源分离株以及10株云南鸭源RA分离株RA-1、RA-2、RA-3、RA-10、RA-22、RA-23、RA-33、RA-36、RA-37和RA-39的基因组DNA作为模板,采用引物27F和1492R PCR扩增16S rDNA基因,采用引物Pf和Pr PCR扩增ompA基因。PCR反应条件均为:94℃预变性3 min;94℃ 30 s,57℃ 30 s,72℃ 30 s,35个循环;72℃延伸5 min。扩增产物经1.2%琼脂糖凝胶电泳鉴定正确后,送北京擎科生物科技有限公司昆明分公司测序,提交GenBank数据库获得基因收录号。
1.7 16S rDNA进化分析将8株鸡源RA分离株16S rDNA基因在GenBank数据库中进行Blust比对,并下载不同国家和地区、不同分离源动物(鸭和鹅)参考株的基因序列共28个,用Clustal_X 1.83软件进行多序列比对分析,用MEGA 4.0.2软件构建系统进化树(Neighbor-Joining方法,bootstrap values值设定为1 000),选择黄杆菌科模式菌株Flavobacterium aquatile LMG4008作为进化树的外群。用DNAStar软件包中的MegAlign软件进行核苷酸序列比对,分析16S rDNA基因的同源性。
1.8ompA基因进化分析将8株鸡源RA分离株ompA基因在GenBank数据库中进行Blust比对,并下载不同国家和地区、不同分离源动物(鸭和鹅)参考株的基因序列共28个,用Clustal_X 1.83软件进行多序列比对分析,用MEGA 4.0.2软件构建系统进化树(Neighbor-Joining方法,bootstrap values值设定为1 000)。用DNAStar软件包中的MegAlign软件进行核苷酸序列比对,分析ompA基因的同源性。
1.9 OmpA蛋白序列进化分析用DNAstar软件包中的EditSeq软件将8株鸡源RA分离株ompA基因序列推导为蛋白序列,将鸡源分离株OmpA蛋白序列在GenBank数据库中进行Blust比对,并下载不同国家和地区、不同分离源动物(鸭和鹅)参考株的基因序列共27个,用Clustal_X 1.83软件进行多序列比对分析,用MEGA 4.0.2软件构建系统进化树(Neighbor-Joining方法,bootstrap values值设定为1 000)。用DNAStar软件包中的MegAlign软件进行蛋白序列比对,分析OmpA蛋白的同源性。
1.10 药敏试验参考文献[11]和 CLSI20015 推荐的 Kirby- Bauer方法,测定各分离株对10种抗菌药物的敏感性。
2 结果
2.1 病理剖检将病死鸡剖检,可见全部8只病死鸡病理变化一致,均表现为腹部膨大,内有大量淡黄色浆液;心包膜表面有大量淡黄色纤维蛋白附着;肝脏表面有大量淡黄色纤维蛋白附着(图1)。
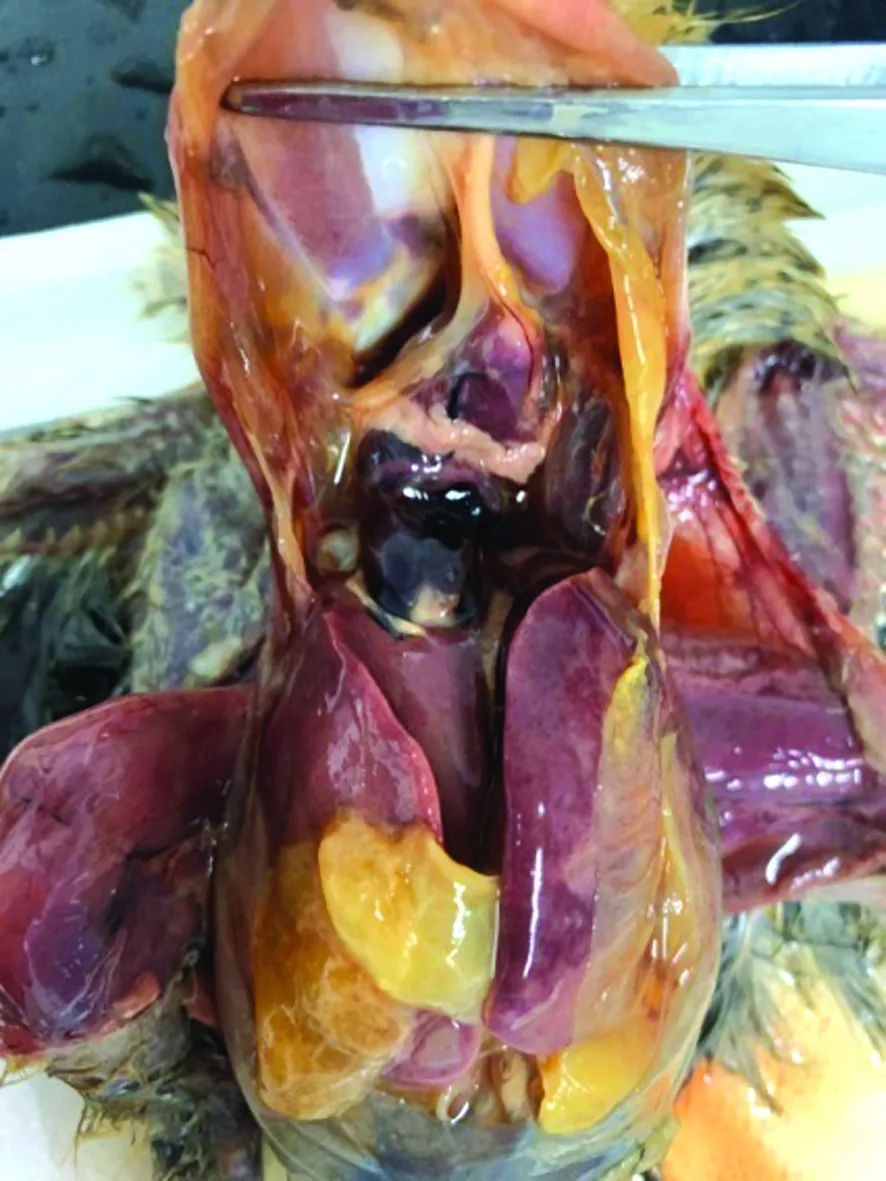
图1 心包膜和肝脏表面有大量纤维蛋白附着
2.2 细菌分离8份鸡肝脏病料分别划线接种营养琼脂,37℃培养过夜后,均长出大量纯粹灰白色中等大小菌落,菌落凸起、湿润、光滑、边缘整齐。分别挑单菌落纯培养后分离到8株鸡源细菌,编号分别为RA-20011、RA-20012、RA-20013、RA-20014、RA-20015、RA-20016、RA-20017和RA-20018,8株分离株革兰染色均呈阴性多形杆菌(图2)。8株鸡源分离株在麦康凯琼脂上均不生长。

图2 分离株革兰染色形态(1 000×)
2.3 16S rDNA和ompA基因测序8株鸡源分离株16S rDNA基因和ompA基因的PCR产物琼脂糖凝胶电泳分别得到约为1 500 bp,和1 200 bp的条带,与预期的1 500,1 154 bp相符,鉴定正确。将PCR产物进行测序,序列提交GenBank数据库获得基因登录号。8株鸡源分离株16S rDNA基因登录号分别为MT367923~MT367930,ompA基因登录号分别为MT380216~MT380223。9株云南鸭源RA分离株(RA-23基因序列未提交)16S rDNA基因登录号分别为MT367914~MT367922,10株云南鸭源RA分离株ompA基因登录号分别为MT380206~MT380215。
2.4 16S rDNA进化分析系统进化树显示,8株鸡源分离株与22株RA参考株形成一个大的进化分支(图3),8株鸡源分离株与22株RA参考株之间的同源性为98.8%~100.0%,与RA模式菌株ATCC11845之间的同源性为99.3%~99.8%。8株分离株形成一个小的进化分支(图3),之间的同源性为99.7%~100.0%。3株R.columbipharyngis形成第2个大的进化分支(图3)。3株R.columbina形成第3个大的进化分支(图3)。8株鸡源分离株与R.columbipharyngis和R.columbina分离株间的同源性为96.3%~96.4%。进化分析表明,8株鸡源分离株与RA模式菌株ATCC11845以及其他RA参考株之间的遗传进化关系最近,与R.columbipharyngis和R.columbina分离株遗传进化关系较远,将8株分离株鉴定为RA。

图3 16S rDNA系统进化树
2.5ompA基因进化分析系统进化树显示,8株鸡源RA分离株与3株印度鸭源分离株KML1、KML2、KML3以及1株中国台湾地区鹅源分离株KS9901-G形成一个大的进化分支(图4),与KML1、KML2、KML3、KS9901-G之间的同源性为94.0%~99.6%,其遗传进化关系最近。8株鸡源RA分离株形成一个独立的小进化分支(图4),之间的同源性为100%。其他19株鸭源RA和5株鹅源RA分离株形成另一个大的进化分支(图4),与8株鸡源RA分离株之间的同源性为88.1%~93.6%,与8株鸡源RA分离株间的遗传进化关系较远。与模式菌株ATCC11845相比较,8株鸡源RA分离株ompA基因均发生99个核苷酸位点的突变。
2.6 OmpA蛋白序列进化分析系统进化树显示,8株鸡源RA分离株形成第1个大的进化分支(图5),之间的同源性为100%。3株印度鸭源分离株KML1、KML2和KML3形成第2个大的进化分支(图5),之间同源性为96.0%~99.7%。1株中国台湾地区鹅源分离株KS9901-G形成第2个独立大的进化分支(图5)。其他RA参考株形成第4个大的进化分支(图5),之间的同源性为92.3%~100%。8株鸡源RA分离株与鸭源分离株之间的同源性为90.6%~96.9%,与鹅源分离株之间的同源性为92.3%~99.4%,其中与鹅源分离株KS9901-G之间的同源性为99.4%,遗传进化关系最近。与RA模式菌株ATCC11845相比较,8株鸡源RA分离株OmpA蛋白均发生19个核苷酸位点的突变。
2.7 药敏试验药敏试验结果显示,8株鸡源RA分离株对青霉素、阿莫西林克拉维酸钾、头孢噻吩、头孢克罗、头孢噻肟、卡那霉素片、庆大霉素、氧氟沙星、磺胺甲噁唑和氟苯尼考均敏感。
3 讨论
RA病呈世界分布,严重危害养鸭业的发展。鹅RA感染时有报道,鸡RA感染报道十分罕见。

图4 ompA基因系统进化树
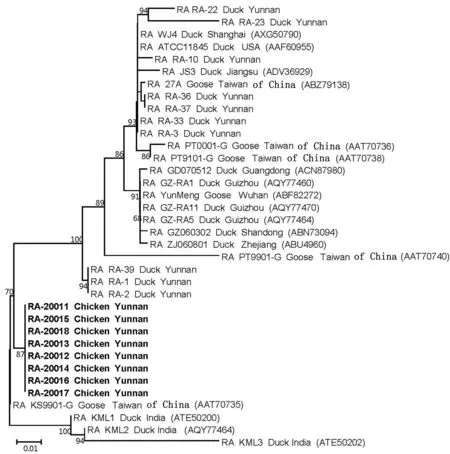
图5 OmpA蛋白系统进化树
病鸭和病鹅病理特征是纤维素性心包炎、肝周炎、气囊炎、干酪性输卵管炎和脑膜炎。本研究从一起纤维素性心包炎、肝周炎和严重腹水鸡病例中分离到RA,证实了我国鸡RA感染的存在。本研究中鸡病例纤维素性心包炎、肝周炎病理特征与鸭、鹅鸭疫RA感染的病理特征相似,但在本试验鸡病例中,约80%病鸡还表现出了严重的腹水病理特征,此特征与鸭和鹅鸭疫RA感染的病理特征不同。本研究中的8株鸡源RA(RA-20011、RA-20012、RA-20013、RA-20014、RA-20015、RA-20016、RA-20017和RA-20018)能够自然感染鸡,导致浆膜炎特征病变和死亡,可能与分离株的宿主嗜性发生改变相关。本试验在我国分离到鸡源RA,并系统报道鸡源RA自然感染的临床症状和病理变化特征,以及鸡源RA的培养特性、菌体形态特征和药物敏感性。8株鸡源RA分离株对阿莫西林克拉维酸钾、头孢噻吩等10种抗菌药物敏感,选择阿莫西林克拉维酸钾对该起病例进行治疗,效果良好。
16S rDNA基因鉴定试验中,8株鸡源RA分离株与其他全部22株RA参考株形成第1个大的进化分支,8株鸡源分离株与22株RA参考株之间的同源性为98.8%~100.0%,与RA模式菌株ATCC11845之间的同源性为99.3%~99.8%;另外16S rDNA基因Blust比较结果显示,8株鸡源分离株与全部100株RA参考株间的同源性为99.3%~99.9%,具有很高的同源性,16S rDNA基因分析数据结合分离株的菌落、菌体形态学特征,最终将8株分离株鉴定为RA。
ompA基因Blust比较结果显示,8株鸡源RA分离株与3株印度鸭源分离株KML1、KML2 KML3以及1株我国台湾鹅源分离株KS9901-G之间的同源性为97.9%~99.7%,与其他RA参考株间的同源性均小于94%。进化分析显示,8株鸡源RA分离株与3株印度鸭源分离株KML1、KML2 KML3以及1株我国台湾地区鹅源分离株KS9901-G形成一个大的进化分支,与KML1、KML2 KML3、KS9901-G之间的同源性为94.0%~99.6%,其遗传进化关系最近。由此推测RAompA基因进化与分离来源地域(印度、中国大陆、中国台湾地区)和宿主种类(鸡、鸭、鹅)无相关性,此结论与参考文献[12] 的报道相一致。
OmpA蛋白Blust比较结果显示,8株鸡源RA分离株与1株我国台湾地区鹅源分离株KS9901-G之间的同源性为99.7%,与其他RA参考株间的同源性均小于97%。进化分析显示,4株中国台湾地区鹅源RA分离株27A、PT0001-G、PT9101和PT9901位于第4个大的进化分支中,而另1株中国台湾地区鹅源分离株KS9901-G位于第3个大的进化分支中,由此推测RA OmpA蛋白进化与分离来源地域不具有相关性,此结论与参考文献[12] 的报道相一致。8株鸡源RA分离株形成一个独立的大的进化分支,由此推测RA OmpA蛋白进化与宿主种类(鸡、鸭、鹅)具有一定的相关性,此结论与参考文献[12] 的报道相一致,其原因可能是由于参考文献[12]的OmpA蛋白进化分析所用菌株仅包括鸭源和鹅源RA分离株,不包含鸡源RA分离株。

