河北省猪场伪狂犬病病毒感染情况调查及gE基因遗传变异分析
左玉柱,王丙雷,韩 磊,王 晶,袁广富,张建楼,范京惠*,仲 飞1,*
(1.河北农业大学 动物科技学院,河北 保定 071001;2.河北农业大学 动物医学学院,河北 保定 071001)
伪狂犬病(pseudorabies,PR)又称奥耶斯基病,该病的病原为伪狂犬病病毒(pseudorabies virus,PRV),是一种严重危害全球养猪业健康发展的病毒性传染病。PRV属于猪疱疹病毒Ⅰ型[1-2]。PRV宿主范围较广,可感染反刍动物、肉食动物、啮齿动物和猪等多种哺乳动物,其中猪为PRV的自然宿主,也是唯一的贮存宿主[3-5]。PRV感染猪后,引起母猪繁殖障碍,表现为流产、死胎、木乃伊胎、不育等;新生仔猪则主要引起脑脊髓炎,表现为神经症状和呼吸困难,死亡率高;育肥猪和成年猪对PRV 有一定的抵抗力,死亡率低,但耐过猪易感染其他疾病,且长期携带毒并排毒,成为新的传染源[2-3,6-8]。由PRV引起的猪伪狂犬病,在我国以及养猪密度较大的一些国家和地区广泛传播,给发病猪场造成了严重的经济损失[2,5,7,9]。
疫苗免疫在伪狂犬病的防制过程中起到了至关重要的作用。基因缺失活疫苗(如gE缺失疫苗等)在猪场的广泛应用,有效降低了该病的发病率和死亡率,减少了猪场的经济损失[2-3]。然而,自2011年中国出现毒力增强的PRV变异株以来,伪狂犬病在疫苗免疫猪场的不断暴发,一些PRV阳性猪场的持续感染,以及一些猪场由PRV 阴性转为PRV阳性的现状,又给我国PRV防控带来了新的挑战,也使伪狂犬病被列为《国家中长期动物疫病防治规划(2012-2020 年)》中优先防治的动物疫病之一[10]。实现对PRV 的有效防制和根除,掌握PRV在猪群中感染情况的详尽数据是必不可少的环节。然而,目前有关河北省PRV 流行病学方面的信息却十分有限,为了了解PRV野毒毒株在河北省猪场的感染情况,本试验对河北省猪场开展了血清学和病原学的调查,并对流行毒株的gE基因进行了分析,以探明河北省猪场PRV感染程度和gE基因变异状况,为河北省PRV的防制提供一定的数据支持。
1 材料与方法
1.1 血清和病料血清来自河北省不同地区、不同规模猪场中不同生长阶段的猪,病料来源于流产胎儿的脑、脾脏和淋巴结。
1.2 主要试剂与仪器PRV-gE抗体检测试剂盒,购自IDEXX公司;PRVV gE基因PCR检测试剂盒,购自北京世纪元亨有限公司;DNA提取试剂盒、PCR产物纯化试剂盒、pMD19-T载体购自宝生物工程(大连)有限公司;PK-15由本实验室保存;Eagle培养基(DMEM)、10%胎牛血清(FBS)购自美国Gibco公司;Heal Force Neofuge 13R 台式高速冷冻离心机、Thermo 酶标仪,美国赛默飞公司产品;单通道移液器及多通道移液器(5~50 μL)购自大龙兴创实验仪器(北京)有限公司。
1.3 引物设计根据GenBank上登录的序列,利用Primer 5.0 设计合成了1对特异性扩增PRV gE基因的引物(表1)。
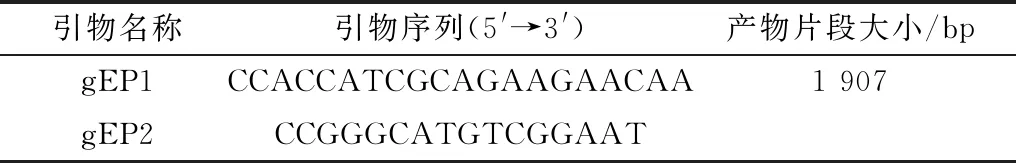
表1 引物序列及产物片段大小
1.4 血样采集和处理猪血清来源于河北省不同地区、不同规模的猪场,按照妊娠母猪、哺乳母猪、空怀母猪、后备母猪、公猪、仔猪(2,3,4,7周龄)和育肥猪(11,17 周龄)等分阶段采血;根据猪场母猪存栏数不同,将猪场分为50头母猪以下、50~300 头、300~800 头、800 头等4类(存栏头数均含下限不包括上限),50头母猪以下者每组采集血样4份,50~300头母猪的猪场,每组采集5份,300~800头母猪的猪场,每组采集血样6份,800头母猪以上者,每组采集8份。选择猪场过程中,如个别猪场个别阶段猪数量不够采样要求,按实际数量进行。每份血样采集3~4 mL,离心后取血清,-80℃冻存备用。
1.5 PRV gE抗体的检测操作方法严格按照美国IDEXX公司的PRV-gE抗体检测试剂盒说明书进行。所有加样和洗板过程均在室温进行,加样后的ELISA板置于恒温箱22.5℃反应。所有反应结束后,使用酶标仪测定各孔的D650 nm值。通过计算样品与阴性对照的比值(S/N),判断样品中PRV野毒株抗体阴阳性。结果判定标准:当S/N≤0.6时,样品确定为阳性;S/N>0.7,样品确定为阴性;0.6
1.6 流产胎儿中PRV的检测从河北省发生流产的猪场采集病料,主要收集流产的胎儿。将流产胎儿的脑、脾脏和淋巴结混合后研磨,离心取上清,使用PCR gE检测试剂盒(anheal,中国北京)检测,操作步骤按试剂盒说明书进行。
1.7 部分猪场PRV gE基因的扩增取PRV PCR检测结果为阳性的材料,按照DNA提取试剂盒的操作说明进行基因组DNA的提取,并以提取的DNA作为模板,使用引物gEP1和gEP2,通过PCR扩增PRV的gE全基因。PCR扩增体系为20 μL:2×GC Buffer 10 μL,2.5 mmol/L dNTP Mixture 3 μL,20 μmol/L 上、下游引物各 1 μL,DNA模板 3.5 μL,rTaq酶 0.5 μL。PCR反应条件:94℃预变性5 min;94℃变性1 min,59℃退火1 min,72℃延伸 2 min,35个循环;72℃延伸10 min。反应结束后,取10 μL PCR产物, 1.0%琼脂糖凝胶电泳。
1.8 序列测序gE基因的PCR产物经1.0%琼脂糖凝胶电泳后,回收目的条带,并使用胶回收纯化试剂盒进行纯化。纯化后的产物送生工生物工程(上海)有限公司(Sangon Biotech,中国上海)进行序列测定。
1.9 基因遗传进化分析从GenBank内查找PRV gE基因核苷酸序列,筛选部分序列作为参考毒株序列,使用MEGA 7.0软件中的Crustal W程序对测序序列和参考序列进行比对分析,并使用MEGA 7.0软件通过近Neighbor-Joining方法构建10 000个自举复制的系统进化树。
2 结果
2.1 血清样品收集情况2018年1月至2019年5月共17个月的时间内,从195个猪场采集血样,其中2018年130个猪场,2019年1-5月猪场65个。存栏50头母猪以下的猪场90个,50~300 头母猪的猪场60个,存栏300~800 头母猪的猪场30个,存栏800头母猪以上的猪场15个,每组按照预定方案采取样品,部分规模小的猪场空怀母猪和公猪少于预计数量,按实际采血份数计算。有效血样共计10 479 份,血样具体分布见表2。
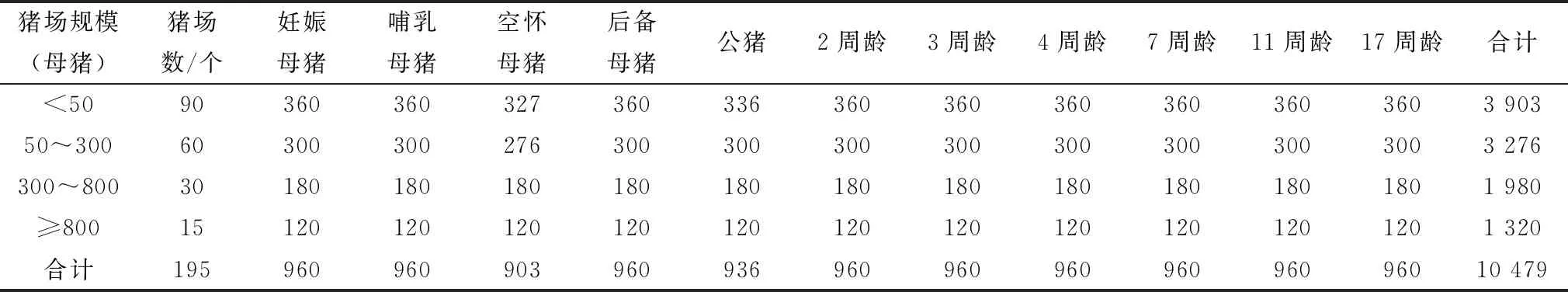
表2 血样采集信息 头
2.2 gE抗体检测结果
2.2.1不同阶段猪血清gE抗体阳性率 在收集的10 479份血清样品中,gE抗体阳性5 245份(其中含 42 份可疑血清,为方便统计,将可疑血样归入阳性样品统计),样本总的阳性率为50.05%。按照猪不同阶段进行分类统计,结果见图1。种猪群中阳性率最高的是空怀母猪,为73.75%%;阳性率最低的是公猪群,为33.01%。在仔猪、保育和育肥猪群,2周龄仔猪阳性率最高,为57.50%;7周龄猪抗体阳性率最低,为22.92%;但是7周龄之后,11周龄和17周龄猪的抗体阳性率呈上升趋势,17周龄时抗体阳性率为55.73%。2018年与2019年血清gE抗体阳性率相比,2019年1-5月各阶段血清gE抗体阳性率比2018年均有明显降低。
2.2.2不同规模猪场gE抗体阳性率 对检测结果按照不同规模的猪场进行血清阳性率统计,结果显示,随着规模化程度的增加,gE抗体阳性比例整体呈下降趋势。但存栏50~300头母猪的猪场野毒抗体阳性率最高,为57.60%;存栏800头母猪以上的猪场,血清gE抗体阳性率最低,为35.68%(图2)。
2.2.3不同规模猪场场群阳性率 对场群阳性率进行统计,结果显示195个猪场中,存在阳性血样的猪场161个,猪场总阳性率为82.56%;其中,50~300头母猪的60个猪场中,53个猪场存在阳性血样,阳性率最高,达88.33%;15个超过800头母猪的规模化猪场中也有10个猪场存在阳性血清,阳性率为66.67%(图3)。
2.2.4不同地区猪场血清gE抗体阳性率 对河北省不同地区阳性率进行统计,结果显示邢台市猪场血清gE抗体阳性率最高,为58.26%;张家口猪场和承德市猪场gE抗体阳性率较低,分别为34.37%和42.57%(图4)。
2.3 流产胎儿中PRV gE基因的检测2018-2019年从河北省76个发生流产的猪场共收集到流产胎儿204个,使用PRV gE基因PCR检测试剂盒对其进行PRV检测,结果显示54个胎儿gE基因检测结果为阳性,整体阳性率26.47%;按照不同规模的猪场进行阳性率统计,结果发现50~300 头规模猪场的流产胎儿PRV阳性率最高,为31.43%;800头以上的猪场阳性率最低,为22.73%(图5)。
2.4 gE全基因扩增和序列测定从PCR检测PRV gE基因呈阳性的病料中选择部分材料,进行gE全基因的扩增。扩增产物经过1.0%的琼脂糖凝胶电泳,在1 900 bp处出现目的条带,与gE基因扩增产物预期大小相符者为阳性。使用凝胶回收试剂盒对产物进行回收纯化,共获得gE全基因阳性产物9份,送生工生物工程(上海)有限公司进行序列测定,由于gE基因GC含量高,有1份重复测序3次未成功,共获得gE全基因序列8份。
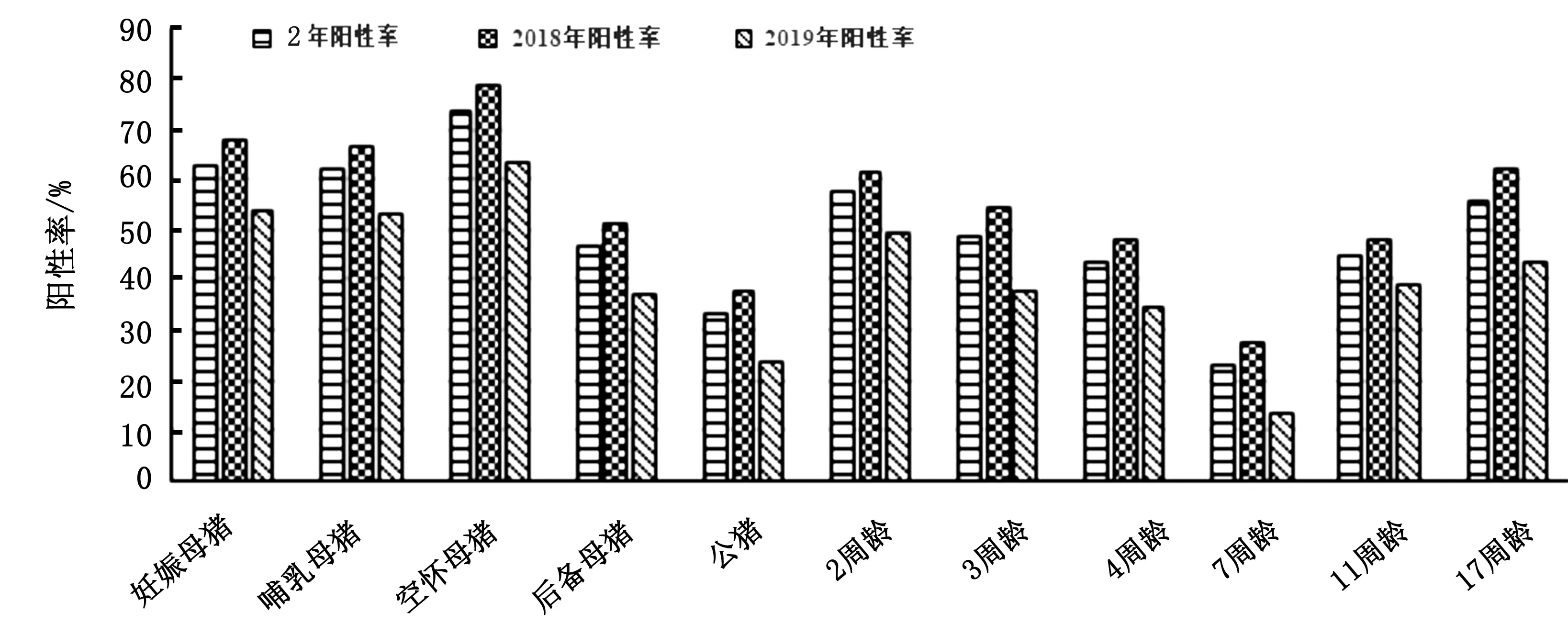
图1 不同阶段猪血清中gE抗体阳性率

图2 不同规模猪场之间猪血清中gE抗体阳性率比较

图3 不同规模猪场场群阳性率比较

图4 河北省不同地区猪场猪血清中gE抗体阳性率
2.5 gE基因遗传进化分析本试验中获得的8个gE全基因序列之间,核苷酸同源性为99.8%~100.0%,与国内外其他参考毒株的核苷酸同源性为97.5%~100.0%。核苷酸进化树分析结果显示(图6),包括本试验获得的8个gE基因在内的47个PRV gE基因序列被分为2个基因型,欧美毒株属于基因Ⅰ型,中国毒株属于Ⅱ型,国内的毒株整体上又分为2个亚群,其中2011年之前的毒株大部分属于SⅠ亚群,2011年之后的大部分属于SⅡ亚群,这与2011年以后,中国出现PRV的变异株,且变异株在中国猪场不断暴发的现状想吻合,本试验中所获得的8株PRV均属于SⅡ亚群。

▲.本次试验所得到的序列;●.本实验室2012年获得的序列
3 讨论
伪狂犬病是危害全球养猪业的重要传染病,给感染猪场造成了巨大的经济损失[2-3]。在伪狂犬的防控过程中,我国普遍使用的是PRV基因缺失疫苗。尽管目前所使用的基因缺失疫苗有多种,但基本都缺失了gE基因,因此免疫了PRV基因缺失疫苗的猪场,如果不存在PRV野毒感染,PRV gE抗体应该为阴性。当感染PRV野毒时,gE抗体则为阳性。对gE抗体进行检测,可用于区分感染动物和免疫动物。欧洲和北美一些国家已经通过gE基因缺失疫苗的强制免疫、以及与之相匹配的野毒毒株gE基因/抗体检测,掌握PRV在猪群中的感染情况,淘汰阳性猪等方式,实现了PRV 的净化[2,3,10]。这为我国PRV的防控和净化措施提供了参考。
近几年,国内不同省份和地区的调查结果显示,gE抗体个体阳性率在全国的数量逐渐下降,但场群阳性率仍然很高[11-16]。李桂霞等[17]对2018 年11月1日至11月20日,从河北省8个地区不同中小型规模猪场采集的481份母猪血液进行PR-gE 抗体的检测,结果显示样本总阳性率为40.96%(197/481),且不同地区的差异很大。但该研究所检测样本所涵盖的时间段较短(仅 20 d),且采集的样本数较少,因此,尚不能有效反映河北省PRV感染的总体情况。程龙等[18]进行邯郸地区猪繁殖障碍病血清学调查时,对2019年从邯郸地区26个猪场采集的864份血清进行了gE抗体检测,结果显示342份呈现阳性,样本阳性率为39.6%。26个猪场中,仅有3个为gE抗体阴性,场群阳性率为88.5%(23/26),且23个阳性猪场的猪只感染情况差异很大,gE 抗体阳性率为25%~79%。本研究对来源于河北省195个不同规模猪场的10 479份血样进行了GE抗体的检测和分析,结果显示血清阳性率为50.05%,对不同地区的统计结果显示,所检测的11个地市均有不同程度的感染,其中邢台地区的阳性率最高,这与李桂霞等[17]检测的结果相一致。对不同阶段猪群进行检测,发现种猪群空怀母猪的gE抗体阳性率达到73.75%,由于本研究未对其他病原进行检测,因此,仅凭这一个指标,尚不能直接说明母猪空怀就是由PRV引起,但是由于空怀母猪gE抗体的高阳性率,可以推测PRV感染在一定程度上导致了空怀率的升高。另外,本研究检测到7周龄仔猪gE抗体阳性率(22.92%)较低,但11周龄阳性率已经开始升高,17周龄阳性率达到55.73%,说明在7周龄时,猪群的感染率较低,而17周龄则存在较高的PRV感染,可能的原因是母源抗体中的gE抗体,随着时间的延长,抗体水平逐渐降低,且仔猪疫苗免疫程序不合理,导致疫苗免疫效果较差,7周龄后仔猪感染PRV比例增高。目前育肥猪阶段呼吸道病较多,可能也与PRV的感染有关。
对场群阳性率进行分析的过程中,发现存栏50~300头母猪的gE抗体阳性率高,有可能是这种规模群体的猪场,存栏量达到了一定数量,引种比存栏50头母猪以下的猪场频繁,但是与存栏300头母猪以上的猪场相比,缺乏专业的技术人员,PRV防控技术薄弱,又由于检测技术和检测费用等方面的原因,很少对猪群进行血清和病原学的检测和监测,引进PRV阳性猪的几率较高,而且免疫后免疫效果不确实、群中存在的阳性个体或持续感染者不能及时筛除,导致PRV抗体阳性率较高。而800头母猪以上的猪场,大部分注重引种时的检测及猪群的定期监测,因此,场群阳性率相对偏低。与2018年相比,2019年收集的血清gE抗体阳性率明显降低,可能是由于自2018年8月,非洲猪瘟病毒在中国猪场的出现和不断暴发,使猪场的生物安全意识增强,对进出猪场的所有车辆、人员和物品均进行严格的控制和消毒处理,定期对猪场及周边环境进行消毒,以及对引进猪只进行检测等措施的实施,降低了PRV的感染机会,使gE抗体的阳性率下降,但场群阳性率仍较高,可能与猪场未及时对存在持续感染猪进行清除有关,场群的高阳性率也说明河北省猪场PRV的防控形势仍很严峻。
对收集的流产胎儿进行PRV检测的结果显示,总阳性率为27.59%,说明PRV是导致妊娠母猪流产的一个重要病原因素,但不是唯一因素,可能其他能引起母猪流产的病原,如猪繁殖与呼吸综合征病毒等,在妊娠母猪流产过程起着更重要的作用。因此,还应加强对河北省猪群其他病原流行情况的调查,并采取相应的防控措施,以降低猪场的经济损失。
对PRV阳性病料中扩增的gE基因进行序列测定和分析,发现河北省猪场2018-2019年流行的PRV gE基因与国内外2011年之前的毒株遗传距离相对较远,与2012年之后的毒株相对较近,且与本实验室2012年从河北省分离获得的4株PRV gE基因同源性较高。曾有研究表明[19],PRV变异株与经典毒株相比,在gE蛋白的第48位和第492位各存在1个天冬氨酸的插入,特别是第492位1个天冬氨酸的插入可作为鉴定PRV变异株的分子特征。本研究对从河北省检测的8株PRV流行毒株及GenBank中不同分离年代和分离地域毒株的gE蛋白进行比较,发现除HLJ(2013)和LA(1997)株外,其他毒株均符合该变异特征。河北省流行的8株PRV 均属于变异毒株;另外,崔欢等[20]对从2017年河北省某猪场分离到的1株PRV进行gE基因分析时,发现gE基因也存在相同的变异特征,说明河北省近几年流行的PRV 主要为毒力增强的变异毒株,这可能也是PRV 在疫苗免疫的猪场不断发生的原因。
本试验通过对河北省不同地区、不同规模猪场的不同阶段猪血清及流产胎儿进行检测,并对河北流行毒株的gE基因进行了遗传变异分析,初步了解了PRV在猪群中的流行和分布情况,以及河北省流行株的变异情况,为河北省PRV有效防控方案的制定提供了参考依据。

