术前新辅助化疗联合同步放化疗对局部进展期直肠癌预后及血清标志物影响
于登峰, 张文俊, 张福杰, 程卫东, 孙 哲
直肠癌是临床最常见的消化道恶性肿瘤之一,高居恶性肿瘤死因第3位,该病发病隐匿,早期症状不明显,多数患者确诊时已发展至中晚期,5年生存率仅20%左右[1]。局部进展期直肠癌手术难度大、复发率高、术中及术后并发症多,对患者的生命健康造成严重威胁[2]。目前同步放化疗是局部进展期直肠癌的标准治疗方案,但其降低远处转移率和提高总生存率的整体效果欠佳。氟尿嘧啶+亚叶酸钙+奥沙利铂(Fluorouracil +Leucovorin + Oxaliplatin,FOLFOX4方案)是目前治疗直肠癌的一线化疗方案,国外研究报道该新辅助治疗策略联合术前同步放化疗具有更佳的近期和远期疗效,但该治疗方案目前在国内研究报道较少[3]。近年来有研究表明血清脂肪酸合成酶(Fatty acid synthase,FAS)在肿瘤组织中呈过度表达状态,且其表达水平与肿瘤预后存在密切联系[4]。肿瘤型M2丙酮酸激酶(tumor-type M2 pyruvate kinase,Tu M2-PK)是在肿瘤细胞中大量存在的一种二聚体丙酮酸激酶,Shiroki等[5]体外肿瘤细胞培养研究结果表明,TuM2-PK水平上调可以促进肿瘤的增殖、侵袭和转移,且癌症患者血清Tu M2-PK水平显著高于健康人群。本研究通过以2014年1月—2016年5月收治的100例进展期直肠癌患者为研究对象,研究FOLFOX4联合术前同步放化疗对局部进展期直肠癌患者血清FAS、Tu M2-PK表达的影响,以期为FOLFOX4化疗联合术前同步放化疗治疗直肠癌的疗效及预后评估提供有价值的血清评价指标。
1 资料与方法
1.1 一般资料 选取100例进展期直肠癌患者为研究对象,以抽签法随机分为试验组和对照组,每组50例。其中试验组男27例,女23例,年龄35~78岁,平均年龄(61.25±3.58)岁,术前T分期(T3/T4A/T4B)例数为9/17/24,术前N分期(N0/N+)例数为18/32;对照组男26例,女24例,年龄36~80岁,平均年龄(62.58±6.87)岁,术前T分期(T3/T4A/T4B)例数为11/16/23,术前N分期(N0/N+)例数为15/35。两组患者的性别(χ2=0.040,P=0.841)、年龄(t=0.989,P=0.325)、术前T3/T4A/T4B分期(χ2=0.252,P=0.882)、术前N0/N+分期(χ2=0.407,P=0.524)等一般资料无显著差异(P>0.05),所有患者均签署知情同意书,本研究获得伦理委员会批准(伦理号:AEE17058) 。
纳入标准:(1)据《结直肠癌诊治指南》[6],所有患者均经结肠镜及组织病理活检,确诊为局部进展期直肠癌;(2)盆腔磁共振或直肠超声检查结果显示肿瘤浸润深度为T3~T4B,距肛<12 cm;(3)均为初诊患者,入组前未接受其他放化疗治疗;对治疗药物没有过敏史;(4)临床资料完整;(5)自愿参与研究并签署知情同意书。
排除标准:(1)患有双原发癌或心、肝、肺、肾功能不全者;(2)发生胸部等远处转移者;(3)有放化疗或手术禁忌证者;(4)患有严重精神疾病者。
1.2 治疗方法 对照组采取术前同步放化疗治疗[7]:肿瘤靶区 (gross tumor volume,GTV)是指肠镜、影像学确诊的直肠肿瘤区域,临床靶区(clinicaltarget volume,CTV)是指原发灶和淋巴结引流区,包括范围为盆腔侧壁、骶前区、髂内淋巴结、直肠系膜区域、坐骨直肠窝、部分髂总或髂外血管周围淋巴结等区域,其上下界分别是L5椎体及肛管下缘,前后界为膀胱后壁1/4~1/3及骶骨皮质后缘,侧界为真骨盆内缘。计划靶区(planningtarget volume,PTV),是 指 CTV 的 一 定外扩区域(左右、上下及背方向向外扩大距离为1 cm,腹方向为0.5 cm)。PTV区域剂量为45 Gy,GTV 剂量加至 50 Gy,1.8 Gy/次,1 次 /d,5次/周,共5周。同时于放疗时同步滴注5-Fu(生产企业:上海旭东海普药业有限公司,国药准字 H31020593,批号:2015122647),剂量为225 mg/m2/d,持续滴注时间为120 h。结束后6~8周该组患者全部行全直肠系膜切除术(total mesorectal excision,TME)术, 其 中 14例 行 腹会阴联合切除术(miles术式),36例行低位或超低位前切除术(dixon术),术后4周行8周期FOLFOX4化疗(第1、2天:氟尿嘧啶静脉推注400 mg/m2以及氟尿嘧啶静脉滴注600 mg/m2,持续滴注时间为22 h;第1、2天:亚叶酸钙静脉滴注200 mg/m2,14 d/周期,共8周期;第1天:奥沙利铂静脉滴注85 mg/m2)。年龄较大患者剂量适当酌减:70~75岁用量减少至80%,75~80岁用量减少至60~70%,80岁以上用量减少至50%。
试验组:术前盆腔放化疗方案同对照组,随后行FOLFOX4化疗,化疗4周期后行TME术(其中1例患者因完全缓解拒绝接受手术),其他该组49例患者均行手术治疗,其中15例行腹会阴联合切除术(Miles术式),34例行低位或超低位前切除术(Dixon术),患者于术后4周再行4周期FOLFOX4化疗,FOLFOX4化疗方案、剂量及酌减原则同对照组。
分别于术后进行为期两年的随访,随访时间截止时间为2018年6月,每个月通过电话、复诊等方式收集并统计患者术后复发、转移以及死亡情况。
1.3 观察指标及评价标准 (1)比较两组患者的近期疗效:包括两组患者治疗前后的TNM分期的降期率、病理完全缓解率(Pathological complete remission rate,pCR)以及手术根治性切除率(R0切除率);(2)比较两组患者的远期疗效:包括两年局部复发率、远处转移率及总生存率;(3)比较两组患者的不良反应以及并发症发生情况;(4)比较两组患者FAS、Tu M2-PK表达水平:分别于治疗前和FOLFOX4化疗结束后次日清晨采取空腹静脉血10 mL,3000 rpm离心(有效离心半径为 10 cm)10 min后取上清液,使用全自动化学发光免疫分析仪(美国贝克曼有限公司生产)采用双抗体夹心酶联免疫吸附法(Double Antibody Sandwich Assay,DAS-ELISA)检测FAS、TuM2-PK浓度,所有操作均严格按照试剂盒说明书进行,FAS和Tu M2-PK试剂盒分别购自合肥莱尔生物科技有限公司和武汉默沙克生物科技有限公司。
1.4 统计学分析 采用SPSS 20.0软件分析所有数据。其中计量资料以(±s)表示,采用t检验,计数资料以(n%)表示,采用χ2检验。采用Kaplan-Meier法分析两组患者生存情况,生存率比较采用Log-rank检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者近期临床疗效比较 经治疗后,试验组和对照组分别有39名和24名患者出现明显降期,两组患者降期率分别为80%(39/49)、48%(24/50),试验组显著优于对照组,具有统计学意义(χ2=9.653,P=0.002);试验组和对照组的pCR率分别为27%(13/49)、6%(3/50),差异有统计学意义(χ2=4.336,P=0.037);试验组和对照组的R0切除率分别为86%(42/49)、64%(32/50),差异有统计学意义(χ2=6.182,P=0.013)。见表1。

表1 直肠癌患者治疗前后降期率比较
2.2 两组患者远期临床疗效比较 随访2年期间内,试验组术后局部复发率为8%(4/49),对照组术后局部复发率为24%(12/50),两组局部复发率具有显著性差异(χ2=4.581,P=0.032);试验组和对照组远期转移率分别为27%(13/49)、46%(23/50),试验组相比对照组显著降低(χ2=4.054,P=0.044)。随访期间,试验组生存率(OS)的log-rank检验显示具有统计学差异[χ2=4.456,P=0.035,HR = 0.71 (95%CI 0.55~0.92)],两组生存曲线见图1。
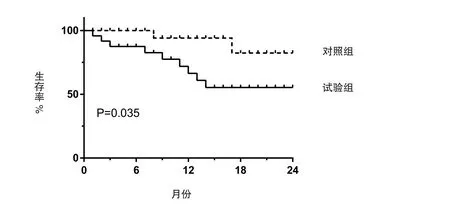
图1 两组患者总生存率生存曲线
2.3 两组患者不良反应及并发症发生情况比较两组患者经治疗后的主要不良反应包括乏力、恶心呕吐、腹泻、放射性皮炎及肠炎、白细胞计数减少、骨髓抑制等。其中,试验组I~II级、III级不良反应发生率与对照组相比,差异无统计学意义(P>0.05),且两组患者均未发生IV级不良反应,见表2。两组患者术中及术后主要并发症有术中出血、切口愈合延迟及吻合口瘘。试验组与对照组中,两组患者术中及术后并发症发生率分别为35%和32%,差异无统计学意义(P=0.766),见表3。

表2 直肠癌患者不良反应发生率比较

表3 直肠癌患者术中及术后并发症发生率比较
2.4 两组患者血清FAS、Tu M2-PK水平比较FOLFOX4化疗结束后,同组患者的血清FAS、Tu M2-PK水平相比术前均明显下降,且试验组血清FAS、Tu M2-PK水平改善程度显著优于对照组,均具有统计学意义(t=9.791,t=4.508,P均<0.001),见表 4。

表4 两组直肠癌患者血清FAS、Tu M2-PK水平比较
3 讨论
直肠癌是临床常见的消化道恶性肿瘤之一,在我国发病率呈上升趋势。直肠癌早期症状不明显,进展至后期的直肠癌临床表现主要有便血、肠梗阻以及排便习惯改变等[8]。目前临床上治疗局部进展期直肠癌的标准治疗方式是术前同步放化疗联合TME手术,可将局部复发率降至10%左右,但远处转移率仍居高不下[9]。故寻找更有效的治疗方式以及优化术前放化疗顺序以降低远处转移率和提高总生存率是直肠癌治疗的重要目标。
pCR是判断直肠癌近期疗效的关键指标,其对远期疗效预测也具有重要提示意义,近来很多研究均证实新辅助放化疗对于局部进展期直肠癌获得pCR具有积极作用。李帅等[9]研究结果证实前放化疗治疗强度以及放化疗结束至手术的间隔时间会对pCR率产生显著影响,因此优化术前新辅助治疗策略是提高直肠癌治疗pCR率的有效方法[10]。FOLFOX4方案是目前治疗直肠癌的一线化疗方案,本文采用FOLFOX4作为新辅助化疗方案,研究结果表明试验组pCR率(26.5%)显著高于对照组(6.0%),试验组降期率、R0切除率(80%、84%)显著高于对照组(48%、64%),均具有统计学意义(P<0.05),说明FOLFOX4新辅助化疗方案近期疗效明显优于对照组。这可能是由于在术前同步放化疗的基础上增加FOLFOX4方案化疗增强了全身化疗的强度,且增加的全身化疗会延长同步放化疗结束至手术的时间间隔,而较长的间隔时间可以使肿瘤组织在放疗后具有充分的坏死时间。在美国和加拿大多个临床试验中心进行的一项II期临床研究结果表明,在对照组基础上于术前分别增加2、4、6个疗程的FOLFOX4方案化疗(氟尿嘧啶+亚叶酸钙+奥沙利铂),其对应的pCR分别达到25.4%、29.9%、38.5%,相比对照组18.3%显著提高[11]。
在远期疗效方面,试验组术后局部复发率、远期转移率分别为8%、27%,显著低于对照组(24%、46%),试验组中位生存时间(20个月)也高于对照组(14个月)。在早期增加全身化疗可以尽早杀死肿瘤细胞和防止其扩散转移,从而有效降低远处转移率和提高总生存率[12]。Hahnen E等[13]通过研究发现,在对照组基础上增加更长的放疗结束至手术时间间隔,试验组的病理降期率相比对照组具有明显的增加优势,与本文结论相一致。另外在本文研究中,试验组不良反应发生率相比对照组,无明显增加(P>0.05),试验组患者术中及术后并发症发生率分别为34%和32%,差异无统计学意义(P>0.05),说明FOLFOX4联合术前同步放化疗治疗进展期直肠癌安全可行。
FAS是人体唯一一种可以在细胞内进行长链脂肪酸合成的蛋白,其在正常人体组织中呈低表达,但由于肿瘤组织细胞快速增殖,需要更多的长链脂肪酸完成细胞膜合成,故其在肿瘤细胞中的表达水平明显增高[14]。Albahlani[15]等研究结果表明FAS不仅在肿瘤组织中过度表达,许多恶性肿瘤患者血清中的FAS水平也明显高于正常健康人群。Bauer F[16]等通过测定不同分期的直肠癌患者血清FAS水平,发现其表达水平与TNM分期呈正相关,提示FAS水平与肿瘤的分期以及恶化程度存在密切联系。Tu M2-PK是一种在肿瘤细胞糖代谢方式中发挥重要作用的糖酵解酶,其是肿瘤细胞进行异常能量代谢的根本原因,也与肿瘤的发生和发展存在密切联系[17]。Paolo C G[18]等研究发现肿瘤转移的过程会释放Tu M2-PK进入外周体液,故Tu M2-PK也在肿瘤患者的外周血中呈现高表达。李喆[19]通过检测不同分期的直肠癌患者血清Tu M2-PK水平,发现Tu M2- PK水平的表达与临床TNM 分期以及癌细胞分化程度呈相关性,与肿瘤的大小、患者性别年龄等其他因素无关。本研究结果显示两组患者在经过对应的治疗后,血清FAS、Tu M2-PK水平相比治疗前均有明显下降,且试验组改善程度显著优于对照组(P<0.05)。既往文献[9]研究显示肿瘤患者的血清FAS、Tu M2-PK水平均与肿瘤分期存在一定的依赖关系,试验组采用FOLFOX4联合术前同步放化疗可以更显著地改善患者的降期率,同时试验组患者血清FAS和Tu M2-PK表达显著降低,因此我们推测可能是与FAS、Tu M2-PK表达水平降低,肿瘤的增殖代谢以及侵袭和转移过程受到明显抑制有关。
综上所述,FOLFOX4联合术前同步放化疗治疗局部进展期直肠癌不仅可以提高肿瘤降期率以及总生存期限,可显著降低血清FAS、Tu M2-PK水平,抑制肿瘤细胞的增殖代谢和侵袭转移,且安全无明显毒副作用。

