当归咖啡酸-O-甲基转移酶基因的克隆与表达分析
张 培,侯云龙,苏 敏,孙 利,徐登封,宋 涛,周璐恒,赵韶华*
(1.承德医学院 中药研究所,河北 承德 067000; 2.石家庄市第二医院,河北 石家庄 050051;3.石家庄以岭药业股份有限公司,河北 石家庄 050035)
当归(Angelicasinensis(Oliv.) Diels)是伞形科多年生草本植物,其干燥的贮藏根是我国传统的大宗药材之一[1],具有悠久的药用历史,在方剂中的应用甚广,具有平喘、保肝、抗胃肠功能障碍,促进造血等药理作用[2-4]。阿魏酸是当归的主要药效成分之一,毒副作用小,其衍生物常用于抗癌药物、食品、化妆品等原料[5]。阿魏酸又是当归的代谢产物,主要生物合成途径之一是咖啡酸甲基转移酶途径[6],这个反应由苯丙氨酸解氨酶催化苯丙氨酸生成反式-肉桂酸开始,再由肉桂酸-4-羟基化酶催化反式-肉桂酸生成对-香豆酸,经香豆酸-3-羟基化酶催化作用生成咖啡酸,并以甲硫氨酸作为甲基供体,在咖啡酸-O-甲基转移酶(Caffeic acid o-methyltransferase,COMT)的催化作用下生成阿魏酸[7]。其中,COMT作为一种重要的甲基化酶,可催化咖啡酸生成阿魏酸,且COMT的基因表达和酶活性的改变会直接或间接影响木质素类、苯酞类、香豆素类、黄酮类、有机酸类等代谢产物的生成[8]。因此,COMT可能在促进当归的生长发育及适应环境和阿魏酸的合成过程中起着关键作用。
通过大肠杆菌原核表达系统合成异源蛋白,可以方便研究植物中目标蛋白的生物学功能和酶学特性[9]。原核表达系统具有产量高、易操作和廉价等优点[10],为研究当归AsCOMT蛋白的表达提供了有效工具。无缝克隆作为一种新兴的DNA克隆技术能快速实现片段与片段或片段与载体的无缝连接,不受酶切位点的限制,也不需要单独的连接反应,可广泛应用在多片段重组和重组表达载体的构建中[11]。雒军等[12]利用同源克隆法及RACE技术从当归中克隆出AsCOMT基因的cDNA全长,并通过生物信息学的方法对该序列进行分析。吴晓刚等[13]从马尾松中克隆出PmCOMT基因的cDNA全长,并通过实时荧光定量PCR分析该基因在不同组织的表达量。刘裕峰等[14]不仅克隆了板栗CmCOMT基因全长cDNA,分析其编码蛋白的生物学信息,而且对该基因进行了原核表达,为获得大量的CmCOMT蛋白,进一步对诱导表达条件进行优化。目前仅是从当归中克隆得到COMT基因,但尚未进行组织特异性及原核表达分析。传统的载体构建方法受限制性内切酶、载体和目的片段的限制,不仅工作量大、操作繁琐,重组效率也较低。无缝克隆技术能解决上述难题,但是目前利用该技术构建重组载体的报道还较少。本研究以当归叶片为材料采用PCR技术克隆当归的COMT基因,利用无缝克隆技术将当归COMT基因的ORF序列插入pGEX-4T-3载体来构建重组表达载体,热击法转化大肠杆菌并利用IPTG诱导重组蛋白表达,进一步优化诱导表达条件以获得可溶性的重组蛋白,为后续当归COMT蛋白的分离与纯化提供技术支持。
1 仪器与试剂
1.1 植物材料
当归植株来自甘肃岷县实验基地。利用Trizol法[15](Invitrogen)提取当归不同组织(根、叶柄及叶片)的总RNA,-80℃保存备用。采用PrimeScriptTM逆转录试剂盒合成cDNA,-20℃保存备用。
1.2 菌株与质粒
pGEX-4T-3表达载体含谷胱甘肽S转移酶(Glutathione-S-transferase,GST)和pMD 19克隆载体均购自宝日医生物技术(北京)有限公司;大肠杆菌感受态细胞DH5α和BL21(DE3)菌株均购自北京全式金生物有限公司。
1.3 实验试剂
EcoR Ⅰ酶、In-Fusion©HD Cloning Kit、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、Premix Ex Taq、DL2000 DNA Marker、质粒DNA小提试剂盒及DNA胶回收与纯化试剂盒均购于宝日医生物技术(北京)有限公司;GoTaq©Real-Time PCR Systems试剂盒购于普洛麦格(北京)生物技术有限公司;氯霉素购于青岛生工生物科技有限公司,异丙基-β-D-硫代半乳糖(Isopropyl-D-thiogalactopyranoside,IPTG)、氨苄青霉素、SDS-PAGE凝胶制备试剂盒均购自北京索莱宝科技有限公司。引物合成及测序均由生工生物工程(上海)股份有限公司完成。
1.4 仪器与设备
电泳系统(DYY-5,北京六一仪器厂),多功能成像系统(Azure Biosystems Inc C300,美国),冷冻离心机(Thermo Micro 21R,美国Thermo公司),恒温水浴锅(HH-4,常州澳华仪器有限公司),电子天平(梅特勒PL602E,瑞士),PCR仪(Bio-Rad icycler IQ,美国),B2级生物安全柜(HFsafe-1200 B2,上海),气浴恒温摇床(GFL 3033,德国),全波长酶标仪(Bio-Rad Bench mark plus),实时荧光定量PCR仪(枫岭FTC-3000P,加拿大),超声波细胞粉碎机(宁波新芝)。
2 实验方法
2.1 当归COMT基因克隆
根据已知的当归COMT基因的序列设计特异性引物S和A,以前期研究所得当归叶片总cDNA为模板,利用PCR技术扩增当归COMT基因的cDNA全长。PCR反应条件为95℃3 min;95℃1 min,56℃45 s,72℃1 min,30个循环;72℃延伸8 min,PCR产物经1%琼脂糖凝胶电泳检测后,切胶回收目的条带。将其连接到pMD19-T载体上进行TA克隆,热击法转化至大肠杆菌DH5α感受态细胞,经菌落PCR鉴定后挑选阳性单克隆进行测序。所用引物见表1。
2.2 当归COMT基因的生物信息学分析
使用NCBI ORF Finder查找该基因的开放阅读框(Open reading frame,ORF);采用NCBI数据库中的Blast,将AsCOMT基因编码的氨基酸序列在GenBank中进行同源性搜索;利用DNAMAN软件对不同来源的COMT氨基酸序列进行多重比对;用ExPASy提供的Protparam tool预测AsCOMT基因编码蛋白的理化性质;利用NCBI的Conserved domains预测AsCOMT蛋白的保守结构域;通过Protscale (http://web.expasy.org/protscale/)预测蛋白质的疏水性;使用SignalP 4.1进行信号肽的预测;通过TMHMM Server v.2.0预测蛋白跨膜区。
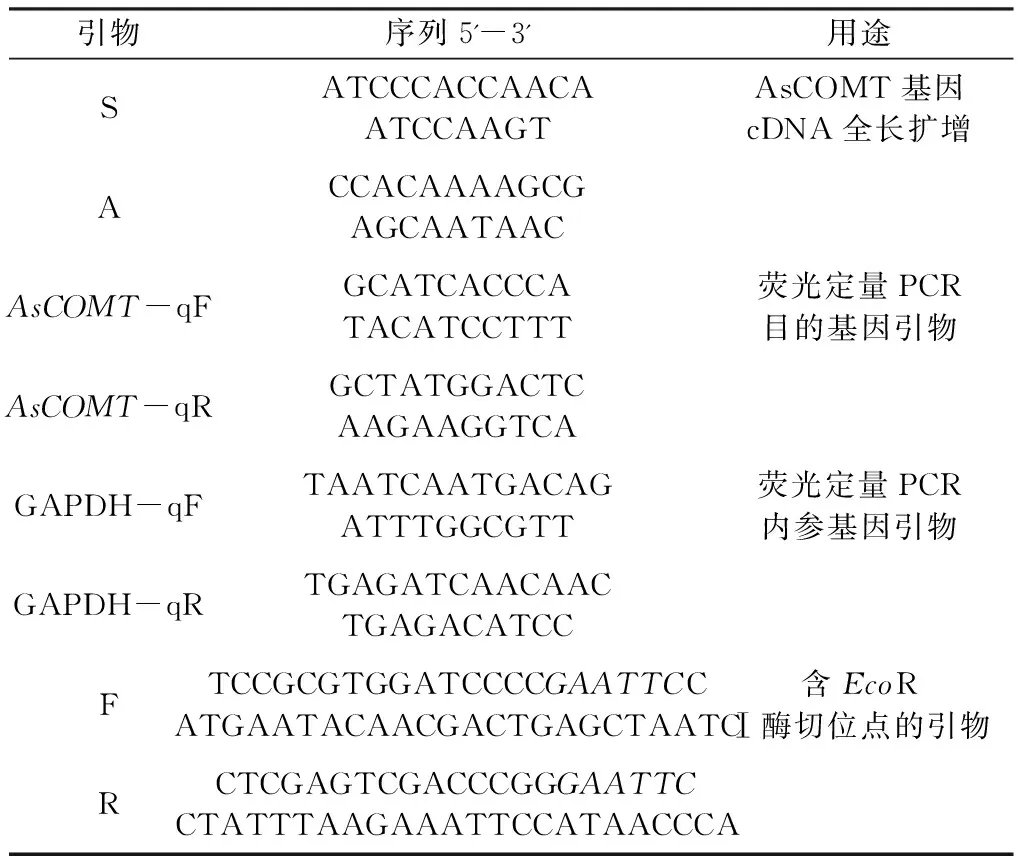
表1 当归AsCOMT基因扩增所用引物Table 1 Primers for amplification of AsCOMT gene in A.sinensis
2.3 AsCOMT基因荧光定量PCR分析
当归各组织的cDNA稀释10倍作为Real-time PCR反应模板。以GAPDH为内参基因,采用GoTaq©qPCR试剂盒进行实时荧光定量PCR分析。反应体系:2×qPCR Master Mix 10 μL,cDNA 1 μL,上下游引物各0.8 μL,无RNase水7.4 μL。扩增程序:95℃预变性3 min,95℃变性15 s、55℃退火30 s、72℃延伸30 s进行40个循环,每个组织样品设置1次生物学重复,每个样品重复3次。根据溶解曲线判断Real-time PCR产物的特异性,相对定量分析采用2方法,所得试验数据用统计分析软件SPSS 21 进行单样本T检验,并使用Graph Pad Prism软件绘图。
2.4 原核表达载体的构建
2.4.1 基于无缝克隆技术的PCR引物设计
无缝克隆技术的原理是在目的基因PCR引物的5'端加上与线性化载体同源的15 bp碱基序列,无缝克隆酶能特异性识别目的基因PCR产物和线性化载体两端的同源序列,并发生同源重组。通过PCR和20~30 min的同源重组反应就能将目的基因片段克隆到目标载体上。据PCR引物设计原则利用Primer Premier 5 软件参照AsCOMT基因片段序列设计一对引物F和R(见表1)。其中斜体为EcoR Ⅰ酶切位点,下划线为依据AsCOMT基因的ORF序列设计的引物,酶切位点前15 bp为线性化pGEX-4T-3载体粘性末端的同源序列。
2.4.2 目的基因片段扩增
以pMD 19-AsCOMT质粒为模板,使用引物F和R扩增当归COMT基因片段,PCR反应体系:2×Premix Taq 10 μL,模板1 μL,正反向引物(10 μM)各0.5 μL,无酶水 8 μL。反应条件: 94℃ 预变性 3 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。PCR产物经电泳检测后回收纯化目的基因片段。
2.4.3 表达载体pGEX-4T-3线性化
用EcoR Ⅰ单酶切pGEX-4T-3载体。反应体系:EcoR Ⅰ 1 μL,10×H Buffer 2 μL,质粒DNA 1 μg,灭菌水补足至20 μL。37℃酶切1 h,65℃灭活10 min。酶切后并回收纯化。
2.4.4 重组表达载体的构建及验证
pGEX-4T-3质粒经EcoR Ⅰ单酶切后并回收纯化。采取In-Fusion©HD Cloning Kit建立当归COMT基因片段与线性化pGEX-4T-3载体的同源重组反应。反应体系:质粒酶切产物1 μL,目的片段1 μL,5×CE Ⅱ Buffer 4 μL,Exnase Ⅱ 2 μL,无酶水 12 μL。37℃反应30 min,立即至冰水浴中冷却5 min。继续使用热击法转化至E.coliBL21(DE3)感受态细胞中。筛选阳性单克隆,经菌落PCR验证后进行测序。确定目的基因序列与质粒组装无误后,将重组后的原核表达载体命名为pGEX-4T-3-AsCOMT。
2.5 IPTG诱导表达条件优化
将转化成功的重组菌株接种在含80 μg/mL氨苄青霉素和35 μg/mL氯霉素的LB液体培养基中,37℃,220 r/min振荡培养过夜。次日按1:100的接种量进行亚培养,至菌液OD600约为0.6时分别进行不同条件的诱导。
2.5.1 IPTG浓度的筛选
分别加入不同浓度的IPTG,使IPTG终浓度分别为0.1 mmol/L、0.3 mmol/L、0.5 mmol/L、1.0 mmol/L,25℃,160 r/min下诱导表达8 h后取样进行SDS-PAGE电泳检测。同时以转化pGEX-4T-3空载体的E.coliBL21(DE3)和未诱导的重组菌为对照。
2.5.2 诱导时间的筛选
加入IPTG使终浓度为1.0 mmol/L,25℃,160 r/min下诱导表达,分别在2 h、4 h、6 h、8 h取样进行SDS-PAGE电泳检测。同时以空载菌和未诱导的重组菌为对照。
2.5.3 培养温度的筛选
加入IPTG至终浓度为1.0 mmol/L,分别在16℃、20℃、25℃、30℃(转速均为160 r/min)下诱导表达,8 h后取样进行SDS-PAGE电泳检测。
2.5.4 表达蛋白的可溶性检测
为确定重组蛋白诱导表达的最适温度,同时评估在不同温度下诱导的目的蛋白的可溶性,分别以20℃、25℃和30℃诱导8 h后收集的菌液,4℃,5 000 r/min离心20 min收集菌体并用1×PBS缓冲液洗涤沉淀,重悬。取5 mL菌液于冰浴中超声破碎菌体至完全,以4℃,10 000 r/min离心10 min分离上清和沉淀。分别向样品中加入100 μL ddH2O和100 μL 2×SDS上样缓冲液,沸水煮7 min,冷却后取15 μL样品进行10% SDS-PAGE检测。
3 结果与分析
3.1 当归COMT基因的克隆
当归COMT基因的PCR产物约为1 100 bp(如图1),且AsCOMT基因的阳性单克隆的测序结果与已知序列(Accession number:KP188587)一致。经NCBI ORF Finder检测发现该序列包含一个完整的ORF,大小为1 098 bp,编码365个氨基酸。

图1 PCR扩增AsCOMT基因Fig.1 PCR amplification of AsCOMT geneM为DNA Marker;1~3为PCR产物
3.2 AsCOMT基因编码蛋白的生物信息学分析
当归COMT基因编码的氨基酸序列与其他植物COMT氨基酸序列具有较高的同源性。且多重比对分析发现当归COMT位于224~354氨基酸序列具有植物S-腺苷-L-甲硫氨酸(S-adenosyl-L-methionine,SAM)高度保守的功能域(见图3),包括VVDVGGGTG、GINFDLPHV、EHVGGDMF、NGKVI及GGKERT[14],进一步说明AsCOMT属于COMT蛋白家族成员之一。

表2 当归COMT基因编码蛋白的生物信息学分析Table 2 Bioinformatics analysis of the protein encoded by AsCOMT gene

表3 不同植物COMT氨基酸的同源性比对Table 3 Homology comparison of amino acids of COMT in different plants
3.3 AsCOMT基因的组织特异性分析
AsCOMT基因的扩增曲线斜率一致且趋势正常,基线平整;熔解曲线峰值单一,引物特异性较好,未产生非特异性扩增。Real-time PCR结果显示,AsCOMT基因在当归各组织中均有表达,而且根中表达量最高,其次是叶片,叶柄中最低,说明AsCOMT基因在当归中的表达具有组织特异性,以在根中表达为主。

图2 AsCOMT蛋白保守域分析Fig.2 The conserved domains of AsCOMT protein

图3 AsCOMT与其它植物COMT蛋白的多序列比对Fig.3 Multiple sequence alignment of AsCOMT and COMT proteins from other plant species注:红色方框所示即为结合位点

图4 当归不同组织总RNA的提取Fig.4 Total RNA extraction from different tissues of A.sinensis注:M为DNA相对分子量标准;1,2为叶柄;3,4为叶片;5,6为根

图5 AsCOMT基因在当归不同组织中的相对表达量Fig.5 Relative expression level of AsCOMT gene in different tissues of A.sinensis*表示差异有统计学意义(P<0.05),与叶柄相比
3.4 原核表达载体的构建及鉴定
重组质粒的菌落PCR产物约为1 128 bp(图6),与预期结果一致;且重组质粒阳性单克隆的测序结果与当归AsCOMT基因cDNA序列比对结果一致,表明pGEX-4T-3-AsCOMT表达载体构建成功。

图6 阳性单克隆的菌落PCR鉴定Fig.6 Detection of pGEX-4T-3-AsCOMT-Ecoli.BL21 (DE3) by colony PCR注:M为DNA Marker;1~3为PCR产物
3.5 IPTG不同浓度对诱导重组蛋白表达的影响
3.5.1 IPTG浓度对重组蛋白表达的影响
由图7可知,含有空载体的大肠杆菌和未诱导重组菌中均未出现与目的蛋白大小相当的条带。但在不同IPTG浓度诱导的重组菌中(泳道3~6)均检测到分子量约为66 kDa的蛋白条带。AsCOMT基因编码的蛋白预测相对分子质量为40.230 kDa,而当pGEX-4T-3质粒在大肠杆菌中表达时,重组蛋白的N-末端融合了pGEX-4T-3载体的谷胱甘肽转移酶GST标签(26 kDa),总相对分子质量为66.230 kDa,所以在SDS-PAGE结果中约66 kDa处出现目的蛋白条带,与预测的AsCOMT重组蛋白分子量相符。含空载体的菌株诱导后与未经IPTG诱导的重组菌均未出现目的条带,而其他4条泳道均有大小与目标蛋白一致的蛋白条带,且表达的蛋白量高于未经诱导的菌株。进一步验证了AsCOMT基因能够在大肠杆菌中与GST标签进行融合并表达,且受ITPG的诱导。结果表明,AsCOMT重组蛋白成功在大肠杆菌BL21(DE3)中表达。当IPTG终浓度达到1.0 mmol/L时AsCOMT重组蛋白的表达量最大,并以此作为最适ITPG浓度。
3.5.2 诱导时间对重组蛋白表达的影响
由图8可知,不同诱导时间1~4组均能表达目的蛋白,且随着时间的延长,目的蛋白的量也在逐渐增加,以诱导8 h目的蛋白表达量最大,因此,以诱导8 h为最佳时间。
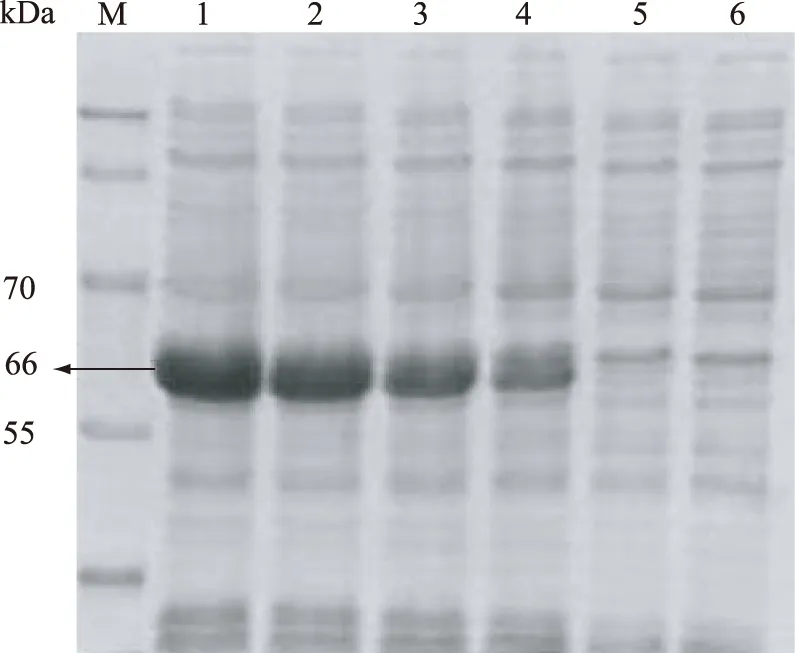
图8 诱导时间对AsCOMT重组蛋白表达的影响Fig.8 Effect of induction time on the expression of AsCOMT recombinant protein注:M为蛋白质分子量标准;1为8 h;2为6 h;3为4 h;4为2 h;5为未诱导pGEX-4T-3-AsCOMT重组菌;6为pGEX-4T-3空载菌
3.5.3 温度对重组蛋白表达的影响
由图9可知,在不同温度条件下均能诱导出目的蛋白,且随着温度的上升,目的蛋白表达量有所增加,在30℃达到最大。
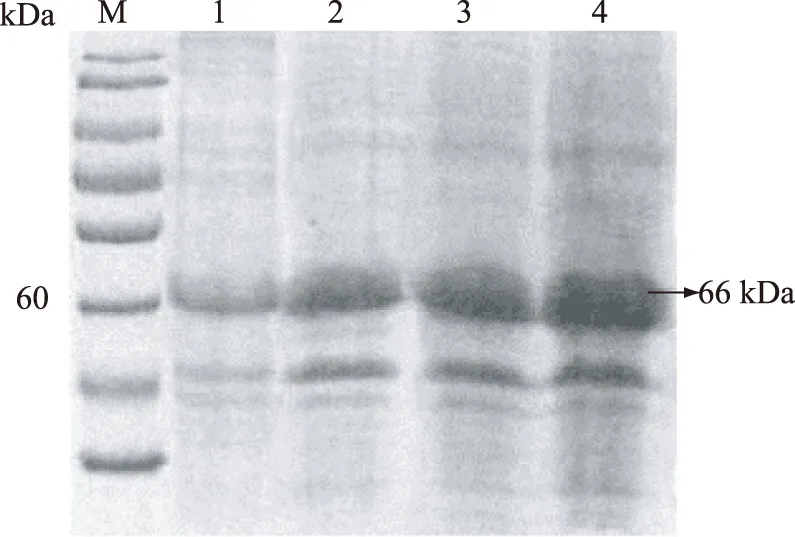
图9 温度对AsCOMT重组蛋白表达的影响Fig.9 Effect of temperature on the expression of AsCOMT recombinant protein注:M为蛋白质分子量标准;1为16℃;2为20℃;3为25℃;4为30℃
3.5.4 重组蛋白的可溶性检测
由图10可知,3种温度条件下均能诱导出目的蛋白,在25℃条件下主要以可溶的形式存在,且该条件下重组蛋白的表达量较20℃条件下高;在30℃条件下重组蛋白的表达量最大,但多以包涵体的形式存在于沉淀中,杂蛋白也较多,因此,目的蛋白诱导表达的温度以25℃为宜,以获得更多的可溶性蛋白。

图10 AsCOMT重组蛋白的可溶性检测Fig.10 Solubility detection of AsCOMT recombinant protein注:M为蛋白质分子量标准;1为沉淀-20℃;2为上清-20℃;3为沉淀-25℃;4为上清-25℃;5为沉淀-30℃;6为上清-30℃
4 讨论
阿魏酸是一种植物来源的酚酸,在细胞壁中与多糖和蛋白质结合成为细胞壁的骨架[16]。阿魏酸具有广泛的药理学作用,如抗血栓、抗氧化[17]、抗炎、抗病毒、抗肿瘤[18]、神经保护[19-20]及保护肝肾作用[21]等,是当归的有效成分之一,常作为药材质量的控制指标[22]。在高等植物体内,阿魏酸是木质素生物合成过程的重要中间代谢产物之一,其生物合成涉及到许多酶的参与。COMT是植物体内调控木质素合成的关键酶之一[23],它主要参与S-木质素的合成,并且可以对咖啡酸、5-羟基松柏醛和5-羟基松柏醇甲基化分别生成阿魏酸、芥子醛和芥子醇起到催化作用[24]。此外,过表达COMT植物木质素含量增加,且木质素组成改变,从而提高物种在干旱胁迫的适应能力[25],如在番茄中过表达COMT提高了干旱胁迫下番茄植株的光合作用和抗氧化能力[26-27]。所以后续可利用RNAi或过量表达等方法研究AsCOMT基因表达特征及其分子作用,不仅有助于理解当归特殊生境下的分子生理机制,而且通过遗传工程手段进行改良,有希望提高当归中木质素及其他苯丙酸途径衍生物的含量,进一步培育高阿魏酸含量的当归新品种,具有重要的商业价值和现实意义。
本研究采用RT-PCR的方法从当归叶片中扩增获得了1个长度为1 098 bp的AsCOMT基因的ORF序列,推测该基因编码365个氨基酸,蛋白分子量约为40.23 kD,等电点为5.43。该蛋白含有SAM结合位点,进一步说明AsCOMT属于COMT蛋白家族成员。通过DNAMAN软件分析,发现该基因编码的氨基酸序列与前胡Peucedanumpraeruptorum、峨参Anthriscussylvestris、川芎Ligusticumsinense、罗勒Ocimumbasilicum、茶树Camelliasinensis等的COMT氨基酸序列的一致性达85%以上,表明COMT基因在进化过程中具有一定的保守性。相关研究显示,COMT基因是一种古老的基因,它与植物进化过程基本一致[28],并且在植物的进化过程中具有较高的保守性[29],本研究的结果与此相同。
近年来,利用高通量测序技术对传统药用植物转录组的研究已经成为现代研究的重点,RNA-seq技术的发展极大的推动了转录组学的研究[30-31],现已广泛应用于药学、生物学等领域。目前,已有多种药用植物进行了转录组的研究,并开展了活性成分合成途径关键酶基因的挖掘与分析[32],为解析这些基因的功能奠定了基础。因此,本研究今后将基于高通量转录组测序技术,利用生物信息学的方法,同时克隆当归COMT基因家族中的其他成员,对当归COMT基因及其编码蛋白的结构与功能进行预测,并分析每个成员的功能以及各成员之间有无协同作用等,为深入解析当归COMT基因家族成员的功能及木质素的合成途径提供参考。
实时荧光定量PCR结果显示AsCOMT基因在当归不同组织的相对表达量为根>叶片>叶柄。这种表达模式可能与当归以根入药有关,膨大的根中积累较多的阿魏酸、藁苯内酯、有机酸类等成分[33],而在叶片中积累较少,这些结果说明AsCOMT基因可能在阿魏酸、苯酞类化合物的合成过程中起关键作用[34]。
原核表达系统的优越性体现在产量高、易操作、稳定性好、成本低等[35],通过在大肠杆菌中表达当归AsCOMT蛋白,为研究AsCOMT蛋白的酶学活性提供了一条有效的途径。传统的载体构建方法需要设计满足特殊条件的引物并通过多种操作程序来实现。与传统的构建方法相比,无缝克隆是一种快捷高效的克隆技术,在不依靠限制性内切酶、连接酶的情况下能将带有15 bp同源序列的目的基因片段无缝克隆到目标载体上,适用于多种载体的构建,也可完成多片段连接和定点突变试验等[11]。本研究用无缝克隆方法成功构建了pGEX-4T-3-AsCOMT重组质粒,转入大肠杆菌BL21(DE3)中,通过IPTG诱导重组蛋白表达,得到分子量约66 kDa的目的蛋白,与GST标签和AsCOMT蛋白两者融合产生的蛋白分子量一致。为获得大量的AsCOMT蛋白进一步优化表达条件,研究发现在IPTG浓度为1.0 mmol/L,25℃条件下诱导8 h获得的目的蛋白表达量较多,且重组蛋白主要以可溶的形式存在;在30℃诱导表达时,重组蛋白表达量最多,但多呈包涵体的形式,说明较低的诱导温度有利于重组蛋白的折叠并形成正确的立体结构,而较高温度下重组蛋白则多以包涵体的形式存在[36-37]。后期将通过Ni2+亲和色谱获得了纯化的AsCOMT重组蛋白,为下一步进行体外酶促反应,研究AsCOMT酶学活性以及底物特异性奠定基础,将有助于深入认识当归阿魏酸生物合成途径及其调控机制,为研究AsCOMT基因在当归阿魏酸生物合成中的功能奠定基础,也为通过基因工程技术遗传改良当归提供候选基因。
COMT作为阿魏酸生物合成途径的关键酶之一,对阿魏酸的合成起重要的调节作用,是从分子水平上揭示当归阿魏酸生物合成机理的一个创新点。本文为后期当归AsCOMT蛋白的分离纯化及酶学活性的鉴定提供了材料基础,为进一步阐释阿魏酸生物合成的分子机制提供了理论参考。

