SARS-CoV-2抗体不同方法学检测结果的差异分析
潘 婧, 梁 芸, 梁翠娟, 赵东兰, 冯 苏, 万玲玲, 宋国威, 李立新
(石家庄市人民医院检验科,河北 石家庄 050000)
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的新发传染病。《新型冠状病毒肺炎诊疗方案(试行第七版)》将血清SARS-CoV-2特异性IgM和IgG抗体阳性作为确诊依据之一[1]。目前,已有多种方法的商品化SARS-CoV-2抗体检测试剂。本研究拟采用胶体金法和化学发光法对发热患者血清SARS-CoV-2抗体进行检测,并对2种方法检测不一致的结果进行分析。
1 材料和方法
1.1 研究对象
选取2020年2—3月石家庄市人民医院住院及隔离观察病区168例发热患者,其中4例确诊为COVID-19。本研究经石家庄市人民医院伦理审查委员会审核通过(伦理号:2020046),并批准予以豁免患者知情同意。
1.2 方法
1.2.1 样本采集 采用无抗凝剂的真空采血管采集所有对象空腹静脉血5 mL,室温静置30 min,离心分离血清,备用。
1.2.2 化学发光法检测SARS-CoV-2抗体 采用MAGLUMI 4000 Plus全自动化学发光免疫分析仪(深圳新产业公司)及配套SARS-CoV-2 IgM和IgG抗体检测试剂盒(化学发光法)进行检测,IgM抗体采用捕获法{以抗人IgM单克隆抗体包被磁性微球,N-(4-氨丁基)-N-乙基异鲁米诺[N-(4-Aminobutyl)-N-ethyl isoluminol,ABEI]标记 SARS-CoV-2重组抗原},IgG抗体采用间接法(SARS-CoV-2重组抗原包被磁性微球,ABEI标记抗人IgG单克隆抗体),结果以相对光强度(relative light unit,RLU)表示,样本中SARS-CoV-2 IgM或IgG抗体的量与RLU呈正相关,根据RLU及内置校准曲线自动计算出抗体浓度(AU/mL),以≥1.10 AU/mL为阳性。
1.2.3 胶体金法检测SARS-CoV-2抗体 胶体金法采用免疫层析技术,以捕获法为原理。胶体金法1检测血清SARS-CoV-2总抗体,试剂盒购自广州万孚生物技术股份有限公司。胶体金法2分别检测血清SARS-CoV-2 IgM和IgG抗体,试剂盒购自英诺特(唐山)生物技术有限公司。2种方法的结果均以T线和C线位置出现紫红色条带判为阳性。
2 结果
采用化学发光法和2种胶体金法检测164例发热患者的血清SARS-CoV-2抗体,结果均为阴性。4例COVID-19患者的检测结果3种方法之间存在差异,胶体金法1的检测结果均为阳性;胶体金法2 IgM抗体均为阴性,2例IgG抗体为阳性;化学发光法1例IgM抗体阳性,IgG抗体均为阳性。检测结果差异来源于患者A和患者B的原倍血清样本,见表1。

表1 3种方法检测结果不一致的2例COVID-19患者血清SARS-CoV-2抗体的分析
对4例COVID-19患者的原倍血清进行稀释。当稀释倍数为8倍、16倍时,胶体金法2检测患者A的结果为IgM(-)/ IgG(+),患者B的结果为IgM(+)/ IgG(+),均与胶体金法1和化学发光法的检测结果一致。见表2。
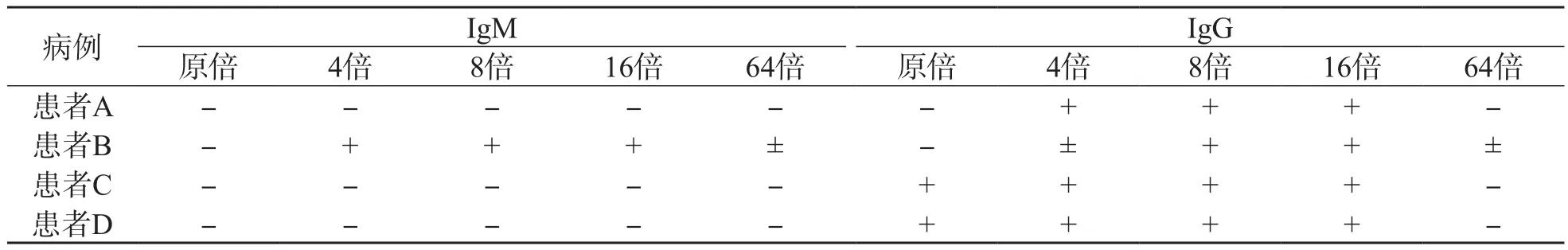
表2 胶体金法2检测不同稀释倍数血清SARS-CoV-2抗体的比较
3 讨论
SARS-CoV-2核酸检测是COVID-19的主要诊断方法,但其结果受样本质量、实验条件及人员操作等因素影响较大,不能满足筛查诊断要求[2]。为此,《新型冠状病毒肺炎诊疗方案(试行第七版)》[1]中引入了血清SARS-CoV-2抗体检测。本研究对不同方法学的SARS-CoV-2抗体检测试剂的测定结果进行了分析,结果显示,化学发光法和2种胶体金法检测168例发热患者血清SARS-CoV-2抗体的结果均为阴性,4例COVID-19患者中有2例检测结果存在差异。胶体金法1检测患者A和B的原倍血清SARSCoV-2总抗体,结果均为阳性;采用胶体金法2检测血清SARS-CoV-2 IgM和IgG抗体,结果均为阴性。对患者血清进行稀释,当稀释倍数为8倍、16倍时,胶体金法2的检测结果与胶体金法1、化学发光法的检测结果一致。人体感染SARS-CoV-2后,一般会在5~7 d检出IgM抗体,10~15 d可检出IgG抗体,抗体滴度在急性期后期或恢复期早期(约第3周)达到峰值,随后IgM抗体滴度快速下降,而IgG抗体滴度迅速升高[3]。患者A和B在石家庄市人民医院采集样本时,患者A为发病后第25天,患者B为发病后第18天,分别处于恢复期早期和急性期后期,抗体滴度可能会超过试剂检测的阈值,出现由于抗体滴度过高、抗原抗体比例不合适而导致的假阴性现象,即钩状效应。当血清抗体浓度极高时,无法正常与胶体金标记的SARS-CoV-2抗原形成复合物,不能在包被的鼠抗人IgM/IgG抗体处被捕获,此时的抗原抗体反应会产生钩状效应,容易造成临床误诊。因此,针对不同病程、不同病情患者的临床样本进行适当稀释,使抗原抗体比例达到平衡或减少干扰物质含量,可避免假阴性或假阳性反应。此外,血清中类风湿因子及其他非特异IgM抗体的存在也会影响检测的灵敏度。
由于重组抗原的选择、制备等方面的差异可能会影响重组抗原的抗原性,因此即使是同一种方法,不同品牌的SARS-CoV-2抗体试剂的检测结果也会出现一定的差异。此外,不同方法学(双抗原夹心法、间接法、捕获法等)也会对试剂盒的敏感性、特异性产生影响[4]。有研究结果显示,采用化学发光法检测SARS-CoV-2 IgM和IgG抗体具有较高的敏感性(70.24%、96.20%)和特异性(96.10%、92.41%)[5]。本研究采用化学发光法(捕获法原理和间接法原理)检测血清SARS-CoV-2 IgM、IgG抗体,检测系统自动化程度较高,可自动稀释高浓度样本,在一定程度上能减少钩状效应的发生。
总之,SARS-CoV-2抗体检测试剂与其他血清学检测试剂一样,存在一定的假阳性或假阴性可能,会影响COVID-19的诊断和防控。虽然抗体检测可以有效弥补核酸检测漏检的风险,但在高度疑似病例中,若抗体检测结果为阴性,建议结合患者发病时间,进行不同稀释度样本的检测。除此之外,各临床实验室应在试剂启用前进行性能验证,避免假阴性或假阳性结果对临床诊断的误导。

