牛源大肠杆菌对氟喹诺酮类药物的耐药性分析
王丽娟,王宁宁,王 乐,李 芬,2,刘晓强,王 妍,李勤凡,2
(1 西北农林科技大学 动物医学院,陕西 杨凌 712100;2 新疆农业大学 动物医学院,新疆 乌鲁木齐 830052)
大肠杆菌是常见病原体,尤其是在水清洁度不够及畜舍卫生条件差的养殖场[1]。粪便中的大肠杆菌易通过气溶胶扩散到外部环境,污染附近的空气、水和土壤,进一步对公共环境和人类健康构成潜在威胁[2]。氟喹诺酮类药物(fluoroquinolones,FQs)作为一类广谱抗生素,在治疗由革兰氏阴性菌引起的疾病中发挥着重要作用[3]。然而,FQs的广泛使用和滥用,导致耐药大肠杆菌出现和快速传播[4]。细菌耐FQs的最常见机制包括喹诺酮耐药决定区(quinolone resistant determining region,QRDR)基因突变和质粒介导的喹诺酮类耐药(plasmid-mediated quinolone resistant,PMQR)基因流行[5-6]。对大肠杆菌而言,耐FQs的原因主要是QRDR突变,尤其是gyrA和parC基因编码的氨基酸突变[7]。PMQR基因最早于1998年被发现[8],研究表明,qnrS、aac(6′)-Ib-cr是最常见的PMQR基因[2,9]。虽然PMQR基因仅赋予大肠杆菌低FQs抗性,但其在肠杆菌中可以水平扩散,并且被认为是QRDR突变产生的有利条件[10]。
由于PMQR基因可以通过相互接触、水及土壤污染从动物传播给人类,同时该基因可以增加QRDR的突变机率,因此其对人或动物大肠杆菌病的防治有重要影响。目前,关于牛源大肠杆菌PMQR基因和QRDR突变的检测研究较少。本试验从犊牛粪便分离鉴定大肠杆菌,通过测定其对3种常用FQs的最小抑菌浓度(minimum inhibitory concentration,MIC),检测PMQR基因与QRDR突变,为合理用药提供依据。
1 材料与方法
1.1 材 料
1.1.1 样品采集 选取陕西宝鸡、渭南、咸阳和杨凌4个规模化奶牛养殖场的腹泻犊牛进行采样。首先对犊牛肛门周围进行消毒,随后用无菌棉签采集腹泻犊牛直肠内粪便,将沾有粪便的棉签放入无菌离心管保存,立即低温运输至实验室进行大肠杆菌分离。
1.1.2 药物和试剂 恩诺沙星(ENR)、环丙沙星(CIP)和诺氟沙星(NOR),购自索来宝公司;麦康凯琼脂培养基购自北京奥博星生物技术有限责任公司;酵母提取物、胰蛋白粉、氯化钠购自OXOID公司;琼脂糖购自Hydra Gene公司;DL2000 DNA Marker和2×rTaqMix购自TaKaRa公司;大肠杆菌ATCC 25922购自杭州滨和微生物有限公司。
1.2 方 法
1.2.1 大肠杆菌的分离鉴定及药敏试验 将粪便样品稀释并涂布至麦康凯培养基上,37 ℃培养24 h,挑取粉红色菌落进一步分离和纯化,最后使用大肠杆菌phoA基因特异性引物[11](表1)进行鉴定。PCR反应体系为:菌液2 μL,上游引物(F)0.5 μL,下游引物(R)0.5 μL,2×rTaqMix 10 μL,双蒸水7 μL,总体积 20 μL。将菌液替换为双蒸水设立阴性对照,其他体系不变。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃终延伸10 min。对PCR产物进行1%琼脂糖凝胶电泳检测。分离的大肠杆菌用体积分数25%甘油于-80 ℃保存备用。以大肠杆菌ATCC 25922作为质控菌,根据美国临床实验室标准委员会(CLSL)推荐的微量肉汤稀释法[12],测定ENR、CIP、NOR 3种FQs对大肠杆菌分离株的MIC。3种FQs的MIC耐药折点分别为:恩诺沙星(ENR)≥2 μg/mL,环丙沙星(CIP)≥4 μg/mL,诺氟沙星(NOR)≥16 μg/mL。
1.2.2 牛源大肠杆菌PMQR基因及QRDR突变的检测 本试验涉及的PMQR基因包括qnr家族基因qnrA、qnrB、qnrD和qnrS,氨基糖苷乙转移酶基因aac(6′)-Ib和喹诺酮类药物特异性外排泵基因qepA;QRDR突变基因包括编码DNA旋转酶的gyrA和编码拓扑异构酶Ⅳ的parC。备检基因引物序列[13]由生工生物工程股份有限公司(生工)合成(表1)。PCR反应体系及阴性对照的设立同1.2.1节。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸15~40 s(gyrA17 s,parC17 s,qnrA38 s,qnrB30 s,qnrD35 s,qnrS40 s,aac(6′)-Ib30 s,qepA15 s),30个循环;72 ℃终延伸10 min。对PCR产物进行1%琼脂糖凝胶电泳检测。将aac(6′)-Ib基因PCR产物送生工进行测序,并通过NCBI网站比对确定其亚型(aac(6′)-Ib-cr)。将gyrA和parC的PCR产物送至生工进行测序,将测序所得核酸序列通过ExPASy(https://web.expasy.org/protparam/)翻译为氨基酸序列,并通过DNAMAN软件与NCBI数据库录入的E.coli-k12的gyrA和parC氨基酸序列进行比对,分析QRDR突变情况。

表1 试验所用引物的信息Table 1 Sequences of primers used in this study
1.2.3 恩诺沙星(ENR)诱导试验 选取携带PMQR基因且QRDR未突变(2株)、不携带PMQR基因且QRDR未突变(2株)的大肠杆菌在含ENR的LB液体培养基中进行诱导,ENR初始诱导质量浓度为0.25 μg/mL,若菌株生长良好,第2天ENR浓度2倍递增继续诱导,以此类推直至第10天;以在不加ENR的LB液体培养基中培养至第10天的菌株作为对照。PCR扩增诱导和对照菌株的gyrA、parC基因,将PCR产物送至生工测序后比对分析gyrA和parC基因是否发生突变。
2 结果与分析
2.1 大肠杆菌的鉴定及药敏试验结果
试验共分离到75株菌,经PCR检测均扩增到468 bp的phoA基因,故确定其均为大肠杆菌,部分大肠杆菌phoA基因的鉴定结果见图1。
M.DNA Marker;1~8.分离菌株;9.阴性对照M.DNA Marker;1-8.Isolated strains;9.Negative control图1 牛源分离菌株phoA基因的PCR扩增(部分结果)Fig.1 PCR amplification of phoA gene from bovine isolated strains (partial results)
MIC试验结果(表2)表明,60.00%(45/75)的菌株对至少2种FQs耐药,其中40.00%(30/75)的菌株对ENR、CIP、NOR均耐药,且对ENR的耐药程度较为严重(60.00%)。
2.2 PMQR基因及QRDR突变检测结果
PMQR基因PCR扩增结果表明,75株大肠杆菌均未检测到qnrA、qnrD、qepA,检测出qnrS(642 bp)、aac(6′)-Ib亚型aac(6′)-Ib-cr(482 bp)和qnrB(469 bp),部分菌株的PMQR基因检测结果见图2。61.33%(46/75)的大肠杆菌菌株至少携带1个PMQR基因,其中以qnrS(45.33%,34/75)和aac(6′)-Ib-cr(21.33%,16/75)最为常见(表2)。
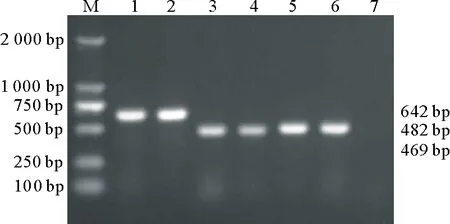
M.DL2000 DNA Marker;1,2.qnrS基因;3,4.qnrB基因;5,6.aac(6′)-Ib-cr基因;7.阴性对照M.DL2000 DNA Marker;1,2.qnrS gene;3,4.qnrB gene;5,6.aac(6′)-Ib-cr gene;7.Negative control图2 牛源大肠杆菌PMQR基因的PCR扩增(部分结果)Fig.2 PCR amplification of PMQR gene from bovine E. coli (partial results)
GyrA和ParC氨基酸序列比对分析的部分结果如图3所示。

a.ParC氨基酸比对;b.GyrA氨基酸比对。1.E.coli-k12;2~10.不同的菌株。S.丝氨酸,D.天冬氨酸,L.亮氨酸,N.天冬酰胺,Y.酪氨酸,I.异亮氨酸,E.谷氨酸,G.甘氨酸a.ParC amino acid alignment;b.GyrA amino acid alignment.1.E.coli-k12;2-10.Different strains.S.Serine;D.Aspartic acid,L.Leucine,N.Asparagine,Y.Tyrosine,I.Isoleucine,E.Glutamic acid,G.Glycine图3 牛源大肠杆菌parC和gyrA基因编码氨基酸的突变分析(部分结果)Fig.3 Mutation analysis of amino acids encoded by parC and gyrA genes from bovine E.coli (partial results)
由表2可知,58.67%(44/75)的大肠杆菌发生了QRDR突变;43株菌发生了GyrA氨基酸的突变,其中90.70%(39/43)为Ser83Leu+Asp87Asn突变,6.70%(3/43)为Ser83Leu+Asp87Tyr突变,2.33%(1/43)为Ser83Leu单突变;43株菌发生了ParC氨基酸突变,其中93.02%(40/43)为Ser80Ile单突变,6.98%(3/43)为Ser80Ile+Glu84Gly突变。在发生QRDR突变的大肠杆菌中,有95.45%(42/44)的菌株同时发生了GyrA和ParC氨基酸突变,其中最常见的突变组合为GyrA:(Ser83Leu+Asp87Asn)+ParC:Ser80Ile。

表2 75株牛源大肠杆菌的耐药表型、PMQR基因及QRDR突变检测结果Table 2 Results of resistant phenotypes,PMQR genes,and QRDR mutations in 75 E.coli strains
分析75株大肠杆菌的耐药表型与PMQR基因及QRDR突变的关系,结果表明发生QRDR突变且携带PMQR基因的菌株对ENR、CIP、NOR均耐药;PMQR基因单独存在的菌株耐药性不强,但是QRDR突变与PMQR基因共存时,NOR、ENR和CIP的MIC较仅发生QRDR突变的菌株分别增加了4~32,4~16和2~16倍(表2)。
2.3 恩诺沙星诱导结果
恩诺沙星(ENR)诱导试验结果表明,携带PMQR基因且QRDR未突变的1株菌,在ENR诱导第2天时gyrA基因第521、539位的碱基由T变为C,另1株菌在诱导第3天时gyrA基因第567、599位的碱基由C变为T、第513位的碱基由T变为G;对照菌株仅在培养第2天时有1株菌gyrA基因第521位的碱基由T变为C,另1株菌gyrA基因第599位的碱基由C变为T。以上碱基突变并未引发氨基酸突变,为沉默突变。携带PMQR基因且QRDR未突变的菌株,经恩诺沙星诱导后parC基因未发生突变。不携带PMQR基因且QRDR未突变的菌株,在恩诺沙星诱导后未发生任何突变。
3 讨论与结论
自1960年以来,在临床上由大肠杆菌引起的疾病多使用FQs治疗[13],该类抗生素主要通过抑制细菌DNA旋转酶和拓扑异构酶-IV的活性而抑制细菌DNA合成,从而发挥抑菌作用[14]。研究表明,随着FQs的大量使用甚至滥用,多数病原体对FQs的敏感性逐渐降低[15-17],导致临床治疗面临极大的挑战。本试验从腹泻犊牛粪便中分离得到75株大肠杆菌,其中60.00%(45/75)的菌株至少耐2种FQs,40.00%的菌株对ENR、CIP、NOR均耐药,其中对ENR的耐药程度较为严重(60.00%),这可能与ENR作为动物专用药在养殖场使用较为频繁有关。
QRDR突变是大肠杆菌耐FQs的主要原因,其主要通过抑制FQs与细菌DNA和酶复合物的结合,导致细菌耐药。gyrA基因编码的氨基酸突变位点通常为第67~106位[18-19],parC基因编码的氨基酸突变位点通常发生于第71~110位[20]。研究表明,gyrA基因编码的第83、87位以及parC基因编码的第80、84位氨基酸的突变与FQs耐药密切相关[21-22]。本研究结果显示,牛源大肠杆菌有58.67%(44/75)发生了QRDR的突变,其中95.45%(42/44)的菌株同时发生了GyrA和ParC氨基酸突变。赵凤菊等[23]研究表明,动物源大肠杆菌GyrA氨基酸突变主要为Ile87Val、Leu101Met,ParC氨基酸突变主要为Ser80Ile;曹立亭等[24]研究表明,养殖环境中大肠杆菌的GyrA突变以Ser83Leu、Asp87Asn最常见。Nishikawa等[25]研究表明,日本鸡源大肠杆菌GyrA突变以Ser83Leu、Asp87Asn为主,ParC以Ser80Ile最盛行。综上可知,QRDR突变多出现在GyrA、ParC的氨基酸上,且以GyrA第83、87位及ParC第80位居多,与本试验结果一致。
虽然PMQR基因仅导致大肠杆菌对FQs低水平耐药,但由于其通过质粒介导,可以在不同菌株甚至不同种属间水平转移[13],这对人类和动物的健康来说都是一个不可忽视的隐患。本研究结果表明,61.33%的大肠杆菌至少携带1个PMQR基因,其中qnrS和aac(6′)-Ib-cr基因最常见;并且存在多个PMQR基因共存于同一分离株中的现象,这在很大程度上提高了大肠杆菌对FQs的抗性,这与Wu等[2]及Mitra等[18]的研究结果一致。此外,QRDR突变与PMQR基因共存菌株比仅有QRDR突变菌株对FQs的耐药性更强,QRDR突变与qnrS+aac(6′)-Ib-cr共存的菌株比单独携带qnrS或aac(6′)-Ib-cr的菌株MIC更高,这与Piekarska等[26]的报道一致。
gyrA、parC是QRDR最容易发生突变的2个基因,已有研究表明含PMQR基因的接合子在CIP诱导后会出现GyrA蛋白第83、87位氨基酸突变[16]。本研究通过ENR诱导试验发现,PMQR阳性菌的gyrA基因出现5处碱基突变,且皆为沉默突变,未出现相应氨基酸的突变,表明在低剂量ENR存在的情况下,PMQR基因的存在一定程度上会影响gyrA基因序列的稳定性。PMQR阴性菌未发生突变。
以上结果表明,QRDR突变是大肠杆菌耐FQs的主要原因,PMQR基因仅赋予其低FQs抗性,但QRDR突变与PMQR基因共存一定程度上会加重耐药菌的耐药程度;此外,PMQR基因会增加gyrA基因序列的突变机率,尤其是ENR存在的情况下。因此临床上合理使用该类药物就显得十分必要,一旦造成致病性大肠杆菌发生QRDR突变,将可能导致该类药物治疗无效。

