非洲猪瘟病毒p72蛋白的原核表达和多克隆抗体制备
陈金凤,乐 伟,何 永,吴丽琴,贾宝玉,邓小淇,胡睿铭,黄冬艳,宋德平,邬向东,吴 琼,唐玉新,丁 珍
(江西农业大学 动物科学技术学院,江西 南昌 330045)
【研究意义】非洲猪瘟(african swine fever,ASF)是由非洲猪瘟病毒引起的一种急性、高度接触性传染病。自1921年肯尼亚首次报道非洲猪瘟疫情后,该病在非洲大陆蔓延,随后传入欧洲和南美洲,2018年我国辽宁首次出现ASFV疫情,至今世界各地仍有疫情爆发的报道[1]。ASF被我国列为一类动物疫病,被世界动物卫生组织(world organization for animal health,OIE)列为A 类动物疫病,一旦出现必须上报。【前人研究进展】非洲猪瘟病毒(ASFV virus,ASFV)有介于痘病毒和虹彩病毒的特征,为一个新科,国际病毒分类委员会将其列入非洲猪瘟病毒属,ASFV 为唯一已知代表种[2]。ASFV 为单分子线性双链DNA 病毒,也是一种虫媒病毒。ASFV 基因组全长170~190 kb,含151 个开放阅读框,可编码150~200 种蛋白质[3]。ASFV基因编码的结构蛋白约有50种,包括囊膜蛋白CD2v、p30、p54;衣壳蛋白p72、p49;核壳蛋白多聚蛋白前体pp20和pp62;DNA 结合蛋白p10、pA104R[4]。【本研究切入点】B646L基因编码的p72蛋白,是ASFV的主要衣壳蛋白,蛋白大小约为73.2 ku,产生于病毒感染晚期,为病毒参与结合细胞的重要蛋白,其表达常作为病毒复制的标志[5]。Mallory Elizabeth[6]绘制的氨基酸重叠图中可知,在氨基酸1至171中,含有2个抗原表位,分别在160-165和165-171氨基酸肽段中,在图1中的C端被蓝色方格标记。【拟解决的关键问题】笔者根据ASFV AuhuiXCGQ毒株序列(GenBank登录号:MK128995.1)合成了ASFV p72全长基因,利用分子克隆技术构建了pET-28a-ASFV-p72 和pET-28a-ASFV-p72(1-171aa)原核表达质粒。通过E.coli原核表达系统获的p72全长和1-171aa融合蛋白,使其作为抗原免疫日本大耳白Balb/C兔,获得高效价兔源多克隆抗体,为非洲猪瘟血清学检测的发展提供依据。
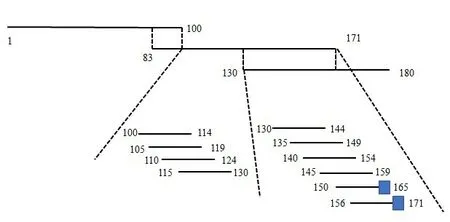
图1 p72截短蛋白抗原表位Fig.1 Antigenic epitope of truncated protein p72
1 材料和方法
1.1 试验材料
1.1.1 细胞、质粒和试验动物 HEK 293T细胞购自ATCC细胞库;日本大耳白Balb/C兔由武汉戴安生物技术有限公司提供;pET-28a 原核表达载体和pCAGGS-myc 真核表达载体皆由本实验室保存;ASFV(MK128995.1)p72全长基因同时5'端携带GAATTC(EcoRI)3'端携带GAGCTC(Xho I)的基因序列委托苏州金唯智生物科技有限公司设计与合成。
1.1.2 主要试剂EcoRI、XhoI 内切酶购自NEB 公司;T4 DNA Ligase 和DNA Marker 购自TaKaRa 公司;胶回收试剂盒(Gel Extraction Kit)购自Omega 公司;TOP10、BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;His 蛋白纯化试剂盒由上海生工生物工程技术服务有限公司提供;SDS-PAGE 凝胶试剂盒购自武汉塞维尔生物科技有限公司;PVDF 膜由Millipore 公司提供;极超敏ECL 化学发光试剂盒购自上海碧云天生物技术有限公司;DAPI 购自Thermo Fisher 公司;PE 标记的羊抗兔抗IgG 和HRP 标记的羊抗兔IgG购自全式金生物技术有限公司。
1.2 试验方法
1.2.1 质粒构建 笔者设计了p72(1-171aa)基因的特异性引物(表1),以合成的p72 全长基因为模板,PCR 扩增目的基因,胶回收反应产物,经EcoRI 和XhoI酶切并纯化,与经相同酶切处理的pET-28a 载体连接,产物转化至TOP10 感受态细胞。挑取单个菌落扩大培养,质粒小提试剂盒提取pET-28a-p72(1-171aa)质粒。而pET-28a-p72 和pCAGGS-myc-p72 则皆为通过EcoRI 和XhoI 酶,与分别pET-28a 和pCAGGS-myc 连接形成。通过双酶切提取的质粒DNA 和北京擎科新业生物技术有限公司进行测序,鉴定构建的质粒为正确。
1.2.2 蛋白的表达和纯化 将鉴定正确的重组质粒pET-28a-p72及pET-28a-p72(1-171aa)和pET-28a空载质粒分别转化入BL21(DE3)感受态细胞中,挑取单个菌落,摇菌扩大培养,加入终浓度为1 mmol/L的IPTG诱导目的蛋白表达,37 ℃摇床上180 r/min诱导4 h,设置未诱导为对照。诱导结束后,5 000 r/mim离心10 min,弃上清用PBS 重悬,超声波破碎处理。离心后收集上清,加入上样缓冲液,沸水煮10 min,通过SDS-PAGE 凝胶跑蛋白电泳查看目的蛋白表达情况。扩大诱导的蛋白通过His 标签纯化试剂盒进行纯化。
1.3 多抗制备
将纯化的蛋白作为抗原免疫2只2~3月龄日本大耳白Balb/C兔,第1次主注射使用弗氏完全佐剂,以后加强注射使用弗氏不完全佐剂,均与等体积抗原充分混匀后背部多点注射,免疫程序见表2。
1.4 抗体效价检测
按照间接ELISA 方法对免疫后获得的血清进行效价检测:用抗原包被液将纯化后的重组ASFV p72 蛋白进行稀释,加入酶标板,4 ℃过夜包被,第2 天弃液并用新配制的PBST 洗涤3 遍,排干板内液体,加入5%脱脂奶粉进行封闭液,37 ℃培养箱封闭2 h,封闭结束后PBST 洗3 遍,拍干待用。将2 种血清按1∶100×20~1∶100×213倍比稀释后,加入酶标板,37 ℃孵育1 h,孵育结束弃液,洗涤拍干(同上),再向其中加入1∶2 500 倍稀释的HRP 带标记的羊抗兔IgG,37 ℃孵育1 h 后弃液,洗涤拍干(同上),最后加入TMB显色液37 ℃避光反应15 min,浓硫酸终止反应后使用酶标仪于OD450检测吸光度。
1.5 间接免疫荧光检测
将p72 基因与pCAGGS-myc 真核表达载体连接,使用pCAGGS-myc-p72 和pCAGGS-myc 空载分别转染HEK 293T细胞,24 h后PBS清洗3次,使用4%的多聚甲醛在室温下固定细胞15 min,PBS洗3次后,用低温无水甲醇透化处理15 min,之后PBS 洗3 次,使用10%的牛血清白蛋白(BSA)封闭,PBS 清洗3 次后加入1∶100稀释的多抗血清作为一抗,37 ℃孵育1 h,PBS将未结合上的一抗清洗后,加入PE标记的羊抗兔二抗孵育避光30 min,接着PBS清洗3遍,加入DAPI室温避光孵育15 min,PBS清洗3遍后于荧光显微镜观察结果。
1.6 Western blot检测
将pCAGGS-myc-p72 和pCAGGS-myc 分别转染于12 孔细胞培养板培养的HEK 293T 细胞,28 h 后收集细胞。取1.5 mL EP 管,加入1 mL RIPA 细胞组织裂解液和10 µL PMSF 蛋白酶抑制剂,混匀后每孔加入100 µL,冰上孵育20 min,12 000 r/min,4 ℃离心10 min,吸取上清加入5×Loading Buffer 于沸水中煮10 min。进行SDS-PAGE 电泳,然后湿转于PVDF 膜,转膜结束后,将膜浸于含5%脱脂奶粉的TBS溶液中37 ℃封闭2 h,TBST 于摇床上清洗3 次,每次10 min。将2 种血清1∶1 000 稀释作为一抗,孵育4 h后TBST 清洗3 次,每次10 min,使用HRP 标记的羊抗兔二抗(1∶2 500 稀释)孵育45 min,TBST 清洗3 次,每次10 min,通过ECL化学发光液将膜于化学曝光仪上曝光。
2 结果与分析
2.1 重组表达载体的构建
笔者构建了pET-28a-ASFV-p72 和pET-28a-ASFV-p72(1-171aa)原核表达质粒,和pCAGGS-mycp72真核表达质粒,通过双酶切重组质粒,琼脂糖凝胶结果p72全长基因显示在1 941 bp(图2A和图2C),p72截短突变体显示在513 bp处(图2B),符合预期结果。
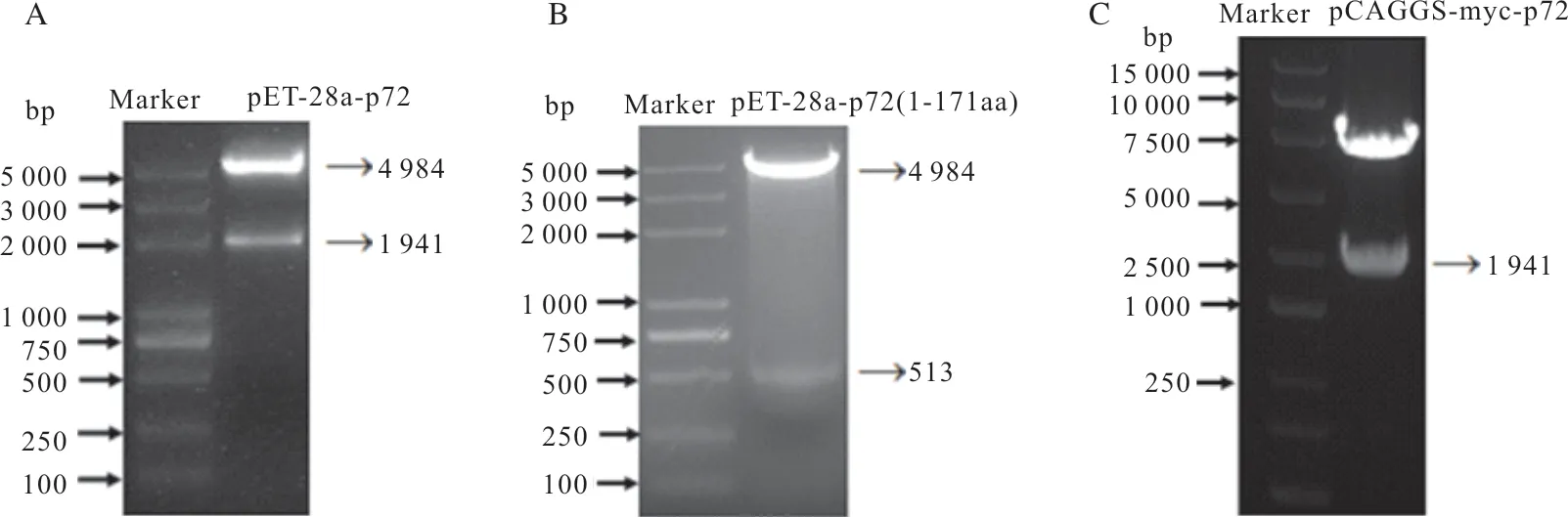
图2 重组质粒的双酶切鉴定Fig.2 Identification of the recombination plasmid by restriction enzymes digestion
2.2 p72及1-171aa蛋白的表达与纯化
构建成功的pET-28a-ASFV-p72 和pET-28a-ASFV-p72(1-171aa)表达质粒转化入BL21 感受态细胞中,添加IPTG 诱导4 h 后,收取细胞样品,并进行SDS-PAGE 分析,结果发现p72(图3A)和p72(1-171aa)(图3B)均出现明显的条带,分别在75.9 ku和23.7 ku处,未诱导及pET-28a空载则没有条带。p72和p72(1-171aa)蛋白通过His 标签纯化试剂盒进行纯化,并进行SDS-PAGE 分析,结果纯化得到p72(图3C)和p72(1-171aa)(3D)蛋白。

图3 重组蛋白的诱导表达与纯化Fig.3 Expression and purification of recombinant protein
2.3 多克隆抗血清的效价测定
用抗原包被液将纯化后的重组ASFV p72 蛋白进行稀释并包被酶标板,分别以抗p72 的兔血清、抗p72(1-171aa)的兔血清和阴性血清作为一抗,按1∶100×20~1∶100×213倍比稀释加入。以HRP 带标记的羊抗兔IgG为二抗,加入TMB 显色液反应,并通过浓硫酸终止反应。OD450检测吸光度发现抗p72和抗p72(1-171aa)2 种兔血清的效价皆大于1∶100×213,即1∶819 200。
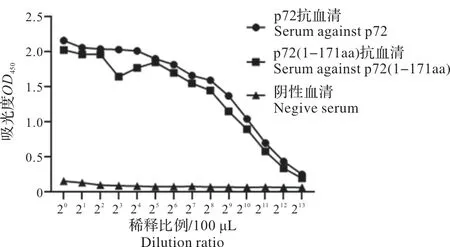
图4 2种抗血清的效价测定Fig.4 Determination of titer of two anti-serums
2.4 多克隆抗体的特异性
为检测获得的多抗的特异性,将pCAGGSmyc-p72 和pCAGGS-myc 转染至HEK 293T 细胞,分别将抗p72 和抗p72(1-171aa)2 种多抗血清作为一抗,进行Western blot 分析和间接免疫荧光检测,结果如图,Western blot 分析结果显示,抗p72(图5A)和抗p72(1-171aa)(图5B)2 种多抗血清皆可识别蛋白大小约为75.9 ku 的条带;间接免疫荧光检测结果显示,2种多抗可特异性识别HEK 293T细胞中表达的p72蛋白(图5C和5D)。
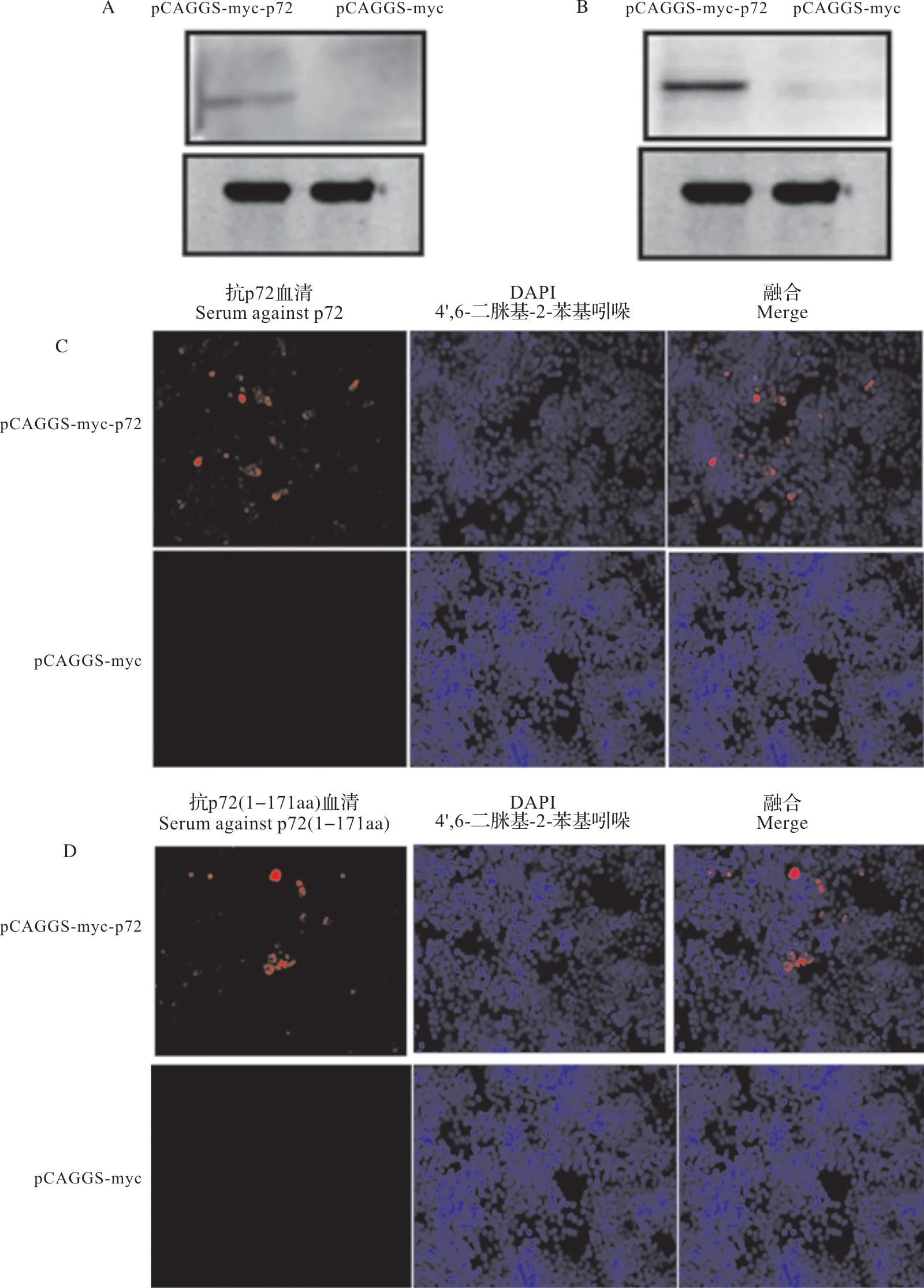
图5 多克隆抗体的特异性验证Fig.5 Specificity verification of polyclonal antibodies
3 结论与讨论
到目前为止,非洲猪瘟已经给我国养猪业造成了极大的损失。我国非洲猪瘟病毒的扩散主要由调运感染猪、感染猪的肉制品及泔水、野猪及软蜱交叉传播,其中调运感染病毒的猪为主要的扩散原因[7]。野猪与软蜱的交叉传播也使得病毒的净化工作变的困难。非洲猪瘟病毒的早期诊断对其有效防控至关重要。目前非洲猪瘟病毒的检测方法有红细胞吸附实验(hemoadsorption test,HAD)、聚合酶链式反应技术(polymerase chain reaction,PCR)、环介导恒温扩增技术(loop-mediated isothermal amplification,LAMP)、荧光抗体实验等,不同诊断技术的联合应用将会是非洲猪瘟诊断的发展趋势[8]。本试验制备的抗p72多克隆抗体可运用于胶体金检测试纸条的制备,而胶体金检测试剂条具有方便快捷等优点,为ASFV 的诊断提供新方法。
常见的血清学诊断利用VP73、p54、p30及p72等蛋白制备抗体。VP73蛋白能够在自然感染中诱发,且在MS细胞中传代后抗原性稳定;p54蛋白在上清表达,有利于纯化,但其为跨膜蛋白,全长蛋白无法在大肠杆菌中表达;p30 蛋白在病毒DNA 合成前就开始表达,针对p30 蛋白产生的抗体可以阻止病毒内吞[1,9-10]。有研究评估了针对p72、p30、p52 3 种蛋白的中和抗体在免疫保护中的作用,结果3 种仅在感染早期表现临床疾病发作延迟和降低的病毒血症水平的作用,其不足以进行抗体介导的保护,这也许是目前尚无有效ASF 疫苗的重要原因之一[11]。尽管无法进行抗体介导的保护,p72蛋白的强抗原性使其足够应用于操作简单、准确性高的血清学诊断方法,以提供ASFV疫情诊断的参考[12]。
本研究通过设计引物合成p72 基因,构建pET-28a-ASFV-p72 和pET-28a-ASFV-p72(1-171aa)重组质粒,表达出2 种蛋白,纯化后免疫兔获得多抗血清,对获得的血清进行Western blot 和间接免疫荧光试验,检测该多抗的特异性,结果显示特异性良好。p72 蛋白在病毒感染时可有效诱导机体产生中和抗体,且在线软件预测筛选发现B淋巴细胞优势表位为12-18、27-37、45-55、77-88、110-120位置[13]。本试验构建的p72 截短突变体1-171 包含了这些预测的所有B 淋巴细胞优势表位,同时也包涵了160-165、165-171 等已经报道的抗原表位,本研究也证实该区间段氨基酸免疫大白兔能够产生良好的免疫原性。全长蛋白及1-171截短片段可为ASFV相关血清学诊断方法奠定基础。
目前已有研究[14-16]通过构建真核表达载体如杆状病毒表达系统、缺陷型重组腺病毒和重组新城疫等表达了亲和力与反应性高的p72 蛋白。虽然本研究通过E.coli原核表达系统表达并纯化了p72 和1-171aa 融合蛋白,制备了抗p72 和1-171aa 的多克隆抗体,但制备的多克隆抗体效价高、且能与真核表达的p72发生良好的反应,可运用于后续诊断试剂的开发。

