菜心重要农艺性状与SSR分子标记的关联分析
严少杰
(广州大学生命科学学院,广东广州 510006)
菜心(Brassica campestrisL.ssp.chinensisvar.utilisTsen et Lee)有“蔬菜之冠”的美誉[1],是华南地区的标志性蔬菜,栽培历史超过百年;菜心风味独特,营养价值高,深受消费者喜爱。培育出高产且优质的菜心品种,是菜心育种工作者的重要目标。现阶段菜心育种仍以系统选育和杂交选育为主[2]。目前,利用这些传统育种方法选育出了一些菜心品种[3-5],但育种周期长、效率低[6]。因此,需要开发更加优质的育种手段来加快菜心高产优质品种的选育。近年来,分子标记辅助育种技术为菜心优良品种的选育提供了便利,不仅可以加快育种进程,而且可以定向地优化目标性状。
分子标记辅助育种涉及构建家系群体的连锁分析和构建自然群体的关联分析两种分析方法。其中,关联分析无需构建作图群体,与连锁分析的数量性状基因座(quantitative trait locus,QTL)定位相比,在一定程度上缩短了育种周期;关联分析利用的是自然群体材料,可检测同一座位上的多个等位基因,具有遗传背景丰富及分辨率高的优势。因此,相比QTL 定位,关联分析具有更大的潜力发现复杂性状所涉及的多基因及它们之间的相互关系[7]。关联分析在植物研究中起步较晚,目前,利用该方法已经在水稻[8]、棉花[9]、烟草[10]等植物育种中取得了显著成绩。但该方法在菜心上的应用较少,目前仅见夏岩石等[11]利用SSR 标记对菜心品质性状进行关联分析,尚未见利用关联分析对菜心经济性状进行研究的报道。鉴于此,本研究以148 份菜心种质的自然群体为研究材料,并测量其株高、株质量、薹高、薹质量和薹粗5 个经济性状,然后结合SSR 标记的群体基因分型结果,开展关联分析,探测与这些经济性状相关的优异变异位点,并筛选典型载体材料,为菜心分子标记辅助育种提供一定的技术和数据支撑。
1 材料与方法
1.1 材料
供试的148 份菜心种质材料,由广州市农业科学研究院(107 份)和广州大学作物抗逆境中心(41 份)提供,材料的编号、名称和熟性等信息详见表1。

表1 菜心种质材料的信息Table 1 Information of B. campestris materials

续表1

续表1
1.2 试剂与设备
DNA 提取所用试剂1%β-巯基乙醇、十六烷基三甲基溴化铵(CTAB)提取液、氯仿、异戊醇、70%乙醇、6 μL 10 mg/mL 的RNase A)、PCR 反应试剂(10×PCR Buffer、TaqDNA 聚合酶)以及电泳所用试剂(10×TBE 缓冲液、琼脂粉、聚丙烯酰胺粉),均购自生工生物工程(上海)股份有限公司。
电泳槽及电泳仪,MGV-216-33 双面三倍宽垂直电泳槽及电泳仪,美国CBS 公司;微孔板分光光度计,Nano DropTM分光光度计,Thermo ScientificTM;BenQ M 800 扫描仪,明基BenQ;EDC-810 基因扩增仪,北京东胜创新生物科技有限公司;卷尺、游标卡尺、电子秤等。
1.3 试验设计及重要农艺性状的调查
148 份菜心种质材料于2018 年7 月10 日和10 月24 日分别在宁夏银川市园艺产业园和广州市农业科学研究院南沙试验基地播种及种植,种质种植区域均长2 m、宽1 m,常规水肥管理。待菜心长至“齐口花”时期,每份材料随机选取3 株,测定其株高、株质量、薹高、薹质量及薹粗5 个重要农艺性状。
株高(PH,cm):用卷尺在采收期测定地面到植株顶部的高度。
株质量(PW,g):用电子秤在采收期测定植株去除根部的质量。
薹高(SH,cm):用卷尺在采收期测定菜薹到植株顶部的高度。
薹质量(SW,g):用电子秤在采收期测定薹部以上的质量。
薹粗(SD,cm):用游标卡尺在采收期测定菜心薹径基部的宽度。
1.4 基因分型
采用李荣华等[12]改进的CTAB 法提取菜心材料的DNA,采用琼脂糖凝胶电泳检测DNA 质量、使用紫外分光光度计检测DNA 浓度,并将所提取的DNA 稀释至30 ng/μL,作为PCR 扩增模板。
用于本研究的147 对SSR 引物中,41 对CX 系列是根据本实验室菜心转录组测序数据设计的SSR 引物[13];106 对SLAF 系列是根据“3T6”和“四九-19 号菜心”基因组survey 测序数据设计的SSR 引物[14]。
PCR 反应体系总体积为10 μL,其中包含30 ng/μL的DNA 模板2 μL,10×PCR Buffer 1 μL,10 μmol/L的正反向引物各0.2 μL,10 mmol/L dNTPs 0.3 μL,Taq DNA 聚合酶(5 U/μL)0.1 μL,dd H2O 6.4 μL。
PCR 扩增程序为94 ℃预变性5 min,之后按94 ℃变性45 s、55 ℃45 s 和72 ℃延伸1 min 运行35 个循环,最后72 ℃充分延伸10 min,之后置于4 ℃条件下保存备用。
PCR 扩增产物采用6%非变性聚丙烯酰胺凝胶电泳分离,按照郭培国等[15]改良的银染技术显色,使用BenQ M 800 扫描仪扫描保存银染图片。
利用GelBuddy 软件对银染图片进行曝光度及图片角度等调整,使变异位点带更加直观,并对变异位点带进行判读,按1(有条带)、0(无条带)和2(数据缺失)统计各材料的基因分型数据。
1.5 农艺性状统计分析
运用SPSS 17.0 软件,分析计算农艺性状的平均值、标准偏差、变异系数。依据环境方差和遗传方差计算广义遗传率(H2)[16],计算公式见式(1)。

1.6 SSR 标记的多态性信息量和种质材料的亲缘关系计算
根据各标记的基因分型数据,利用PIC-Calc0.6 软件,计算各标记的多态性信息量(polymorphism information content,PIC),计算每个标记的PIC 平均值[16];利用SPAGeDi1.3d,并将其中所有负值设为0,计算各材料间的亲缘关系系数(K)[17]。
1.7 连锁不平衡及群体结构分析
用TASSEL 3.0 软件连锁不平衡分析功能,分析计算各种质材料对应的标记变异数据,得出标记的连锁不平衡(linkage disequilibrium,LD)信息[18],以D'(strandarized disequilibrium coefficients)衡量两两位点间的连锁不平衡关系。利用Sructure2.3 软件对菜心材料进行群体结构分析[16],K取值1~10,将MCMC(markov chain monte carlo)的不作数迭代(length of burn-in period)设为100 000 次,每个K值进行10 次计算。根据似然值最大原则选取最合理的K值,绘制菜心群体遗传结构图,并获得关联分析校正协变量(Q值)[19]。
1.8 关联分析及发掘优异等位变异
应用TASSEL 3.0 软件的混合线性模型(mixed linear model,MLM)程序,以群体结构(Q)矩阵为协变量、亲缘关系系数(K)为协变量,将农艺性状数据和标记变异数据进行MLM(Q+K)回归分析[17,20]。发现与菜心农艺性状密切关联的SSR 标记,并计算出标记位点对表型变异的解释率(R2);阈值选择以P<0.05 为显著水平,P<0.01 为极显著水平。以获得关联位点为基础,参考王娟等[21]的方法,计算与表型性状显著关联位点的表型效应值,得到与表型性状显著关联的位点等位变异、表型效应及典型品种。
2 结果与分析
2.1 菜心农艺性状的变异情况及性状间相关性测定
2018 年在银川和南沙种植的种质材料5 个重要农艺性状的统计数据见表2。由表2 中可知,菜心种质各材料的性状差异明显,变异范围较广。变异分析数据表明,在两地分别测定的5 个性状存在广泛的变异,5 个性状的平均变异系数为45.5%,变异范围为19.9%~73.9%;其中,南沙测定的薹质量变异幅度最大,达73.9%;银川测定的薹粗变异幅度最小,为19.9%;薹粗变异系数小于30%,低于其他性状的变异幅度。5 个性状的平均广义遗传率为44.4%,其中株高和薹高的广义遗传率超过50%,其余性状的广义遗传率低于30%,表明相比于其他性状,株高和薹高性状受环境影响较小。
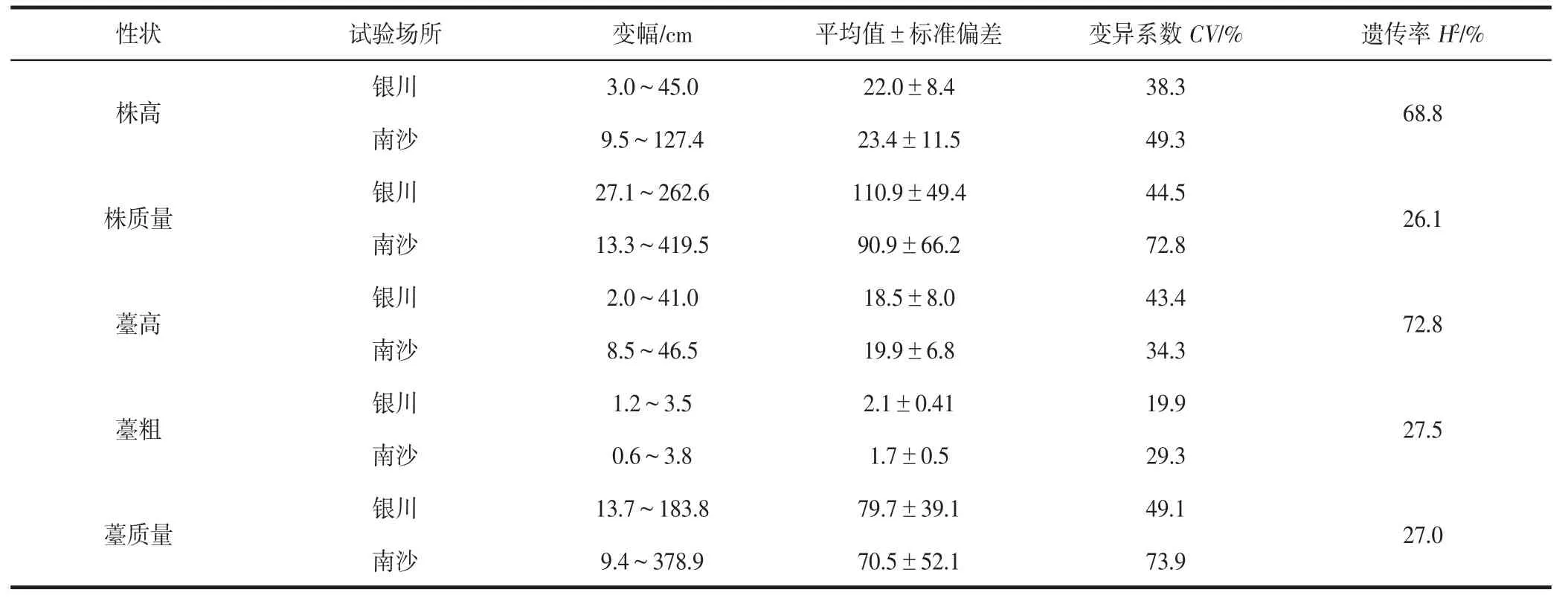
表2 菜心材料农艺性状变异统计Table 2 Variation of agronomic traits of B. campestris accessions
2.2 菜心SSR 位点遗传多样性评价
利用200 对SSR 引物扩增菜心种质DNA,发现147对SSR 引物多态性良好,条带清晰且重复性好。利用147对SSR 引物共检测到252 个等位变异位点,平均每个SSR 标记存在1.71 个等位变异(见表3),标记的多态性信息含量(PIC)为0.052 6~0.522 2,平均值为0.379 3。
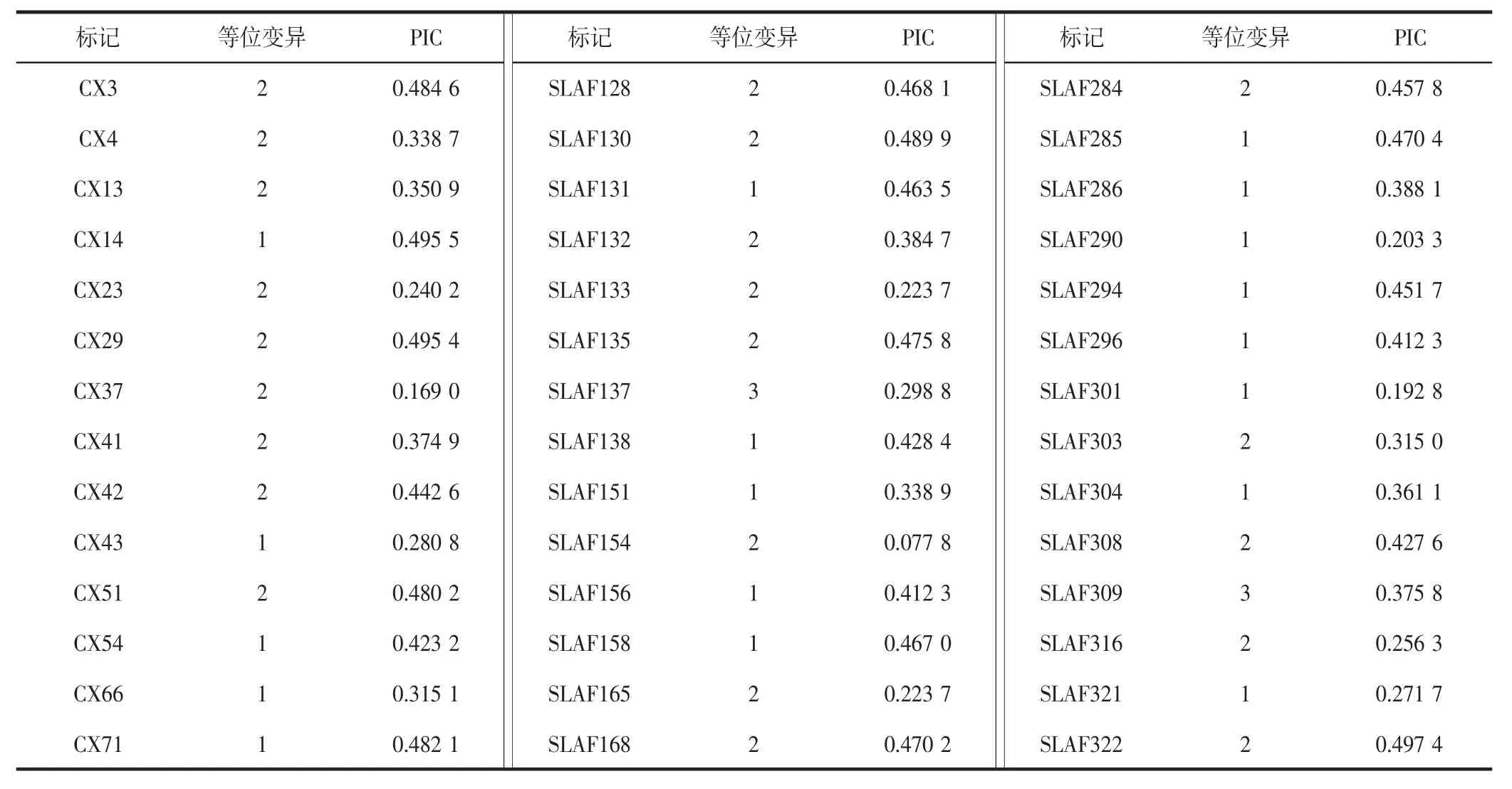
表3 147 对SSR 标记多样性统计Table 3 Diversity statistics of 147 SSR markers
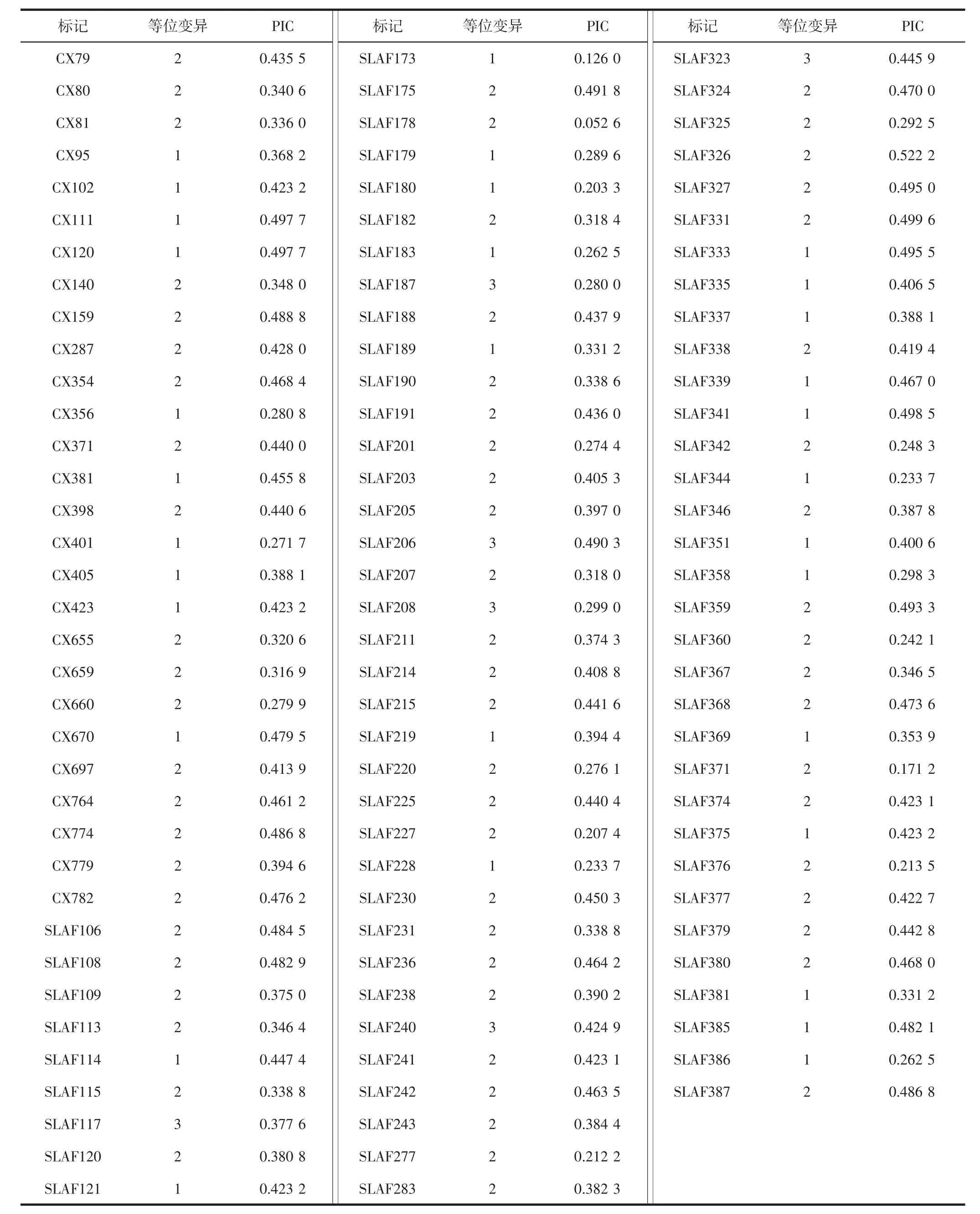
续表3
2.3 SSR 位点间的连锁不平衡分析
菜心基因组的SSR 位点间的连锁不平衡分析结果见表4(见第41 页)。在252 个位点的31 626 种组合中,进行显著统计学差异P<0.01 分析时,观察到连锁不平衡组合654 种,所占比例为2.1%。在0.2<D'≤0.4 的连锁不平衡位点组合最多,为300 种。
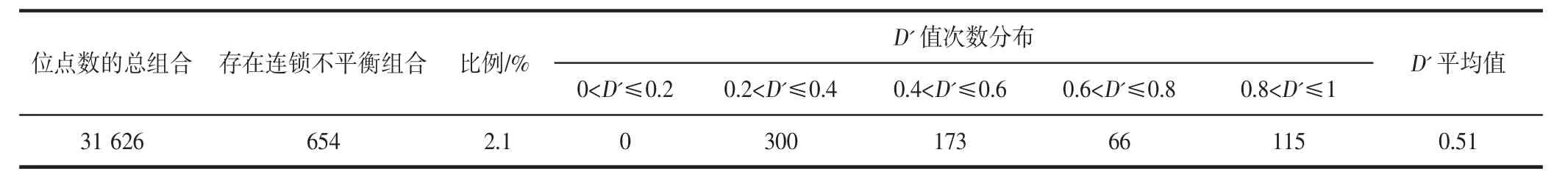
表4 SSR 位点间的连锁不平衡分析Table 4 Analysis of D' of LD for SSR loci
2.4 群体结构及亲缘关系分析结果
运用Structure 2.3 软件对148 份菜心材料进行群体结构分析,随着预测类群数K值的增加,LnP(D)持续增加且未出现明显的拐点(图1A)。以ΔK的最大值来确定K值的方法,经计算K=2 时,ΔK出现最大值和拐点(图1B),表明该群体最佳类群数为2。根据K=2 时构建的群体结构(见图2),148 份材料中类群I 有83 份,包括60份早熟材料和23 份中熟材料;其余的65 份材料在类群Ⅱ中,包括29 份早熟、30 份中熟和6 份晚熟材料。基于检测到的252 个变异位点,利用SPAGeDi1.3d 软件计算出148 份菜心种质材料的两两组合为10 878,亲缘关系系数小于0.05 的组合占到总组合的70.22%,亲缘关系系数为0 的组合占到总组合的52.99%。
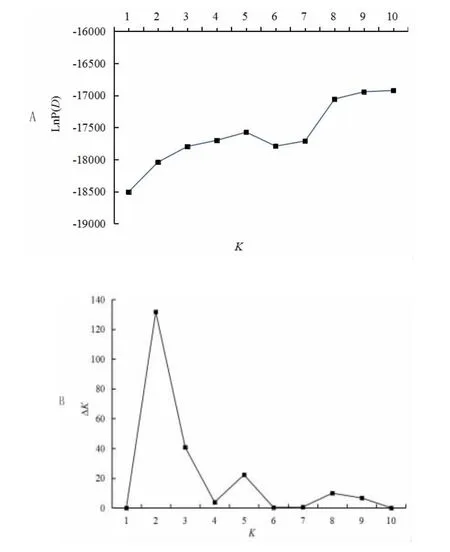
图1 K 值与lnP(D)、ΔK 值折线图Fig.1 Line chart of K with lnP(D) and ΔK
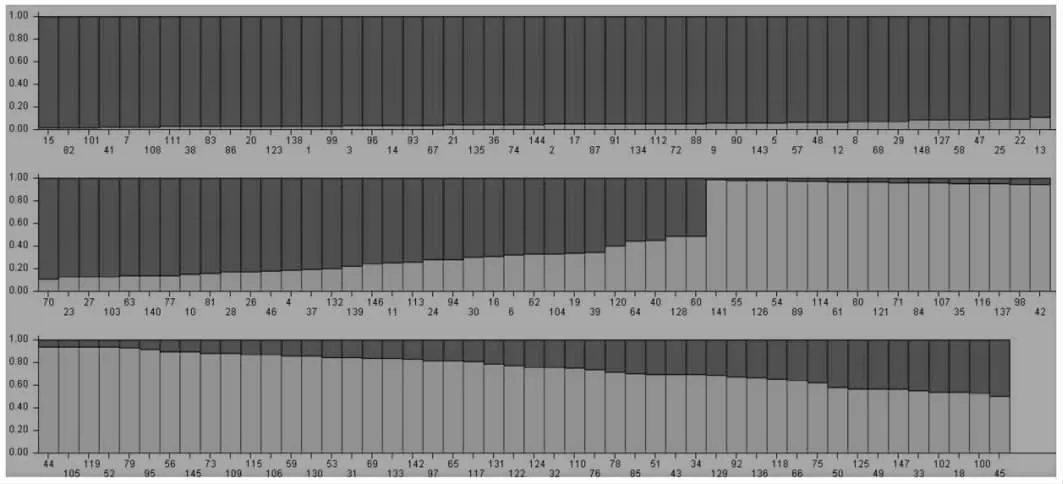
图2 148 份菜心材料群体结构图Fig.2 Population structure of 148 B. campestris accessions
2.5 农艺性状间与SSR 标记的关联
采用MLM(Q+K)模型,对SSR 标记和菜心性状进行关联分析,分析结果见表5。
由表5 可知,MLM(Q+K)模型中,在银川发现有9 个位点分别与株高(CX120-280)、薹高(CX140-185)、薹粗(SLAF277-230、SLAF283-280、SLAF308-320、SLAF309-240 及SLAF344 -285)、薹质量(SLAF277 -230 和SLAF308-320)在P<0.01 水平上极显著关联,其中两个位点为增效表型效应,其余位点为减效表型效应;在南沙发现的6 个位点分别与薹粗(SLAF283-280、SLAF308-320、SLAF309-240 及SLAF344-285)、薹质量(SLAF277-230 和SLAF308-320)在P<0.01 水平上极显著关联,所有位点均为减效表型效应。
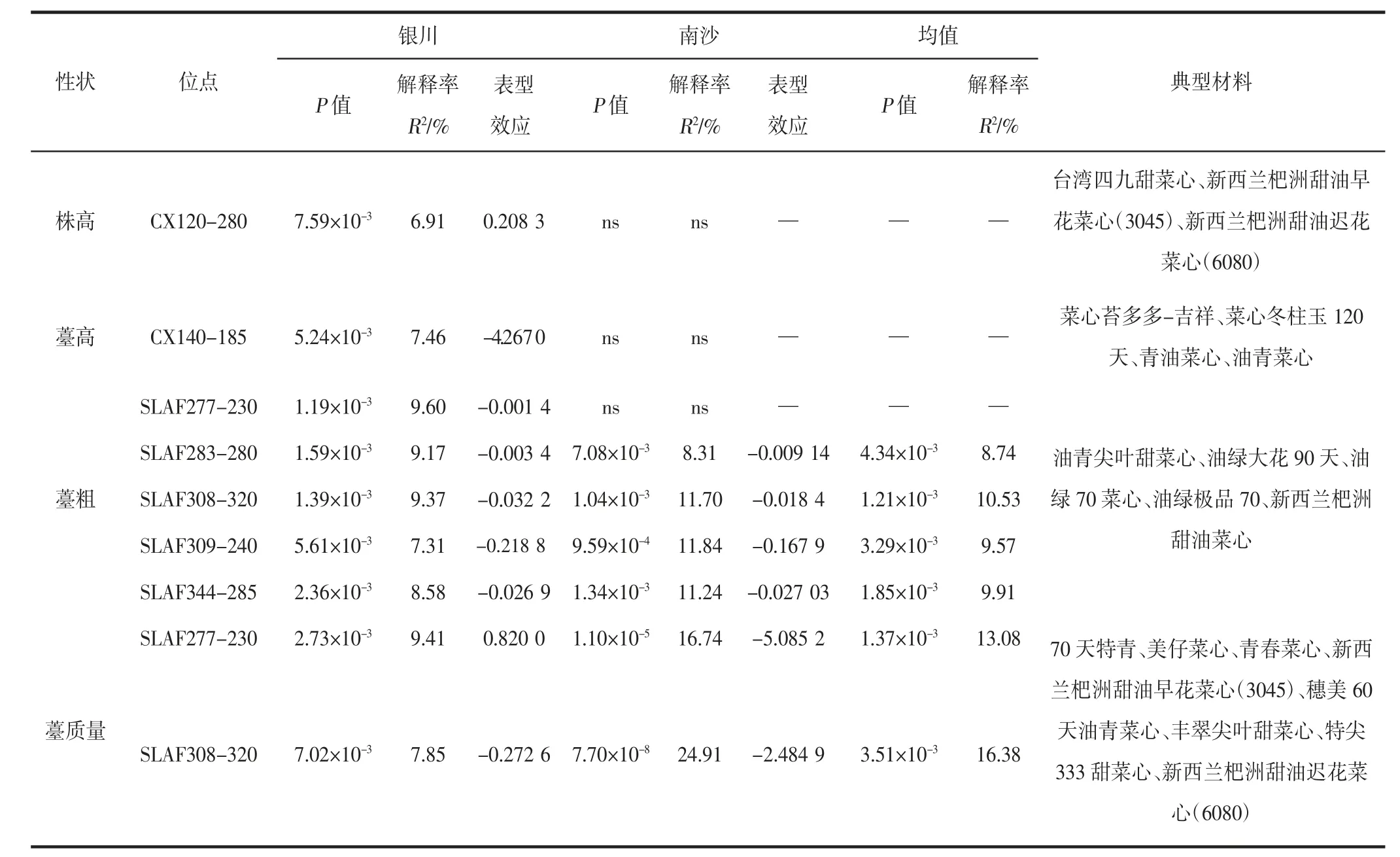
表5 与性状极显著相关(P<0.01)的SSR 标记位点及其对表型变异的解释率Table 5 The SSR locus associated with traits and their explained phenotypic variations (P<0.01)
两地菜心品种的变异位点与性状关联结果表明:位点对表型变异的两地解释率在银川为6.91%~9.6%,在南沙为8.31%~24.91%。银川和南沙两地在P<0.01 水平上有相同的位点与性状显著关联,它们是薹粗与SLAF283-280、SLAF308-320、SLAF309-240 及SLAF344-285,薹质量与SLAF277-230 和SLAF308-320,其中位点SLAF308-320 在银川和南沙两地均检测到与薹粗和薹质量两个性状在P<0.01 水平上极显著关联。
以位点显著相关的性状为依据,筛选出18 个典型材料,其中有5 个早熟品种,12 个中熟品种和1 个晚熟品种。
3 讨论
群体结构的存在影响等位变异位点连锁不平衡,导致关联分析的结果不准确。混合组群中群体结构的存在会增加等位变异位点的LD 值,影响关联分析的分率,可能导致性状与变异位点的假关联结果增加[22]。群体结构分析得到的协变量Q值可用于进行群体矫正,避免性状与标记间的假关联[19]。本研究利用252 个变异位点对供试菜心种质材料进行群体结构分析,经计算K=2 时,ΔK出现最大值和拐点以及LnP(D)未出现明显拐点,将148份菜心群体分为两个组群。早熟及中熟品种分到两个不同类群,而晚熟品种均分到类群II。从早、中、晚熟品种的分类群的情况来看,组群与菜心熟性有一定的相关性。群体结构分析的结果显示,所选菜心材料群体结构简单,来源比较单一。可能是因为菜心起源于华南地区,是白菜的一个变种,且菜心育种上多采用系统方法,部分良好的菜心品种多用于杂交选育,从而导致菜心遗传背景狭窄[6]。
植物的重要性状多为数量性状[23],性状的最终表达由基因和环境相互影响。关联分析是以基因或标记间存在连锁不平衡为基础,通过软件分析检测遗传标记与目标自然群体性状相关性的分析方法[19]。与连锁分析相比,关联分析以自然群体作为材料进行研究,节省了构建群体的时间,且关联作图的精度高[23],可在较短时间获悉标记与性状间的关系。本试验将菜心材料分别种植于南沙和银川两地,对菜心的5 个农艺性状进行测量,随后对两地表型数据与发现的SSR 位点数据进行关联分析。对所选的5 个性状进行变异分析,结果显示,5 个性状的平均变异系数为45.5%,在南沙采集到的菜心样品变异系数较大,与早熟菜心在秋季测得的薹质量变异较大的研究结果一致[24],供试菜心品种间的遗传差异较大。采用MLM(Q+K)模型对标记和作物性状进行关联分析,对菜心表型性状和252 个SSR 标记位点进行关联分析,发现了6个位点在银川和南沙两地均检测到与相同性状在P<0.01水平上显著关联。其中标记SLAF308-320 与薹粗及薹质量两个性状显著关联,与在野生大豆[25]、海岛棉[26]及玉米[27]上发现的SSR 标记同时与2 个或以上性状相关联的情况类似,提示菜心性状间可能存在的遗传相关或基因多效性即一因多效的遗传基础。MLM(Q+K)模型的关联分析结果表明,这6 个位点可能是不受环境影响的稳定标记,有报道称MLM(Q+K)可以有效抑制加关联的产生,是群体关联分析最佳模型[28]。
自Thornsberry 等[29]首次在植物上运用关联分析发现dwarf 8 基因上的几个多态位点与玉米开花期的变异显著关联,随后关联分析被广泛用于探究与植物性状和标记间的关系。在菜心群体遗传研究中,有学者通过标记开展了对菜心分子遗传的探究[11,30]。而在其他作物如水稻[31]、小麦[32]等上,已经运用分子标记辅助选择对作物育种进行筛选培育,加速了新品种的培育进程。分子标记辅助选择育种的首要前提是有与作物性状相关的候选标记,而关联分析是快速发掘候选标记的有力手段。本研究以分别种植在宁夏银川与广州南沙两个不同环境的148 份菜心种质材料为试验材料,获得性状数据用于开展SSR 标记与性状的关联分析,以MLM(Q+K)为模型关联分析中发现了两地表型性状数据中,薹粗、薹质量检测到相同的标记与这些性状存在一定的相关关系,这些标记可以为菜心的分子辅助选择育种提供参考。

