脱落酸对植物生长的作用研究
芦禹冰,万鲁河
(哈尔滨师范大学)
0 引言
脱落酸(Abscisic acid,ABA)在20世纪60年代被发现存在于植物体内的半萜类化合物,作为一种应激激素调节植物的基本生理过程和植物对各种环境胁迫的反应,对植物生长与表征和对逆境过程的响应发挥重要作用[1].ABA水平在生物与非生物胁迫下升高,协调生理和代谢反应,帮助植物在逆境中生存,减少环境胁迫对植物造成的伤害.该文主要以白桦为主要研究对象,对白桦体内脱落酸的状况做研究综述.
1 ABA的基本内容
ABA是通过ABA信号传导的方式实现对植物的调控作用.对脱落酸最初的研究报告表明,其积累于未成熟的棉球中,近些年被广泛认可的ABA信号转导组分包括PYR/PYL /RCAR受体家族、蛋白磷酸酶2C (PP2C)、Sn RK2 和AREB/ABF,这些信号在植物生长发育过程起着重要作用,参与脱落酸生物合成的关键酶是玉米黄质环氧酶(ZEP)、9-顺式环氧类双加氧酶(NCED)、短链脱氢酶/还原酶和脱落酸醛氧化酶[2].脱落酸作为一种很重要的植物激素信号,很大程度上都依赖于蛋白激酶的SnRK家族,在植物发育过程中涉及种子萌发、侧根生长、调节开花时间等不同过程,并且整合其他如Ca2+、光、水杨酸等信号共同调控植物发育[3].并且根据研究表明PYR/PYL/RCAR能够正向调节ABA信号传导,根据对拟南芥的研究,PP2C成员中有6~9个、SnRK2有3个、蛋白家族(PYR/PYL/RCAR)有14个参与ABA信号通路[4].
2 ABA的胁迫反应
植物生长过程中,脱落酸信号被看作是反应环境刺激和发育过程中应激反应的重要工具.植物在遇到非生物胁迫如干旱胁迫、低温冷胁迫和盐渍胁迫等,会通过脱落酸来评价胁迫的影响程度同时改变自身的ABA信号通过调节例如发芽、侧根生长等发育过程适应环境的变化,将不利于植物生长的外部环境隔离开,该文从以下几点做简要解释.
2.1 干旱胁迫
当水分条件不足、内外水分失衡致使渗透或压力失衡时就会触碰脱落酸信号.干旱期间脱落酸诱导气孔对水分胁迫快速关闭,诱导对干旱的逐渐适应.在记录基因表达对干旱的两种时间反应表明在转录水平的实验中表面,不同的信号模式调节不同的植物干旱反应,而这些模式可能依赖于ABA.
2.2 盐渍胁迫
盐属于一种非生物压力,极大的降低了世界上的作物产量,同时过高的盐度能够抑制种子萌发、根系生长以及种子的发育.因此当植物遭受盐渍胁迫的时候,植物会通过植物激素应对胁迫,ABA在应对盐胁迫的过程中主要的目的就是调节细胞的水分失衡和脱水耐受性,有研究表明,在遭受盐胁迫的15~30 min,植物根系中和叶中的脱落酸水平达到峰值,关闭气孔保护细胞[5].
2.3 低温冷胁迫
冷胁迫被认为是限制其生长和分布的关键环境因素.在分别处于低于冰点和冰点到15℃这样的冷冻应力和低温应力下,植物的一些重要的代谢过程如光合作用等会受到抑制,冷胁迫致使细胞间形成冰晶从而引起渗透胁迫[6].冷胁迫伴随着许多植物内源脱落酸水平的增加,外源脱落酸处理可以增强植物的抗寒性[7].在低温条件下,植物通过脱落酸依赖性和脱落酸非依赖性途径激活下游基因表达.换句话说,由低温引起的应激信号也是植物保护自身不受损伤的一种方式.研究表明,一种名为“dormin”的化合物作为ABA被发现能够增加树木的抗冻性.也有研究者表明在冷胁迫后观察到AREB/ABF转录因子ABF1(ABA介导的信号传导)显著增加[8].在对狗牙根冷胁迫反应的研究中表明在经过冷胁迫7 d后的叶片出现黄化和卷叶现象,而经过脱落酸处理后的叶片展现出缓解型,提高了应对冷胁迫时的耐受性.除此,其他冷应激诱导的信号分子如Ca+也会促进ABA信号.
3 ABA调控种子休眠
脱落酸在种子发育过程中进行积累,抑制并刺激成熟种子的发育和休眠.ABA在其调控种子休眠在合成与信号传导的过程中实现,其合成与信号传导过程如图1所示.
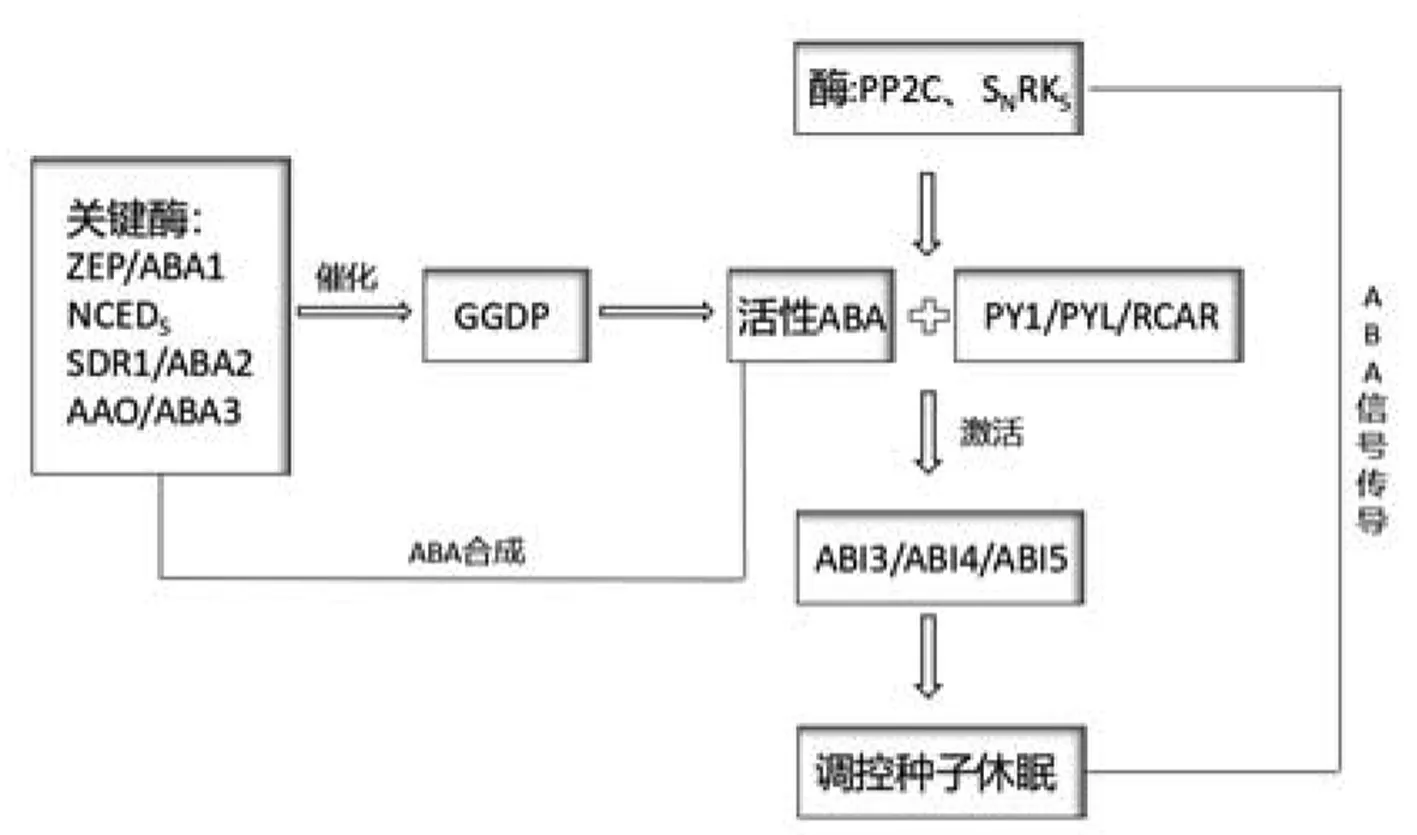
图1 ABA合成与信号传导过程
GGDP经关键酶的催化转化成活性ABA,ABA与ABA受体结合经酶的参与激活转录因子,从而调控种子的休眠.在整个合成与转化的过程中,酶的含量决定了ABA含量的积累,影响其调控种子休眠的能力.ABI3作为ABA下游信号的传导组分主要调节种子的休眠和萌发,ABI5被负调节因子MYB96激活在ABA信号通路中起作用,参与盐渍和干旱胁迫抑制植物侧根形成[9].简而言之,内源ABA水平和ABA 信号:正调节种子休眠,负调节种子萌发同时参与植物的发育过程.相关研究表明了与其他野生的植物相比,有ABA缺陷的植物相对来说发芽更快,有更短的休眠期.
4 对根茎叶的作用
ABA在与其他植物激素相互作用的同时,抑制根细胞的伸展和增殖,维持根静止中心.脱落酸调节根细胞长度、从细胞增殖到分化的转变以及侧根发育.在根的发育过程中,脱落酸与其他钙离子、活性氧等相互作用形成脱落酸效应,发育过程中由不同的植物激素调节包含不同的区域.对于近端分生组织,脱落酸通过调节细胞周期蛋白和蛋白激酶从而抑制细胞分裂,因此,脱落酸对于伸展分化区有抑制作用[10].通过对拟南芥的研究表明,基础水平的ABA对于植物主根的生长发育必不可少,脱落酸受体基因AtPYR1,AtPYL1,AtPYL2,AtPYL4,AtPYL5,AtPYL8促进脱落酸介导的根生长抑制,转录因子ABI5有调节主根的作用,同时转录因子ABI5能够抑制种子萌发和早期成苗.Bai等通过激光共聚焦和PCR分析进行阐述:ABA通过诱导根细胞产生过多的H2O2从而抑制根的生长,也有研究发现作为ABA受体中的PYL8基因在侧根生长过程中为植物所必须且研究表明ABI3及其突变体abi3以及ABI4等都在根系生长的过程中起到抑制作用,侧根密度低或者侧根出现延迟,表明PYL在ABA介导植物根系生长过程中有着不可代替的作用[11].除此,ABA可以通过诱导蛋白激酶CPK4和CPK11的活性来过量的促进乙烯合成从而达到抑制根系生长的目的.结果显示,当外界环境发生改变或者植物收到外界应激时,ABA通过调节组织抑制根的生长,当危机解除后,继续生长过程,因此,根系特定发育阶段的胁迫条件决定植物内源脱落酸水平,从而决定根系生长的反应.不仅在根细胞发育和生长中脱落酸起不可替代的作用,在植物衰老的过程中也是起着正调节的作用.脱落酸通过受体蛋白PYL9和相关的PP2Cs、SnRK2蛋白激酶、ABFs和RAV1转录因子促进叶片衰老[12].在植物的生命周期中,叶片的脱落和衰老既是发育的一步,也是脱落酸介导的长期生存反应.
5 白桦中脱落酸的含量变化
白桦( Betula platyphylla Suk ) ,落叶乔木,树干可达25 m高、50 cm粗.生长于海拔400~4100 m的山坡或林中,广泛分布于东北、华北平原、黄土高原山区及西南高山林区等 14 个省区.该文主要对白桦生长期内脱落酸含量的变化做简要阐述.
根据测定内源激素含量与白桦开花关系的研究结果发现对于无花史的幼树来说其脱落酸的含量在5~9月明显上升,秋季时逐渐下降并最终进入休眠时期;而对于有花史的成年树来说5月份是脱落酸含量的最大值,6月开始逐渐下降并且由于ABA抑制其生长促使其向花芽进行分化.在杨传平等的研究中表明5月下旬~6月上旬白桦处于花絮发育初期,在其所测定的4种内源激素中ABA的含量最低但明显有上升趋势,到达7月中旬的时候ABA的含量达到峰值.也有研究结论进一步表明白桦在6月中旬时ABA的含量达到峰值随后逐渐波动[13].在白桦成花这一点上与上述二位研究者的结论大体相同.
在近期测定二、三、四倍体白桦叶芽中内源激素含量的变化情况中表明:由于不同倍体白桦在受到其胸径、叶片、气孔、果序的影响.其内源激素含量如ABA含量也会有差异[14].在对比白桦与新疆杨叶片中内源激素含量的实验中表明,白桦叶片中ABA含量是新疆杨叶片的10倍.内源脱落酸引发许多植物花器官、叶子和幼果的脱落,脱落酸促进叶片衰老,其在衰老过程中的高内源水平表明[15].但在非胁迫条件下的脱落酸水平较低,外源施用脱落酸可恢复活力降低的脱落酸缺乏突变体的脱落酸水平[16].此外,在其他的证据中表明,ABA对根的生长既有负面影响,也有正面影响,这取决于ABA作用过程中的特定条件[17].在Migle等对白桦体外培养的研究中,将不同浓度的ABA添加到培养基中并观察其生根情况,结果表明:就根系生长而言,外源ABA能够增加白桦根长但对茎的生长和不定根的生成具有抑制作用对枝条生长没有负面影响[18].此观点与McAdam等学者的结论不谋而合,McAdam认为茎源脱落酸通过与根生长抑制激素吲哚乙酸(IAA)的相互作用促进根的生长[19].根据最近的研究表明ABA生物合成的源器官发生在植物叶片[20],因此,可以用叶片来测量植物体内的脱落酸水平.Rongshu等学者研究测定了不同生长阶段白桦幼叶的脱落酸水平,表明在整个生长期间,ABA对白桦植物的正常生长和发育是必要的[4].其研究结果与Lo′pez-Carbonell等学者的研究结果相一致[21].而受到内部变化与外界环境因素的不同,脱落酸水平可能发生很大的变化.
6 总结与展望
白桦作为一种广泛分布的树种,在工业制造中有很大的应用,因此研究其生理和发育是极其有必要的.植物体能够调节其激素含量的变化从而应对生物或非生物迫害,目前来说研究ABA作用机理较为广泛,但很少有关于灌木的报道,尤其是关于白桦在生长过程中其体内的脱落酸的含量与季节变化或环境变化之间的关系更少,因此,研究白桦体内的激素含量对探讨环境的变化也有重要意义.

