基于多数据集分析10型胶原α1链和分泌型磷蛋白1在肺腺癌中的表达及临床意义
刘美岑,刘蕾
解放军北部战区总医院呼吸与重症医学科,沈阳 110016
肺癌是最常见的恶性肿瘤之一,是肿瘤相关死亡的主要原因。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要组织学亚型,占肺癌患者的85%。肺腺癌(lung adenocarcinoma,LUAD)和肺鳞状细胞癌(lung squamous cell carcinoma,LUSC)是最常见的 NSCLC 亚型。其中,LUAD是NSCLC中最常见的组织学亚型,占NSCLC的50%以上。大约70%的肺癌患者被诊断时为晚期,此时患者已经错过了接受手术、化疗和放疗的机会。中晚期就诊、缺乏可靠的生物标志物、不精准的治疗靶点已成为治疗LUAD的主要障碍。因此,早期诊断和治疗对于改善患者的预后和生活质量至关重要。10型胶原α1链(collagen typeⅩ alpha 1 chain,COL10A1)基因编码的产物是10型胶原蛋白的α1链,是一种主要的间质基质成分。它通过形成同源三聚体,组成10型胶原蛋白。COL10A1在许多实体肿瘤中表达升高,如结肠癌、食管癌和乳腺癌,并在关键的细胞过程中发挥重要作用,如细胞增殖、迁移、侵袭和肿瘤血管生成。分泌型磷蛋白1(secreted phosphoprotein 1,SPP1)是一种分泌型磷酸化糖磷蛋白,人类SPP1
基因位于第4号染色体(4q13)上,有7个外显子和6个内含子。该蛋白可由多种细胞分泌,如破骨细胞、巨噬细胞、上皮细胞和内皮细胞,涉及多种生物学功能。本研究利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)等数据库中的基因组和临床数据,运用生物信息学技术分析COL10A1
、SPP1
mRNA表达与LUAD诊断和预后的关系,预测COL10A1和SPP1参与LUAD发生发展的作用机制,探讨COL10A1和SPP1在LUAD诊断及预后中的意义。1 资料与方法
1.1 资料收集
从TCGA公共数据库(https://tcga-data.nci.nih.gov/)下载COL10A1
和SPP1
基因mRNA测序数据集及与之相一致的患者临床资料。仅保留临床资料和生存信息完整的病例,共纳入LUAD患者594例。1.2 表达差异分析
利用数据库搜索COL10A1和SPP1在正常肺组织和LUAD组织中的表达情况,并进行比较。基于数据库数据,统计分析COL10A1
和SPP1
基因在正常肺组织和LUAD组织中的表达差异、在不同分期LUAD组织中的表达差异及其与LUAD预后的关系。1.3 生存分析
为明确COL10A1和SPP1表达在LUAD预后中的价值,采用Kaplan-Meier Plotter数据库分析,应用“Auto select best cut off”方法[该方法计算基因高低表达四分位数之间所有可能的边界值,并使用最佳性能阈值作为边界值。结果中除了显示P
值外,还将显示错误发现率(false discovery rate,FDR)]比较数据库中COL10A1和SPP1的表达水平对719例LUAD患者生存期的影响。1.4 免疫组化分析
人类蛋白质表达图谱(the Human Protein Atlas,HPA)是基于RNA测序分析和免疫组化分析的大型转录组和蛋白组数据库(https://www.proteinatlas.org/),可用于正常组织和肿瘤组织中蛋白差异表达分析。通过该网站分析SPP1
基因在不同分级的LUAD组织中的表达。通过SPP1组化抗体(HPA027541)对正常肺组织和肺癌组织进行免疫组化检测,分析3例正常肺组织和3例肺癌组织中SPP1蛋白表达及抗体染色程度。1.5 预后影响因素分析
本研究基于TCGA数据库中较完整的325例LUAD患者数据信息,利用Cox回归模型分析临床特征、COL10A1和SPP1表达与LUAD预后的关系。
1.6 基因集富集分析(gene set enrichment analysis,GSEA)
为探讨COL10A1和SPP1表达水平对相关生物通路基因集的影响,本研究分析与COL10A1和SPP1相互作用的蛋白网络以及这些相互作用蛋白参与的生物学过程,进一步分析COL10A1和SPP1影响肺癌患者预后可能的作用机制,并通过GSEA分析不同表达水平的COL10A1和SPP1对多种生物通路基因集的影响。从分子标签数据库(molecular signatures database,MsigDB)中获得参照(h.all.v7.4.symbols.gmt和 c2.cp.kegg.v7.4.symbols.gmt)基因集,按default weight edenrichment statistic的方法,每个分析重复1000次。在GSEA中按P
<0.05且FDR<0.25判断显著富集基因集。1.7 统计学分析
采用SPSS 18.0统计软件进行数据分析;非正态分布的计量资料以中位数(四分位间距)[M
(P
,P
)]表示,组间比较采用秩和检验;采用Kaplan-Meier绘制生存曲线,组间比较采用Log-rank检验;采用Cox回归模型进行单因素及多因素分析;以P
<0.05为差异有统计学意义。2 结果
2.1 肿瘤组织与癌旁组织中COL10A1和SPP1表达量的比较
针对535例LUAD组织和59例癌旁组织的统计学分析结果表明,LUAD组织中COL10A1和SPP1表达量均明显高于癌旁组织,差异均有统计学意义(P
<0.01)。对57例患者的肿瘤组织与癌旁组织的分析结果表明,LUAD组织中COL10A1和SPP1表达量均明显高于癌旁组织,差异均有统计学意义(P
<0.01)。(表1、表2)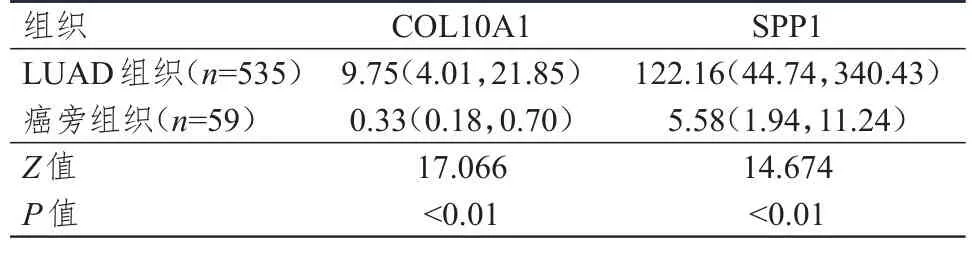
表1 535例LUAD组织和59例癌旁组织中COL10A1和SPP1表达量的比较[M,(P25,P75)]
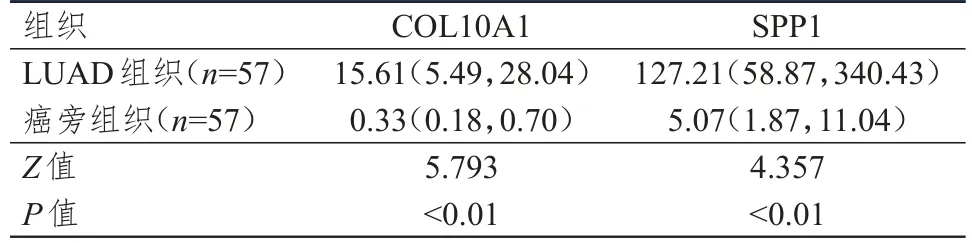
表2 57例患者的LUAD组织和癌旁组织中COL10A1和SPP1表达量的比较[M,(P25,P75)]
2.2 不同COL10A1和SPP1表达情况的LUAD患者生存情况的比较
分析Kaplan-Meier Plotter数据库中的719例LUAD患者的生存情况,结果显示,COL10A1和SPP1高表达LUAD患者的生存期均明显长于低表达患者,差异均有统计学意义[HR=0.51(0.40~0.66)、1.83(1.42~2.38),P
<0.01)]。(图1、图2)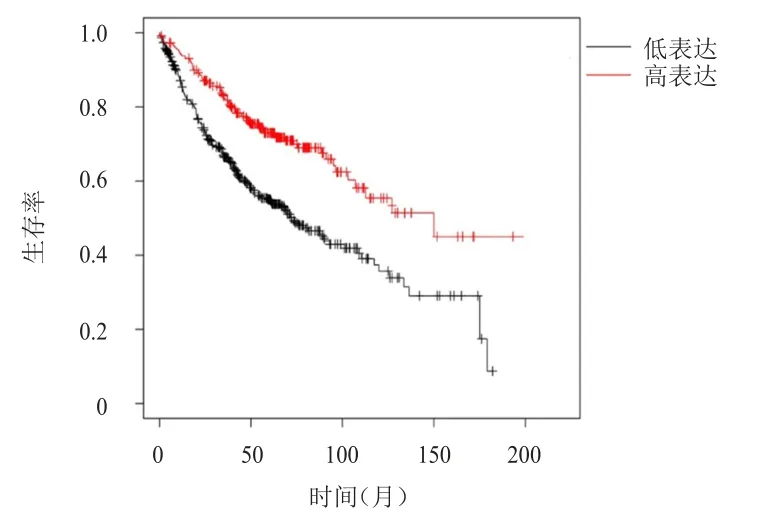
图1 Kaplan-Meier Plotter数据库分析中COL10A1高表达(n=290)与COL10A1低表达(n=429)LUAD患者的生存曲线
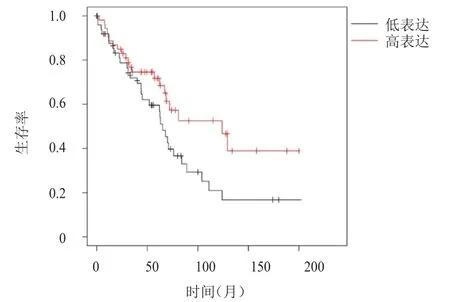
图2 Kaplan-Meier Plotter数据库分析中SPP1高表达(n=181)与SPP1低表达(n=538)LUAD患者的生存曲线
2.3 LUAD中SPP1特征的初步验证
为验证以上结果,本研究重点探讨肺癌中SPP1蛋白表达情况。采用HPA公共数据库中肺癌免疫组化标本评估SPP1的表达情况,且引用该数据库中SPP1(组化抗体编号HPA027541)的免疫组化检测结果,结果显示,肺癌患者的SPP1特异性染色呈阳性,与正常肺组织中SPP1蛋白表达存在显著差异。与正常肺组织相比,SPP1在LUAD组织中呈高表达(图3)。
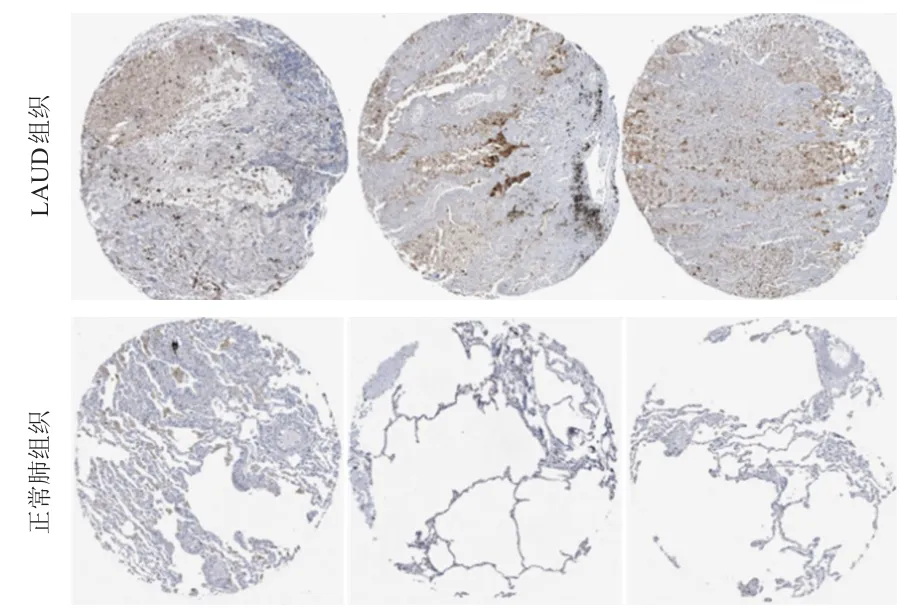
图3 SPP1蛋白在正常肺组织与LAUD组织中的表达差异(免疫组化染色,×100)
2.4 LUAD患者预后影响因素的单因素及多因素分析
从TCGA数据库中共获取325例LUAD患者信息,将其临床特征以R语言处理。将年龄、性别、肿瘤分期、TNM分期、COL10A1表达、SPP1表达进行单因素分析及多因素分析,Cox多因素分析结果表明,肿瘤分期是LUAD患者预后的影响因素(P
<0.01)。(表3)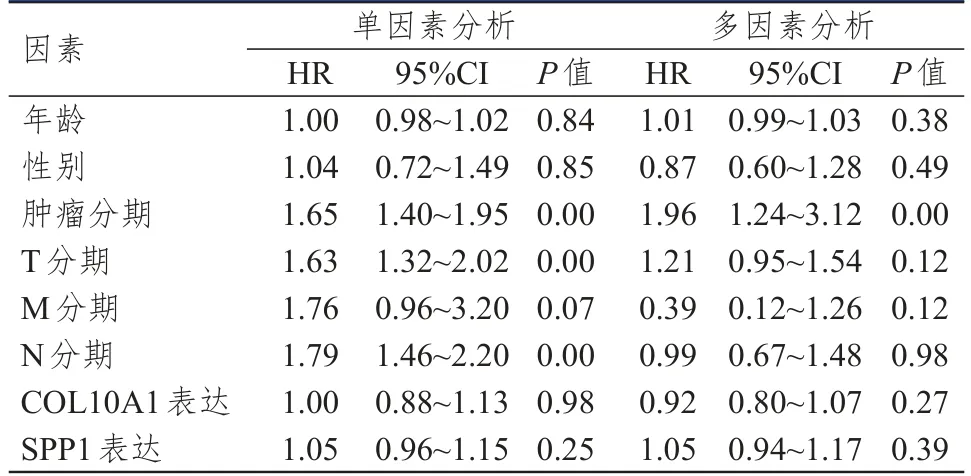
表3 预后影响因素的单因素和多因素分析
2.5 COL10A1和SPP1的功能基因集富集
GSEA富集分析结果显示,COL10A1高表达的样本富集了与血管新生、顶端连结、凝结、DNA修复、上皮-间充质转变、脂肪酸代谢、KRAS信号上调、肌细胞生成、NOTCH信号、转化生长因子-β(transforming growth factor-β,TGF-β)信号通路、致心律失常性心肌病、细胞因子受体相互作用、ECM受体相互作用、黏着斑、糖胺聚糖生物合成硫酸软骨素、肥厚型心肌病、白细胞跨内皮迁移、肌动蛋白细胞骨架的调节有关的基因集(图4A、图4B)。SPP1高表达的样本富集了与血管新生、细胞凋亡、凝结、补体、上皮-间充质转变、糖酵解、组织缺氧、炎症反应、mTORC1信号、Myc目标、糖酵解糖质新生、致病性大肠杆菌感染、磷脂酰肌醇信号系统、蛋白酶体等有关的基因集(图4C、图4D);在GSEA中按缺省加权富集统计方法进行富集分析,P
<0.05且FDR<0.25的基因集判断为显著富集基因集。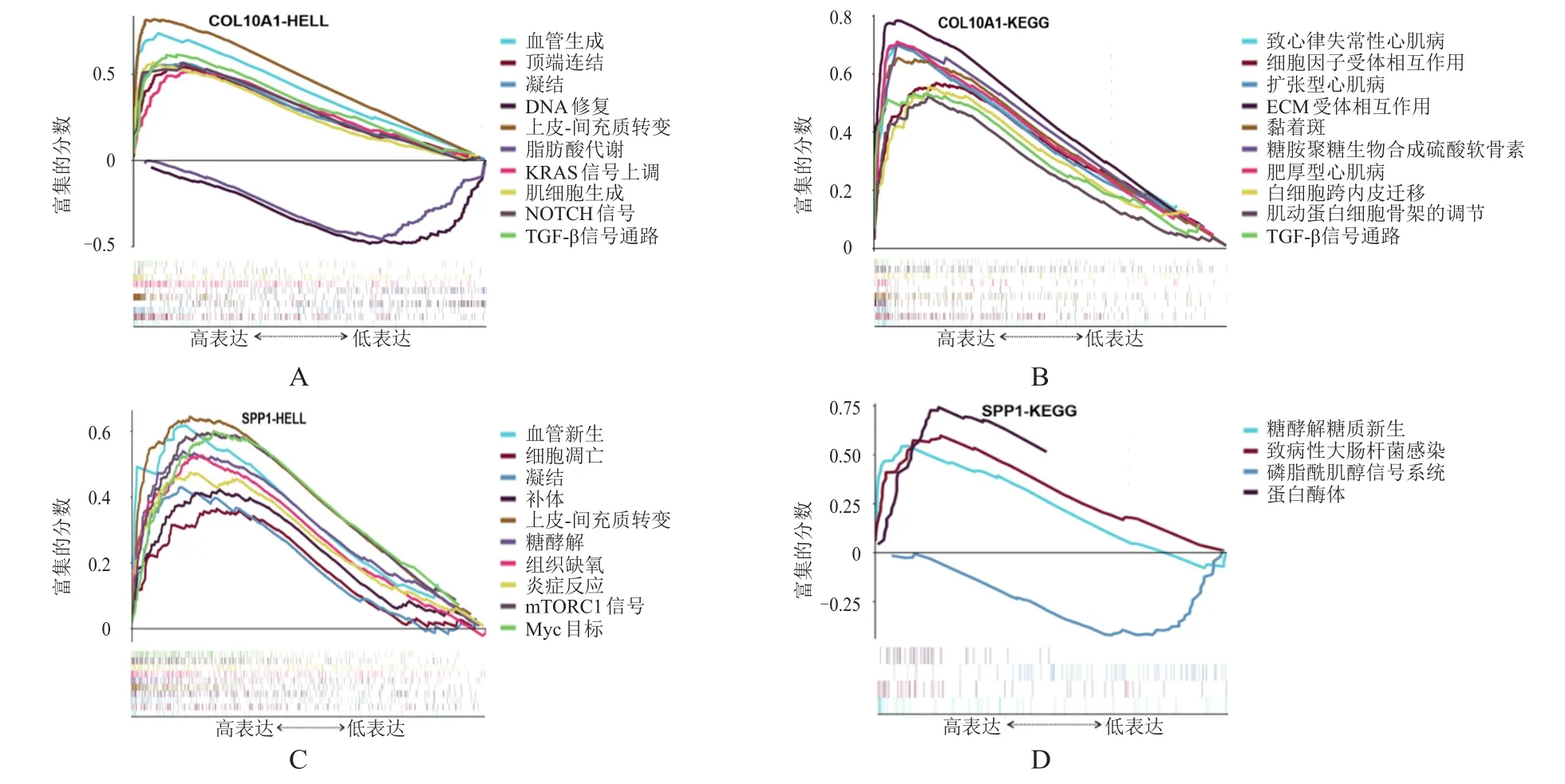
图4 GSEA分析COL10A1和SPP1相关富集基因集
3 讨论
LUAD是最具侵袭性和快速致死性的肿瘤之一,其发病率在各种类型的肺癌中居第1位。发现LUAD特异性的早期诊断分子及治疗靶标,对于指导LUAD患者早期诊断和干预治疗、提高患者生存率、改善患者生活质量以及延长生存期具有着重要意义。
COL10A1是一种液态非纤维胶原,是分布在细胞间质中的主要间质基质成分。细胞外基质在肿瘤细胞的生长、分化、进展、凋亡和转移中发挥重要作用。COL10A1在许多实体肿瘤类型中高表达,如结肠癌、食管癌和乳腺癌,并在许多关键的细胞过程中发挥重要作用,如肿瘤细胞的生长、增殖、迁移、肿瘤血管生成,此外,COL10A1还与肿瘤的不良预后相关。SPP1可能是多种肿瘤的潜在驱动因素。SPP1在多个肿瘤相关生物过程中发挥重要作用,包括增殖、侵袭、迁移、血管生成和转移。在胃癌和食管癌中,SPP1的表达与肿瘤转移密切相关。SPP1通过调节血管内皮生长因子的表达和细胞外基质蛋白促进肿瘤发展。SPP1调节肿瘤细胞的许多功能,如刺激肿瘤细胞增殖和侵袭、支持肿瘤血管生成。然而,COL10A1和SPP1蛋白在LUAD中的作用及其调控机制尚未得到很好的研究,COL10A1和SPP1在LUAD中的表达及与预后的关系尚不清楚。
本研究分析了COL10A1和SPP1在LUAD中的表达及与预后的关系,研究发现,与癌旁组织相比,LUAD组织中COL10A1和SPP1高表达。分析结果表明,在LUAD中COL10A1和SPP1表达上升是导致预后较差的因素之一。本研究使用的数据库样本量大、临床资料完整、可信度高。但是,数据库提供的是COL10A1
、SPP1
mRNA变化情况,无法完全反映COL10A1和SPP1蛋白水平的变化情况。因此,应用HPA数据库从蛋白质表达水平进一步证实了SPP1在LUAD中表达量升高。为了推测COL10A1和SPP1在LUAD发展过程中的功能,本研究利用GSEA方法进行分析,结果发现COL10A1的表达与血管新生、TGF-β信号通路、肌细胞生成、黏着斑、顶端连接、ECM受体相互作用、DNA修复、KRAS信号上调、上皮-间充质转变、NOTCH信号通路等相关。因此,COL10A1可能与肿瘤细胞生长和分化相关。另外,SPP1在血管新生、上皮-间充质转变、组织性缺氧、mTORC1信号、糖酵解糖质新生、磷脂酰肌醇信号系统、细胞凋亡、炎症反应、蛋白酶体等通路中大量富集,提示SPP1可能与肿瘤的转移、代谢和免疫功能相关。COL10A1和SPP1将成为LUAD治疗的新潜在靶点。
综上所述,LUAD样本中COL10A1和SPP1的表达显著增高,其功能可能参与肿瘤细胞生长和分化、肿瘤的转移、代谢和免疫调节。该研究将为后续深入研究COL10A1和SPP1在LUAD中具体作用的分子机制提供重要的临床数据支持和理论基础。

