负载葡萄皮粉花色苷提取物的W/O/W型复乳制备及其体外消化评价
徐伟丽,穆 韡,鲁兆新,徐贵华
(1 哈尔滨工业大学食品科学与工程系 哈尔滨150001 2 哈尔滨工业大学生物分子与化学工程系 哈尔滨150001 3 河南科技学院食品学院 河南新乡453003)
花色苷(anthocyanins,ACNs)是类黄酮水溶性色素,广泛存在于花卉、水果、蔬菜、谷物和草药中[1]。自然界中的ACNs 主要是黄酮基(2-苯基-苯并吡嗪盐)的多羟基和多甲氧基糖苷衍生物[2]。流行病学研究表明,ACNs 的摄入可以改善许多慢性疾病,如心血管疾病、糖尿病、关节炎和癌症[3]。富含ACNs 的植物提取物,如浆果果渣提取物比单一酚类化合物具有更强的抗氧化作用[4],但它们是不稳定的化合物,在高pH 值、氧气、光、热和特定酶的存在下容易降解[5],很难到达肠道,口服后生物利用度低。保护ACNs 的生物活性以增强其稳定性并促进其在目标吸收位点的释放,是一项技术挑战。
研究证明W1/O/W2型复乳可以有效防止食品体系中各种成分的相互作用,是实现亲水性生物活性物质保护和靶向输送的最佳微囊化技术[6-8]。最近,体外模型作为了解微胶囊的基本物理化学性质和被包埋组分控释的工具而备受关注[9]。消化时,内水相、油相和外水相的物理性质都对微胶囊的包埋率,生物活性成分的稳定性及其控释性质起重要作用[10]。虽然此前报道了一些关于单层或双层微胶囊的消化研究[11],但是就复乳在胃、肠道消化时微观结构的变化及其内水相或内部W1/O单一乳液的靶向输送情况尚未阐明。
此前关于包埋ACNs 的研究主要使用多糖作为外水相[12],而对于使用WPI 溶液作为乳化剂包埋ACNs,以及通过口腔和胃、肠道连续消化负载ACNs 的W/O/W 型复乳的信息有限。本研究的目的是评价以葡萄皮粉ACNs 提取液为内水相(W1),含聚甘油聚蓖麻油酸酯(PGPR)的玉米油为油相,WPI 溶液为外水相(W2)的W/O/W 型复乳,表征其在体外消化过程中的微观结构、流变学特性、靶向传输和抗氧化活性的变化情况。
1 材料与方法
1.1 材料与试剂
葡萄皮粉,加拿大约瑟夫天然产物公司;WPI(97.5%蛋白质),美国戴维斯科食品国际公司;玉米油,市购;ACN 标准品,美国Indofine 化学公司;HCl、柠檬酸和苯甲酸钠,美国Sigma 公司;聚甘油聚蓖麻油酸酯(PGPR,4175),美国Palsgaard 公司;6-羟基-2,5,7,8-四甲基色满-2-羧酸(Trolox)、2,2'-偶氮二-(2-甲基丙脒)二盐酸盐(AAPH)、2,2-二苯基-1-苦基肼(DPPH)、L-抗坏血酸、荧光素和苯甲基磺酰氟(PMSF),Sigma-Aldrich 化学公司;氯化钠和HPLC 级溶剂,加拿大卡利登实验室。
1.2 仪器与设备
匀浆器(PT 2500 E),瑞士Kinematica AG 公司;微流化器,加拿大ATS 公司;光学显微镜、照相机(AxioCam MRC5),德国Zeiss 公司;粒度电位仪(Zetasizer),英国Malvern 仪器公司;流变仪(ARES-LS1),美国TA 仪器公司;UV 微板读数器,美国Bio-Tek 仪器公司;离心过滤装置(30,000-MWCO Amicon-Ultra 15),德国Millipore 公司;光电二极管阵列检测器,德国安捷伦科技公司;C18分析柱(150 mm×4.6 mm i.d.×5 μL),中国北京迪科马科技公司。
1.3 方法
1.3.1 制备WPI 溶液和葡萄皮提取物 将WPI粉末溶于去离子水(2.5%,质量分数)中,磁力搅拌2 h,4 ℃过夜和储存。将20 g 葡萄皮粉在600 mL 50%(体积分数)甲醇中50 ℃超声提取1 h,用滤纸(Whatman Grade No.1)过滤。如此进行两次,合并滤液,使用旋转蒸发仪在40 ℃条件下对其浓缩。将最终提取物(不含甲醇)置-20 ℃储存备用。
1.3.2 复乳的制备 参考文献[13]制备W1/O/W2型复乳。
1.3.3 模拟体外消化 根据先前报道[11]的方法进行体外模拟消化。将没有添加样品的空白作对照,在相同条件下处理以校正来自消化酶和缓冲液的干扰。该体外消化模拟系统用于模拟人类口腔、胃和小肠的消化过程。
1.3.4 显微镜观察 拍摄照片,评估乳液表面形态的变化。将光学显微镜与AxioCam MRC5 照相机连接,观察乳液的微观结构(100×)。
1.3.5 粒径和ζ-电势测定 参考文献[13]进行检测。
1.3.6 流变学性质测定 用ARES-LS1 流变仪测定乳液的流变学性质。测量期间乳液的温度保持在25 ℃。
1.3.7 HPLC 法测定ACNs 将60 μL 葡萄皮提取物(相当于1 mL W/O/W 乳液中的量)稀释至5 mL(3.3 mL 5 mol/L HCl 和1.7 mL Milli-Q 水)。此溶液在100 ℃温度下保持60 min,以确保将ACNs 完全水解成花青素。冷却后,用0.45 μm 过滤器过滤。25 ℃条件下使用配备光电二极管阵列检测器(PAD)和C18分析柱的Agilent 1100 系统进行HPLC 分析。使用体积分数10%甲酸(溶液A)和100%甲醇(溶液B)梯度洗脱,即:0~20 min,95%A/ 5%B 至40%A/60%B 的线性梯度洗脱;20~23 min,40%A/60%B 的等度洗脱;23~24 min,40%A/ 60%B 到95%A / 5%B 的线性梯度洗脱;24~28 min,95%A/5%B 的等度洗脱。洗脱液流速0.8 mL/min,注射样品体积100 μL。在波长520 nm 处定量外标(即氯化翠雀宁、氯化矢车菊素、氯化天竺葵素和氯化锦葵色素),并基于峰面积建立校准曲线。
1.3.8 W1/O/W2型复乳中ACNs 的释放检测 采用文献[13]中的HPLC 法测定W/O/W 复乳中ACNs 的释放率。计算ACNs 的包埋率(EE,%)公式:
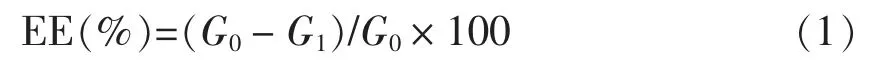
式中,G1——乳液中游离ACNs 的含量(μg/mL);G0——制备时加入的ACNs 总量(μg/mL)。
ACNs 的释放率(R)计算公式:

1.3.9 W1/O/W2型复乳抗氧化活性评价 按照Li等[14]的方法测定样品的抗自由基活性(DPPH 测定法)。提取物的氧自由基吸收能力(ORAC)测定采用文献[11]的方法,通过标准曲线将结果表示为μmol/Trolox 物质的量。根据文献[10]方法测定铁还原能力(FRAP),抗氧化活性表示为μmol/L 抗坏血酸物质的量。
1.3.10 乳液稳定性测量 将不同消化阶段收集的乳液转移到无菌离心管中,用塑料盖密封,25℃下储存24 h。数码相机拍摄乳液照片。
1.3.11 统计分析 文中使用SPSS 14.0 软件统计分析,结果表示为3 次独立试验结果的平均值(±s)。采用单因素方差分析(ANOVA)进行组间比较。
2 结果与分析
2.1 W1/O/W2 型复乳的形态和储存稳定性
本研究使用PGPR 和WPI 作为乳化剂,制备包埋ACNs 提取物的W/O/W 型复乳(6%,质量分数),乳液的形态和微观结构如图1~4所示。结果表明,制备的所有乳液都质地均匀且表面光滑(图1A),W1/O/W2和O/W2乳液为白色并具有良好的流动性,W1/O 乳液呈浅粉色,有黏性。W1/O/W2和O/W2乳液的平均粒径分别为(287.90±3.12)nm(PDI=0.193±0.022)和(299.70±5.83)nm(PDI=0.146±0.023)。显微镜分析显示,小油滴均匀分布在O/W2乳液的水相中(图2B),水滴均匀分布在W1/O 乳液的油相中(图2C)。此外,根据Florence等[15]分类,许多W1/O 小液滴存在于外水相内部(图2A),表明其为B 型W1/O/W2复乳。
图1 乳液照片Fig.1 Photographs of different emulsions
乳液的稳定性在食品加工和储存过程中非常重要。4 ℃储存5 周的样品依旧均匀,无游离油滴,液滴未发生团聚现象(图1A)。结果表明,4 ℃储存35 d 的复乳表现出良好的稳定性。然而,W1/O/W2型复乳在胃中消化30 min 发生相分离现象,表明胃消化会破坏乳液的稳定性(图1B)。
2.2 体外模拟消化对W1/O/W2 型复乳微观结构的影响
使用显微镜(图2)和激光衍射(图3 和图4)评估体外不同消化阶段的W1/O/W2型复乳的微观结构。初始复乳乳滴的平均粒径为(287.90±3.12 nm)(PDI=0.193±0.022)(图3),整体粒径分布在50~1 000 nm 范围(图4)。经口腔消化后,液滴粒径和形态未发生明显改变 【d =(296.13 ± 2.52)nm】(图3,图2A,2D)。当乳液经口腔移动到胃部消化后,液滴仍保留双层结构,但粒径显著增加【d=(619.40±15.96)nm】(图2E,图3 和图4)。其原因是蛋白质水解导致复乳的表面结构改变,小液滴融合成具有双层结构的不稳定的较大液滴。这也可能是图1B所示相分离的原因。相反,Shima等[16]研究显示双层复乳在模拟胃部消化期间是稳定的。而Xiao 等[17]发现大多数复乳液滴在胃消化过程中塌陷并释放出内水相。上述研究结果的不一致可能与模拟胃液化学组分和pH 值不同以及外水相有关。
显微照片证实,模拟肠道消化后乳滴完全失去双层结构并变为空油滴(图2F)。这表明双层结构的外部蛋白被完全消化,酶解使W1/O 液滴破裂并释放ACNs,油相被胆汁盐乳化后聚集并重新形成油滴,因此未观察到相分离现象(图1B)。Andrade 等[18]和Frank 等[19]的研究结果与本研究结果一致,也证实在体外消化过程中使用含脂肪酶和胆汁的人工消化液,W/O/W 型复乳发生油相的水解和聚结。
2.3 体外模拟消化对乳液ζ-电位的影响
监测体外不同消化阶段乳液液滴所带电荷情况,即ζ-电位。WPI 稳定的初始乳液(pH 6.6~6.8)具有负ζ-电位(约-45 mV)(图5),这主要取决于乳化剂WPI 的性质。模拟口腔消化(pH 6.8~7.0)后,乳液液滴带有相对较少的负电荷(约-39 mV)。当乳液经口转移到胃消化后,乳液电势为正【(12.80±0.28)mV】(pH=2.0)。乳液液滴电荷的变化与多种因素有关,例如:溶液pH 值和离子强度的变化,或者带电物质从胃液吸附到乳化剂涂层上。模拟胃液消化后,如果界面组成没有变化,pH 值低于等电点(PI),WPI 包被的微粒就会携带正电荷[20]。WPI 含有球状蛋白质,如β-乳球蛋白,可以形成共价交联的界面。在模拟胃消化过程中,β-乳球蛋白对酸和酶的降解具有抗性[21]。这可以解释大量乳滴在模拟胃环境中保留蛋白层的现象。乳液经胃转移到模拟小肠(pH 6.8)消化后的ζ-电位值(-63.97±3.04)mV 甚至高于初始乳液。pH 值的影响是乳液微粒携带较多负电荷的主要原因。其它研究[22]也报道了在体外消化模型中β-乳球蛋白包被的液滴ζ-电位的类似结果。

图2 不同乳液的显微照片Fig.2 Photomicrographs of different emulsions
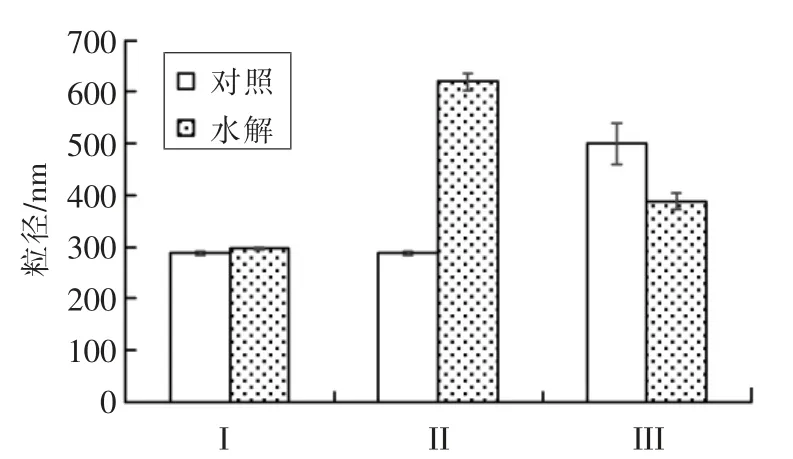
图3 不同体外消化阶段W1/O/W2 型复乳液滴的平均粒径Fig.3 Mean particle diameters of W1/O/W2 emulsion after in vitro digestion

图4 W1/O/W2 型复乳的粒径分布Fig.4 Particle size distributions of W1/O/W2 emulsions

图5 W1/O/W2 乳液的ζ-电位Fig.5 ζ-potential of W1/O/W2 emulsions
2.4 体外模拟消化对乳液流变学性质的影响
流变特性与食品配方、加工条件以及食品口感等感官特性高度相关[23],这使其在食品应用方面非常重要。在给定质量浓度的乳液中,乳液黏度取决于液滴相互作用的性质和聚集程度[24]。本研究使用流变仪追踪体外不同消化阶段乳液的黏度变化(图6)。随着剪切速率的增加,W1/O/W2复乳和O/W2乳液的黏度未发生明显变化,表明这些乳液属于牛顿流体。这与Wang 等[25]的研究结果一致。然而,另有报道显示,复乳是非牛顿流体,其复杂的流变行为,使在高剪切力下变稀的程度更大[26]。最近的一项研究表明当剪切速率在1~100 s-1时,O/W 乳液表现出典型的假塑性流体特性[27]。这些不同的结果可能是由所用乳化剂的类型和浓度,以及分散相的体积不同所致。随着剪切速率的增加,W/O 乳液的黏度缓慢下降,表明这些乳液是非牛顿流体[28]。Jiao 等[29]也得出相同的结论。然而,Abivin 等[30]发现W/O 乳液的黏度与剪切速率曲线表现出牛顿流体特性。W1/O/W2和O/W2乳液与水的黏度相近(<0.1),W1/O 乳液的黏度高于这两种乳液(W1/O/W2和O/W2)。体外消化后,W1/O/W2乳液发生剪切变稀,可能是由乳液液滴变形和/或结构破坏导致的[31]。
2.5 体外模拟消化对W1/O/W2 乳液中ACNs 释放的影响
研究了体外消化对W1/O/W2乳液中包埋的ACNs 释放的影响,结果如图7所示。初始W1/O/W2复乳ACNs 的包埋率为(93.19±2.78)%。在口腔消化后,ACNs 仍保持在乳液的内水相中。经胃消化后,复乳的内水相中ACNs 少量被释放,这是因为乳液微粒仍具有双层结构,ACNs 主要存在于微粒的内部水相(图2E)。Frank 等[19]、Oidtmann 等[32]和Flores 等[11]也有类似的发现。然而,Xiao 等[17]和Andrade 等[18]证明,在胃消化阶段由于液滴结构的破坏,W/O/W 复乳的内水相(W1)大部分释放。而Shima 等[16]的研究表明复乳不受人工无酶胃液的影响,包埋率没有变化。
ACNs 主要在模拟肠道消化过程中释放,释放率为(41.89±2.95)%。其主要原因可能是胃蛋白酶和胰蛋白酶的消化,复乳成为单一的W1/O 乳液,而W1/O 液滴的油层进一步被酶水解,ACNs 被释放。相反,Aditya 等[33]报道在体外无酶肠道消化1 h,超过45%的姜黄素从W/O/W 复乳中释放出来。这种差异可能与人工消化液的化学成分、包埋方法、壁材类型或内层水相的物理化学性质有关[18]。
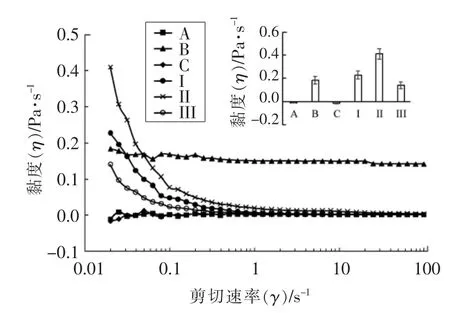
图6 乳液的黏度-剪切速率曲线图Fig.6 Viscosity-rate of shear curves for emulsions
2.6 体外模拟消化过程中W1/O/W2 复乳抗氧化活性的变化
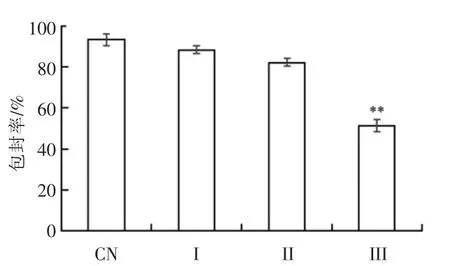
图7 ACNs 在W1/O/W2 复乳中的包埋率Fig.7 The encapsulation efficiency of ACNs in W1/O/W2 emulsions
包埋ACNs 的复乳在体外不同消化阶段的抗氧化活性如图8所示。在体外消化过程中乳液的FRAP 值没有明显的变化。然而,DPPH 和ORAC值随着体外消化的进行呈显著增加趋势(P<0.05)。在模拟肠道消化后,从乳液检测出最高的抗氧化活性,其原因主要是微胶囊中ACNs 的大量释放。Ydjedd 等[34]研究表明:在肠道消化过程中最高剂量的酚类物质和类黄酮物质从微胶囊中释放出来。这一结果与本研究发现一致。经胃消化后,仍有(82.13±1.90)%的ACNs 包埋在油相中。然而,与初始复乳和经口腔消化后的复乳(阶段I)相比,经胃消化后的复乳具有更高的抗氧化活性(P<0.05)。这可归因于胃消化过程中W1/O/W2液滴的双层结构被破坏且ACNs 在亲水介质中易于扩散[33]。WPI 被消化酶水解产生的抗氧化肽,可能也是这种高抗氧化活性的部分原因[35]。本研究结果表明,在整个模拟胃、肠消化过程中W1/O/W2复乳能够稳定ACNs 的高抗氧化活性。然而,Cofrades等[36]报道了相反的结果,由于体外模拟胃部和肠道消化使生物活性化合物损失,因此使复乳和凝胶化复乳的抗氧化活性显著降低。

图8 W1/O/W2 乳液的抗氧化活性Fig.8 Antioxidant activity of W1/O/W2 emulsions
3 结论
本研究结果表明,负载ACNs 的W1/O/W2复乳具有较高的包埋率【(93.19±2.78)%】和较好的储存稳定性。口腔消化后复乳的液滴未发生明显的形态变化。经模拟胃液消化后,大量液滴相互融合形成不稳定的较大颗粒,然而仍具有双层结构。在肠道消化过程中,液滴释放出内部水相而变成油滴。黏度分析结果也表明,体外消化使复乳液滴的结构受损。此外,ACNs 释放率和抗氧化活性分析证实包埋的ACNs 可针对性地运送至模拟小肠中。这些结果表明,W1/O/W2复乳是潜在的,可用于稳定水溶性生物活性成分并控制其在肠道中靶向释放的微载体系统。

