肝癌患者行微波消融术前进行经肝动脉灌注介入治疗的效果及对TK1及CXCL13血清水平的影响
李丹 董洪林 许冉 常勇闯
(1. 汤阴县人民医院介入科,河南 汤阴 456150;2. 安阳市人民医院放射介入科,河南 安阳 455000)
研究调查显示[1],我国每年肝癌新增患者占全球每年新增患者的55%。手术治疗是肝癌早期最佳治疗方案,但临床上确诊肝癌的患者已达到中晚期阶段,实施微波消融术切除治疗是通过热凝方式促使恶性肿瘤组织达到完全坏死,但其在治疗过程中并发症较多,转移和复发率均有可能提高,进而使患者5年后生存率减低。随着介入放射学的发展和进步,在微波消融术前行经肝动脉灌注介入(ranshepatic arterial chemoembolization,TACE)治疗,通过对恶性肿瘤供血血管注入化疗药物杀死肿瘤细胞,并采用碘化油栓塞剂封堵血管发挥阻断肿瘤血液供应的作用,进而达到治疗效果。鉴于此,本文旨在观察肝癌患者行微波消融术前行TACE治疗效果,分享如下。
1 资料与方法
1.1 一般资料
选取我院2018年3月-2020年3月期间收治的103例肝癌患者以随机数字表法分为对照组和观察组。对照组51例,男30例,女21例,年龄在47-69岁之间,平均58.02±6.02 岁,肿瘤直径3-11cm之间,平均7.01±1.02 cm。观察组52例,男32例,女20例,年龄在48-69岁之间,平均58.50±6.13 岁,肿瘤直径4-11cm之间,平均7.52±1.05 cm。纳入标准:所有患者均符合肝癌诊断标准[2],具备微波消融术手术指征,经检查未发现门静脉与肝静脉癌栓发生转移,患者及家属知情并签订知情同意书。排除标准:伴有心肺肾功能障碍、凝血功能障碍、其他恶性肿瘤,患有全身代谢系统、免疫系统疾病。一般资料对比无统计学意义(P>0.05)。
1.2 方法
两组术前均实施常规检查,经MRI或CT检查患者恶性肿瘤位置、大小、门静脉瘤栓及血供情况,均在股动脉处穿刺并留置5F-RH导管。
对照组给予微波消融术治疗,选用湖南昊德仪器设备有限公司生产的微波消融治疗仪,功率设置为40-50w,消融时间设定为6-8min,消融范围超出肿瘤病灶1cm。
观察组在微波消融术前进行TACE治疗,给予患者丝裂霉素联合铂类、阿霉素进行肝左右动脉缓慢灌注,常规给予抗感染、止吐治疗,灌注时间大于 30min,采用 30mg表阿霉素(Antibioticos S.p.A,X19990296)与15ml碘化油(武汉中联集团四药药业有限公司,H42020306)混合成混悬液进行缓慢推注。根据患者肝功能和肿瘤血供状态每4-5周进行介入治疗1次,2-3次后进行微波消融术治疗,消融术治疗方式与对照组相同。两组均随访3个月。
1.3 观察指标
1.3.1 临床疗效
完全缓解(complete remission,CR)恶性肿瘤病灶完全消失,维持4周及以上;部分缓解(partial response,PR)为肿瘤病灶减小程度>50%,持续时间≥4周;稳定( stable disease,SD)为病灶减小程度<50%,或增大程度>25%,维持时间在4周或以上;进展(progressive disease,PD)为恶性肿瘤增大幅度>25%,或者有新病灶出现。总有效率=(CR+PR)/总例数×100%。
1.3.2 肝功能
治疗前后抽取患者空腹静脉血,采用化学氧化法检测总胆红素(total bilirubin,TBIL)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平。
1.3.3 预后血清学指标
治疗前后采集患者空腹静脉血,采用酶联免疫吸附法检测血清胸苷激酶1(thymidine kinase 1,TK1)、趋化因子CXC配体13(CXCchemokine ligand 13,CXCL13)水平。
1.4 统计学方法
采用SPSS23.0统计软件分析数据,计数资料数据用(%)表示,用x2值检验,计量资料数据用(¯x±s)表示,用t检验,P<0.05有统计学意义。
2 结果
2.1 两组患者治疗前后肝功能对比
治疗后观察组TBIL、ALT、AST水平均低于对照组(P<0.05)。见表1。
表1 肝功能对比(±SD)
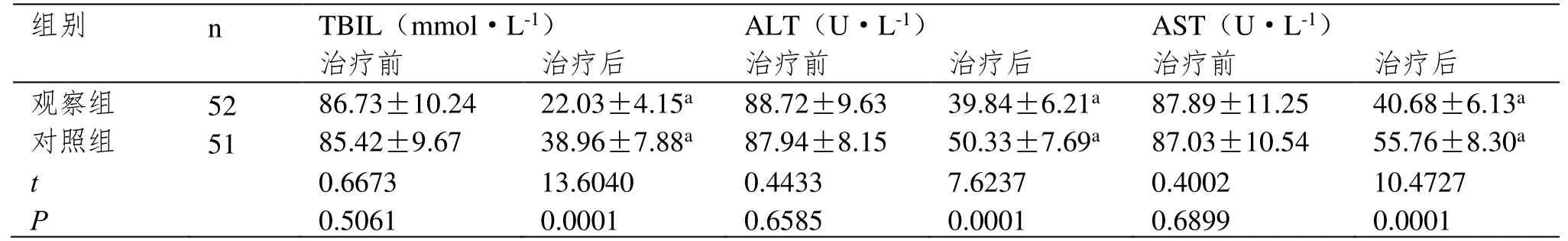
表1 肝功能对比(±SD)
注:与治疗前比较,aP<0.05。
?
2.2 两组患者治疗前后血清TK1、CXCL13对比
治疗后观察组TK1、CXCL13水平均低于对照组(P<0.05)。见表2。
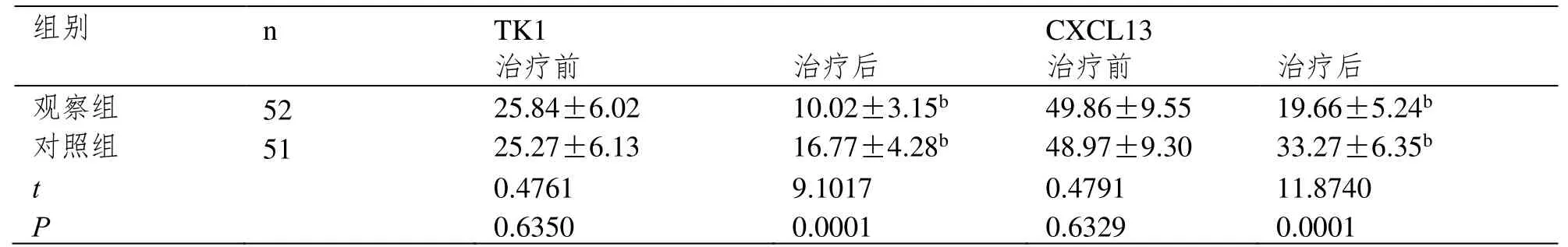
表2 TK1、CXCL13水平对比(¯x±s,μg·L-1)
2.3 两组患者临床疗效对比
观察组CR25例,PR11例,SD12例,PD4例,其总有效率为69.23%;对照组CR10例,PR15例,SD13例,PD13例,其总有效率为49.02%;两组对比有统计学意义(χ2=4.3553,P=0.0369)。
3 讨论
肝癌患者常表现为日渐消瘦、肝区疼痛、纳差等临床症状,如不及时给予规范化治疗,可造成肝癌肿瘤细胞跟随血液扩散至全身,严重威胁患者生命安全。对于肝癌患者实施微波消融术治疗,其通过偶极分子在微波辐射作用下产生旋转而产生热效应进行杀灭肝癌肿瘤细胞,在短时间内肿瘤病灶局部可产生一定程度高温,使肿瘤细胞发生不可逆性的凝固性坏死现象,可有效杀灭患者机体内肿瘤细胞,并抑制肿瘤细胞进一步扩散;微波消融术的消融范围可达肿瘤病灶边界1cm处,通过电压改变肿瘤组织内水分子极性,使其出现高速振荡摩擦生热效果,进而发挥杀灭肿瘤细胞的效果[3-5]。对照组单独采用微波消融术治疗可杀灭肝癌肿瘤细胞,但肿瘤在肝脏内侵袭易形成微卫星样病灶,使手术消融后仍存在边缘处癌症细胞残留,同时在手术过程中对恶性肿瘤施加压力极易造成肿瘤癌栓脱落,进而提高癌症复发率。
本研究显示,观察组TBIL、ALT、AST水平均优于对照组,提示经微波消融术前行TACE治疗可有效促进肝癌患者肝功能恢复。TACE治疗是将化疗药物直接灌注至控制肿瘤血供动脉内,减低或阻断肝动脉供血可阻滞癌细胞血供,可增大肿瘤细胞内药物浓度,影响正常肿瘤细胞血供状态,造成肿瘤细胞受损,机体内自由基、溶酶体被激活,进而导致肿瘤细胞坏死,达到治疗肿瘤的目的。在微波消融术前进行TACE治疗可帮助患者更彻底的消除肿瘤病灶,改变肝炎发展至肝硬化最终生成肝癌的病理过程,阻滞肝硬化细胞的增生和癌变,进而减轻肝功能受损情况,促进患者肝功能恢复[6]。本结果显示,观察组TK1、CXCL13水平优于对照组,提示经微波消融术前行TACE治疗可抑制肿瘤病灶转移。TACE通过采用碘化油和表阿霉素阻塞治疗,可在肿瘤DNA复制过程中发挥抑制作用,一定程度上缩小恶性肿瘤体积,进一步阻断肿瘤组织的血供,促使肿瘤组织缺血坏死;而动脉灌注可将治疗药物快速注射于肿瘤供血动脉,长时间作用在恶性肿瘤组织内,利用药物毒性与灌注效应提高抗肿瘤效应。在微波消融术前进行TACE治疗,因肝癌细胞具有嗜碘效应,重离子碘与高强度微波会共同产生高温效果,可扩大消融范围,进而增大杀灭肿瘤细胞强度,有效抑制肝癌肿瘤细胞的扩散和复发,降低TK1、CXCL13水平[7]。结果显示,观察组总有效率高于对照组有明显差异,提示在微波消融术前行TACE治疗可提高临床疗效。通过TACE治疗可阻止肝癌动脉血液供应,使肿瘤细胞坏死,减小恶性肿瘤直径,同时还可降低微波消融术过程中动脉血流所生成的“热沉降效应”,提高消融效果;在TACE治疗后肿瘤病灶处于缺血缺氧、水肿状态,可充分提供热量传递有利条件,增大肿瘤细胞热敏感性,使微波消融过程中低温仍可杀死肿瘤细胞的效果,提升临床疗效[8]。
综上所述,微波消融术前行TACE对肝癌患者治疗,可有效降低TK1、CXCL13水平,抑制肿瘤细胞转移复发,促进肝功能恢复,提升临床疗效。

