洋参御唐方对高糖诱导下人肾小球系膜细胞增殖及TIMP-1 mRNA、MMP-9 mRNA表达影响
梁硕,孙宇婷,王萍,赵大鹏,2*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
糖尿病(diabetes mellitus,DM)目前在我国为多发性常见疾病之一,其临床发病率在近年来、世界各国范围内,逐年呈上升趋势。而随着病情病程的发展,大多数患者也可因此而导致微血管的局部病变。DM的诱因大多与其遗传因素与环境因素有关,大量患者在上述因素长期作用下可引发病变,多表现为累及肾脏。糖尿病肾病(diabetic nephropathy,DN)是DM最常见的慢性微血管并发症,病情的不同程度均对患者日常工作与生活造成较大影响,在身体、心理、经济上都体现出来[1-3]。随着病情的逐渐加重,发展至终末期肾病(ESRD)。
对DN患者进行早期防治,延缓其进展,已成为现今医疗界共识。DN患者肾脏结构的改变主要包括细胞外基质(extracelluar matrix,ECM)的聚积、小球细胞的肥大和肾小膜的扩张,上述皆为评价肾小球硬化纤维化的重要指标。且ECM的合成与降解紊乱是导致肾小球硬化、纤维化的主要原因,其中基质金属蛋白酶(matrix metallo-proteinase,MMPs)是ECM代谢过程中的关键酶之一,其中MMP-9是ECM降解过程中最关键的酶之一。属蛋白酶组织抑制剂(Tissue Inhibitor of Metalloproteinases,TIMPs)是一组能抑制MMPs活性的多功能因子。研究表明,在DN的发生和发展过程中, ECM在肾小球系膜区合成分泌的增加或降解的减少主要依赖于MMPs和TIMPs之间的分泌平衡。经体外研究表明,MMP-9 基因多态性、MMP-9/TIMP-1表达的失衡及活性的改变与DN的发生发展密切相关[4-6]。
洋参御唐方以健脾补肾、益气养阴为治疗法则[7]。经前期临床研究表明,洋参御唐方对DN疗效较好,可缓解糖尿病肾病患者的一般状态、明显改善相关指标,减轻患者焦虑和病痛,其机制主要为保护肾脏的功能,从而延缓DN病情病程的进展。本研究在以往临床与实验研究的基础上,选取HMC为研究对象,观察高糖培养下HMC的增殖,对MMP-9、TIMP-1表达影响,并用洋参御唐方药物血清进行干预,观察洋参御唐方对高糖培养下HMC的影响,并探讨其作用机制。
1 实验材料
1.1 药物及试剂
洋参御唐方:黑龙江省中西医结合研究所药物制剂室生产。组成:西洋参、黄芪、麦冬、山茱萸、龟板、女贞子、山药、白芍、鹿茸等。盐酸贝那普利(洛汀新):北京诺华制药有限公司(生产批号:国药准字H20030514,规格:10 mg/片)。改良型RPMI-1640培养基(美国HyCLone公司);MTT(美国HyCLone公司);PBS(美国HyCLone公司);胎牛血清(美国HyCLone公司);二甲基亚枫DMSO(美国Sigma公司);青霉素、链霉素(华北制药股份有限公司);EDTA (美国Sigma公司);D-葡萄糖干粉(北京宝希迪科技有限公司);多聚甲醛(美国zymed公司);胰蛋白酶(美国HyCLone公司)。
1.2 实验仪器
Multiskan354型酶标仪( Perkin Elmer公司VICTOR×3型),CO2恒温培养箱(赛默飞公司,型号:3111),MR18.12高速冷冻离心机(大连美仑生物技术有限公司),细胞计数板(上海巴疚实业有限公司),实时荧光定量PCR仪(MJ,Mini-Opticon2)。
1.3 实验动物
清洁级健康雄性Wistar大鼠60只,由黑龙江中医药大学实验动物中心提供,6周龄,体质量(200±20)g,动物合格证号:SCXK(黑)2013-002。由黑龙江中医药大学动物实验中心提供,实验室温度22~25 ℃,相对湿度40%~75%。
2 实验方法
2.1 含药大鼠血清的制备
将60只大鼠适应性喂养1周,依体质量进行编号,按“随机数字表法”分成6组,每组10只。分别为对照组、洋参御唐方(高、中、低)剂量组、高糖组、贝那普利组。依据人与大鼠给药剂量比例进行等效转换,分别按2.7 g/(kg·d)给予洋参御唐方高剂量组大鼠,按1.35g/(kg·d)给予洋参御唐方中剂量组大鼠,按0.67 g/(kg·d)给予洋参御唐方低剂量组大鼠,按0.9 mg/(kg·d)给予贝那普利组大鼠分别进行对应药物的灌胃给药,对照组予以等体积的生理盐水灌胃,每天1次,共7 d,饮食均正常。实验末次给药2 h后在离心管中加入抗凝剂,待大鼠行眼球取血后混匀,室温4 ℃静置化,3 000 r/min离心10 min,同组血清互相混匀,经56 ℃ 30 min灭活补体,0.22 μm无菌过滤除菌,分装于-80 ℃冻存。
2.2 细胞的培养
人肾小球系膜细胞惠赠于黑龙江中医药大学基础医学院实验室;HMC细胞复苏后将细胞悬液接种于培养瓶,培养箱环境设置为37 ℃、5%CO2,利用倒置显微镜观察到细胞贴壁后,吸弃培养液,加适量PBS缓冲液洗净细胞,弃去未贴壁细胞,吸除PBS,加入2 mL培养液,继续置培养箱培养,细胞生长状态良好。每隔1~2 d换新鲜培养基1次,待细胞生长至80%~90%融合时,进行传代培养。选取4~8代细胞进行实验。
2.3 实验分组及给药
实验分为6组:对照组,洋参御唐方高、中、低剂量组,高糖组,贝那普利组。对照组给予10%大鼠血清+RPMI-1640培养液,其余5组给予对应组别10%大鼠血清+30 mmol/L D-葡萄糖+RPMI-1640培养液。
2.4 MTT法检测洋参御唐方对高糖培养下HMC増殖的影响
取健康对数生长期的贴壁人肾小球系膜细胞,经过蛋胰白酶消化后用无菌胶头滴管吹打细胞,并制备成单细胞悬液,经细施计数板计数处理,配成密度为4×104cell/mL。均匀接种于96孔板中。每孔加培养液200 μL,并用等体积的PBS将细胞周围的孔填充。将培养板置细胞培养箱中培养,待细胞生长至80%融合,换为无血清培养液培养24 h,使细胞处于G0期,将其分为6组,依次加对应的对照、含药血清、高糖培养液,接连培养至24 h、48 h、72 h时,避光条件下每孔加15 μLMTT溶液,置培养箱孵育4 h。孵育停止后,弃上清液,分别加入150 μLDMSO溶液,振荡10 min使结晶充分溶解。用酶联仪测定光吸收值即A值,选择测定波长490 nm,记录结果。并绘制细胞的生长曲线。重复实验3次。
2.5 Real-time法检测各种处理因素对HMC中TIMP-1 mRNA、MMP-9 mRNA水平的影响
2.5.1 细胞RNA的提取
取对数生长期的HMC细胞,含10%FBS RPML-1640培养液培养细胞至细胞贴壁,待细胞达80%融合,换为无血清培养液,同步细胞24 h,分别加入对应培养液(具体分组与给药处理方法同上)。于48 h、72 h培养后,弃上清,加PBS缓冲液,清洗3遍,弃除吸干。将各培养瓶中加入1 mL Trizol Reagent的细胞裂解溶液中加入200 μL氯仿,盖严管盖,充分混匀。待溶液呈乳白状充分乳化后,静置其5 min。13 000 rpm 4 ℃离心10 min。将约600 μL上清液转至新的离心管中。在取出的上清液中加入600 μL异丙醇,将离心管中液体充分混匀后于-20 ℃放置10 min。在13 000 rpm 4 ℃离心10 min。弃去上清液,倒入75%乙醇1 mL洗涤离心管的管壁。4 ℃ 13 000 rpm/min离心5 min,弃上清液。室温干燥5~15 min,加入100 μL RNase Free H2O吹打用以RNA的助溶。
2.5.2 RNA浓度测定及纯度测定
总RNA的提取:利用高纯总RNA快速提取试剂盒(北京百泰克生物)提取样本总RNA。将样本中加入1 mL RL裂解液,充分混匀,室温下放置5 min。加200 μL氯仿,盖严管盖,充分混匀,室温放置3 min,4 ℃ 12 000 rpm离心10 min,RNA主要存在于溶液最下层的水相中,水相体积约为所用裂解液50%。将水相移至新管,缓慢加同体积70%乙醇,混匀后转入吸附柱RA中,4 ℃、12 000 rpm离心30 s,弃去废液。加入500 μL去蛋白液RE,4 ℃、12 000 rpm离心30 s,弃废液。再加入500 μL漂洗液RW,静置2 min,4 ℃、12 000 rpm离心30 s,弃残液。将吸附柱放入1.5 mL收集管,4 ℃、12 000 rpm离心2 min,弃残液。将吸附柱RA转入新管,加30 μL RNase-free ddH2O,放置2 min,4 ℃、12 000 rpm离心2 min,即得到样本总RNA。
2.5.3 RNA反转录
将得到的RNA样本进行反转录,对上步实验所得的RNA样本进行反转录以得到对应的cDNA。反应体系如下:将1 μg总RNA、1 μL random引物、1 μL oligo(dT)15、2 μL dNTP(2.5 mM)加入至PCR薄壁管中,加DEPC水至总反应体系为14.5 μL。70 ℃加热5 min后速冷2 min,离心收集反应液稍离心,65 ℃孵育5 min,取出冰水浴,稍离心,按顺序分别加入4 μL 5×reaction buffer、0.5 μL RNasin、1 μL M-MLV(200 U),总体积为20 μL混匀。用移液器混匀后25 ℃温浴10 min,42 ℃温浴50 min。95 ℃加热5 min终止反应,冷冻保存。
2.5.4 Real-time PCR目的片段扩増的反应
引物合成:MMP-9、TIMP-1及GAPDH的引物各一对,由上海生工合成。引物序列见表1。

表1 引物序列表
2.6 统计学方法
3 实验结果
3.1 葡萄糖对HMC增殖的影响
由表2可见,与对照组比较,高糖(30 mmol/L)环境对人肾小球系膜细胞在培养24 h、48 h和72 h三个时段对系膜细胞刺激后均有增殖效应,差异有统计学意义。且细胞增殖作用最明显为48 h后,作用时间延长到72 h呈下降趋势。
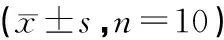
表2 葡萄糖对不同时间点HMC增殖的影响
3.2 不同处理因素对HMC增值的影响
见表3。MTT结果显示,与对照组相比,高糖(30 mmol/L)能显著促进人肾小球系膜细胞(HMC)的增殖(24、48和72 h,P<0.01)。低剂量洋参御唐方(72 h,P<0.05)、中剂量洋参御唐方(48和72 h,P<0.01)和高剂量洋参御唐方(24、48和72 h,P<0.01)处理后,明显抑制高糖对HMC的促增殖作用,差异具有统计学意义。而且,贝那普利处理后也能显著抑制HMC的增殖(48和72 h,P<0.01)。洋参御唐方对高糖刺激下HMC增殖具有明显抑制作用,呈一定剂量依赖性(与对照组相比,P<0.01;与高糖组相比,P<0.05或P<0.01)。
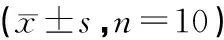
表3 不同处理因素对HMC增殖的影响
见表4、5。Real-time PCR结果显示,对照组细胞存在一定水平MMP-9和TIMP-1 mRNA的本底表达。与对照组相比,高糖刺激能下调MMP-9 mRNA表达,并上调TIMP-1 mRNA表达(P<0.01)。与高糖组相比,中、高剂量洋参御唐方和贝那普利处理后,都能显著上调MMP-9 mRNA的表达,并下调TIMP-1 mRNA表达(中剂量组,P<0.05;高剂量组,P<0.01),差异具有统计学意义(与对照组相比,P<0.01;与高糖组相比,P<0.05和P<0.01)。
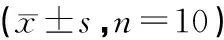
表4 各组MMP-9 mRNA表达相对值比较
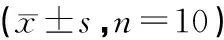
表5 各组TIMP-1 mRNA表达相对值比较
4 讨论
糖尿病肾病是由糖尿病发展而来,因消渴是以阴虚内热为主要病机,兼有瘀血阻络,主要病变脏腑在肺,脾,肾三脏,缠绵不愈则导致肾阳衰败,阳不化气,水湿内停,从而膀胱气化不利,小便洪浊[8]。古代医学认为此病成因与身体因素关系密切,如《灵枢·五变篇》说“五脏皆柔弱者,善病消瘅”[9]。因此当糖尿病累及肾脏损害的阶段多属中医病证中的阴阳两虚证[10],即消肾是消渴的进一步加重。肾精亏虚,抑或肾元不足,下元虚冷气化不能,则致阴精不能荣于上而发为口消;肾气不固,致精微走泄则发为下消。故现代认为脾肾亏虚为DN发生发展的病机关键,且尤以肾虚为著。根据以上表述,洋参御唐方根据古今医学对DN病机的认识行健脾补肾、益气养阴之效,标本同治,补泻兼施[11]。本方西洋参具健脾补肾,益气养阴之效;黄芪重补气生阳,益气固表。二药合用,补虚损、扶正气;山药增补脾养肺益肾之功;龟甲重滋阴潜阳[12];玉竹、麦冬、乌梅增养阴、益胃、生津之功;女贞子可清虚热;山茱萸收敛固涩;白芍敛阴;加鹿茸补阳调冲任[13]。本方在前期临床治疗糖尿病肾病过程中已显示出较好的减少蛋白尿的疗效,具有独特的优势。因此本实验研究欲借助观察DN大鼠一般情况、生化指标、病理学改变及细胞因子等的改变来探讨洋参御唐方治疗DN的机理。
大量研究显示,肾小球系膜细胞在肾脏疾病的发生发展过程中发挥重要作用,具有产生细胞因子、吞噬清除大分子物质、分泌肾素的作用,系膜细胞的增殖与细胞外基质的堆积是肾小球硬化的关键机制,如SLN、IgAN、感染后肾炎等疾病发生与发展中具有重要作用。系膜细胞在病理情况下可通过自分泌或旁分泌形式来释放多种细胞因子,如血管内皮生长因子(VEGF)、血小板源生长因子、生长激素(GF)、转化生长因子β(TGF-β)和表皮生长因子(EGF)、结缔组织生长因子(CTGF)等[14],造成ECM产生增加,从而促进肾脏疾病的进一步发展,加重肾小球的损害,晚期则出现肾小球硬化,最终引起肾功能衰竭[15]。
肾小球系膜细胞是肾脏纤维化的主要效应细胞,MC的异常增殖是肾脏纤维化发生发展的关键环节[16]。MC的异常增殖及炎症介质的释放导致了ECM的积聚,这一机制是DN进展的关键。高血糖是引起糖尿病患者及糖尿病动物模型的肾小球系膜细胞异常增殖的最初因素,在高糖环境中一些细胞因子及TGF-β都参与了对MC的增殖作用。研究发现,高糖培养的HMC与DN大鼠的肾小球系膜细胞在病理改变上存在着相同的过程[17]。根据MTT结果看,与对照组相较,高糖组细胞生长活跃,这可能与高糖环境刺激HMC增殖与激活细胞内某些基因转录及蛋白质的表达有关。给药组(洋参御唐方高、中、低剂量组及贝那普利组)对高糖培养下的HMC增殖均有抑制作用。通过上面实验可得,洋参御唐方能够在DN发生发展过程中减少ECM的积聚,防治蛋白尿,延缓肾小球硬化都具有重要意义,且对高糖培养下HMC增殖均有抑制作用,且从观察时间与给药组不同剂量发现,洋参御唐方对HMC的增殖抑制作用呈时间依赖性与浓度依赖性关系。高糖环境下培养的系膜细胞中MMP-9表达增加,TIMP-1表达减少。
近年来研究表明,MMP-9的主要功能是参与ECM的降解与重建,可切断任何ECM的成分,是ECM降解过程中最关键的酶之一。当受到某种刺激因子导致体内ECM产生过多时,也诱导了MMP-9的表达增加。现今研究报道,检测尿液中MMP-9及IV型胶原的含量可能对评估2型糖尿病患者,特别是患者处于早期肾损害的程度起作用。在正常生理情况下,尿液中的明胶酶主要是MMP-9,而当2型糖尿病患者出现蛋白尿时,其尿液中的MMP-9的含量均显著增加[5]。TIMPs主要功能是对MMPs活性的抑制,通过抑制MMPs的活性来调节细胞外基质的代谢;此外在细胞生长及繁殖、血管生成等生理和病理学方面发挥一定的作用。TIMPs对MMPs活性的抑制不仅存在一定的交叉性,而且存在特定的选择性,在调节ECM的代谢中起重要的作用[18]。MMP-9是TIMP-1的作用底物之一,因此TIMP-1在DN的发生发展过程中发挥着重要作用。Phillips[19]等研究发现, HMC在高糖环境下培养24 h后, TIMP-1的水平比对照组增加了8倍。在高糖环境下既能使HMC的TIMP-1的mRNA表达增加2.1倍,使ECM降解减少[20]。上述表明,高糖既能使TIMP-1的表达增加, MMP-9的表达下调,MMP-9活性受到抑制,MMP-9/TIMP-1的失衡导致了ECM降解的减少,也加剧了DN的发生发展。
综上所述,本实验研究说明洋参御唐方都能够抑制HMC的增殖,减少ECM积聚,使MMP-9 mRNA的表达上调,且以洋参御唐方高剂量组的作用最明显,具有延缓肾小球硬化进展的作用。在高糖环境下HMC中TIMP-1 mRNA的表达增加,而洋参御唐方和贝那普利组的TIMP-1 mRNA表达均受到抑制,且以洋参御唐方高剂量组对TIMP-1 mRNA表达抑制作用更为明显,能降低TIMP-1,调控降解酶系 MMP-9/TIMP-1 比例,抑制 DN 细胞外基质沉积。

