酸汤对断奶仔猪生长性能、免疫性能、抗氧化性能及肠道微生物区系的影响
卢盛勇 陈胜昌 张滔滔 陆小萝 李景上 李海霞
(贵州大学动物科学学院,贵阳 550025)
2020年7月1日起,我国开始在饲料中禁用抗生素,但饲用抗生素的禁用会降低动物的生长性能,使发病率上升,导致养殖经济效益降低。因此,急需开发饲料微生态制剂、天然植物提取物等安全饲料添加剂,以保障畜牧业的生产性能、减少养殖损失[1-2]。酸汤制作技术含量低,来源广泛,价格低廉,其含有酵母菌、乳酸菌和醋酸菌等有益菌群及丰富的营养成分,具有吸收快、无残留、无污染等特点,对调节肠道微生态平衡、预防消化道疾病和促进机体健康有着不可忽视的作用[3-4]。鉴于目前有关于酸汤对断奶仔猪生长性能等方面影响的研究较少,本试验拟在饲粮中添加酸汤,研究其对断奶仔猪生长性能、免疫性能、抗氧化性能及肠道微生物区系的影响,旨在为酸汤在断奶仔猪生产中的应用提供数据支持。
1 材料与方法
1.1 试验动物与设计
试验选用31日龄、体重[(5.34±0.86)kg]相近、健康的复兴猪断奶仔猪45头,随机分为5组,每组3个重复,每个重复3头。试验Ⅰ组为对照组,饲喂基础饲粮,试验Ⅱ、Ⅲ、Ⅳ、Ⅴ组分别在基础饲粮的基础上添加0.5%、1.0%、1.5%、2.0%的酸汤,进行为期47 d的饲养试验,其中预试期7 d,正试期40 d。
1.2 基础饲粮与酸汤
基础饲粮参照中华人民共和国农业行业标准NY/T 65—2004配制,其组成及营养水平见表1。酸汤的制作方法:采用传统制作豆腐所产生的液体部分,待其冷却发酵变酸后,再将酸豆腐浆与已处理好的萝卜菜(将萝卜菜洗净、切段,煮5 min捞出,并用自来水冲洗使其冷却)共同放入密闭的罐子中,100 L豆腐浆放5 kg萝卜菜,室温发酵3 d,所测pH为4.0左右。对本试验所使用的酸汤进行高通量测序发现,酸汤中细菌种类较为丰富,其中隶属于厚壁菌门的乳杆菌属(Lactobacillus)在属水平上占绝对优势。
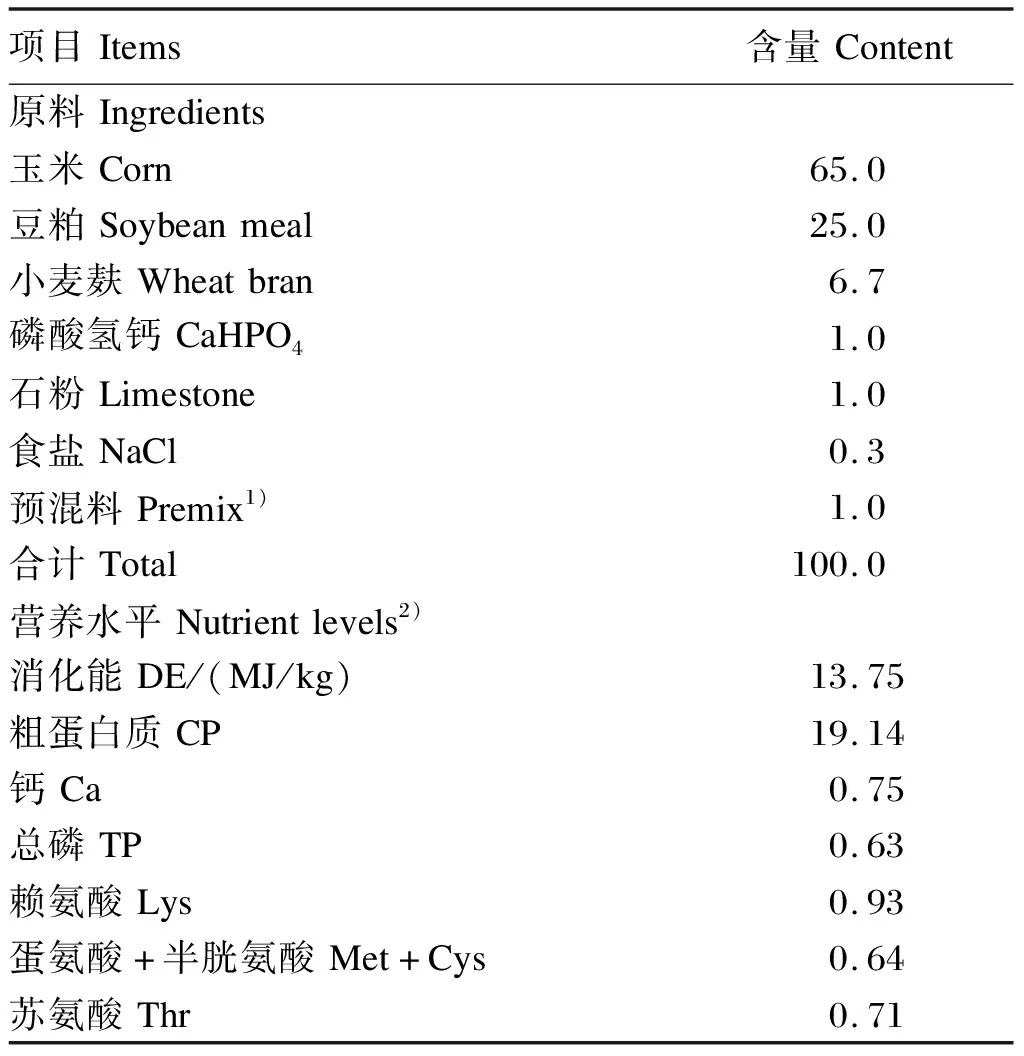
表1 基础饲粮组成及营养水平(风干基础)
1.3 样品采集与测定
1.3.1 生长性能与腹泻率
试验期间每日记录断奶仔猪的采食量,分别于第1、20、40天08:00空腹称重,计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。试验期间每日记录猪的腹泻情况,计算腹泻率。
ADFI(g/d)=总耗料量/试验天数;ADG(g/d)=总增重/试验天数;F/G= ADFI/ADG;腹泻率(%)=[腹泻头数/(每组猪头数×试验天数)]×100。
1.3.2 血清免疫指标和抗氧化指标
试验结束当天(正试期第40天)08:00,每个重复选3头接近平均体重的断奶仔猪,空腹前腔静脉采血5 mL,3 000 r/min离心15 min,分离血清,用于检测免疫指标和抗氧化指标。血清免疫指标包括免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)含量,血清抗氧化指标包括谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性与丙二醛(MDA)含量。上述指标测定所用试剂盒均为南京建成生物工程研究所产品,操作步骤严格按照试剂盒说明书进行。
1.3.3 小肠形态
试验结束时,分别从试验Ⅰ、Ⅲ、Ⅴ组中各选3头仔猪进行屠宰并采集小肠各段(包括十二指肠、空肠及回肠)各3 cm左右,生理盐水清洗后固定于10%中性甲醛溶液中,制作石蜡切片,苏木精-伊红(HE)染色以检测肠道形态,测量小肠各段(十二指肠、空肠、回肠)的绒毛高度(VH)和隐窝深度(CD),计算绒隐比(VH/CD)。
1.3.4 肠道微生物区系
试验结束时,分别从试验Ⅰ、Ⅲ、Ⅴ组中选取3头仔猪进行屠宰,用事先灭菌的细线将盲肠两端结扎,确保盲肠内容物充足,剪下结扎的盲肠段,立刻转入100 mL的无菌离心管中,置于-80 ℃冰箱保存,采用Illumina Miseq Regent V3 kit进行测序。
1.3.5 生物信息分析
Miseq测序得到的PEreads首先根据barcode区分每个样本,而后对序列质量进行质控和过滤,再根据overlap关系进行拼接,拼接后的序列再次进行质控和过滤,最后得到优化序列。将优化序列进行操作分类单元(OTU)聚类分析[5-6]和物种分类学分析,基于OTU聚类分析结果,对OTU进行样本内的alpha多样性分析和测序深度检测。
1.4 数据统计与分析
本试验全部数据均采用Excel 2013进行初步整理分析,应用SAS 9.3软件中的PROC GLM过程进行统计分析。平均值的多重比较采用Duncan氏法进行,差异显著性水平定为P<0.05。试验数据以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 酸汤对断奶仔猪生长性能与腹泻率的影响
由表2可知,试验Ⅴ组的ADFI显著高于试验Ⅰ组(P<0.05),其他组间ADFI差异不显著(P>0.05)。试验Ⅱ、Ⅲ、Ⅳ、Ⅴ组的ADG显著高于试验Ⅰ组(P<0.05),试验Ⅴ组的ADG还显著高于试验Ⅱ、Ⅲ组(P<0.05)。各组的F/G差异不显著(P>0.05)。试验Ⅴ组的腹泻率显著低于试验Ⅰ、Ⅱ、Ⅳ组(P<0.05)。

表2 酸汤对断奶仔猪生长性能与腹泻率的影响
2.2 酸汤对断奶仔猪血清免疫指标的影响
由表3可知,试验Ⅴ组血清IgG含量显著高于试验Ⅰ、Ⅱ、Ⅲ组(P<0.05),试验Ⅳ组血清IgG含量显著高于试验Ⅱ组(P<0.05)。各组间血清IgA、IgM含量差异不显著(P>0.05)。

表3 酸汤对断奶仔猪血清免疫指标的影响
2.3 酸汤对断奶仔猪血清抗氧化指标的影响
由表4可知,试验Ⅳ组血清GSH-Px活性最高,显著高于其余各组(P<0.05)。试验Ⅴ组血清SOD活性显著高于试验Ⅰ、Ⅱ、Ⅲ、Ⅳ组(P<0.05);试验Ⅳ组血清MDA含量显著低于试验Ⅰ、Ⅱ组(P<0.05)。
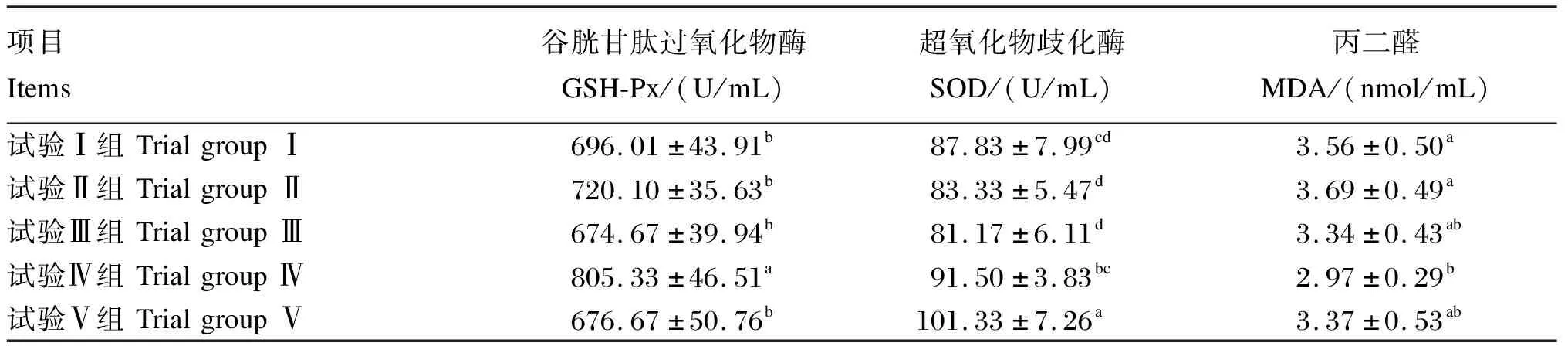
表4 酸汤对断奶仔猪血清抗氧化指标的影响
2.4 酸汤对断奶仔猪小肠形态的影响
由表5可知,各组十二指肠绒毛高度差异不显著(P>0.05)。试验Ⅲ、Ⅴ组十二指肠、空肠和回肠隐窝深度与试验Ⅰ组相比在整体上有降低趋势,但差异不显著(P>0.05)。相对于试验Ⅰ组,试验Ⅲ、Ⅴ组十二指肠和回肠绒隐比均有不同程度的增加,但差异不显著(P>0.05);试验Ⅴ组空肠绒隐比显著高于试验Ⅰ组(P<0.05)。
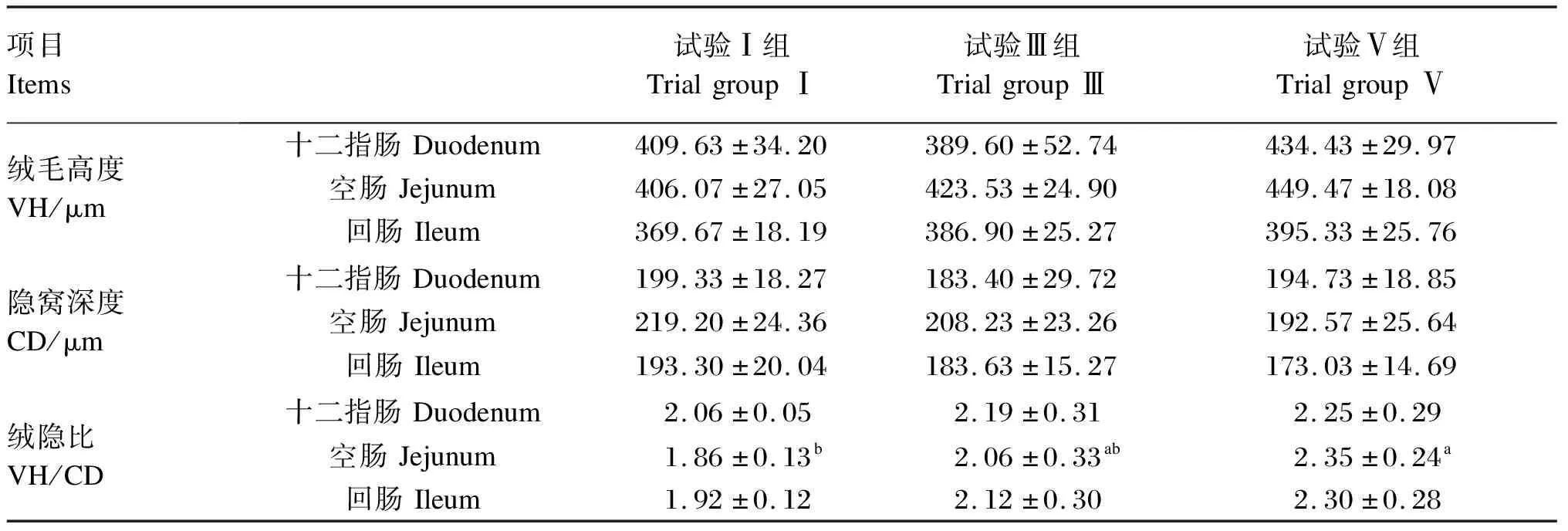
表5 酸汤对断奶仔猪小肠形态的影响
2.5 酸汤对断奶仔猪肠道微生物区系的影响
2.5.1 alpha多样性分析
由表6可知,各组的有效序列数均较高,在46 678~51 905;各组的覆盖度(Coverage)也均在0.999以上,说明测序结果已基本覆盖样本的多样性。试验Ⅰ、Ⅲ、Ⅴ组之间OTU数目差异不显著(P>0.05)。试验Ⅰ、Ⅲ组的Shannon指数显著高于试验Ⅴ组(P<0.05);试验Ⅴ组的Simpson指数最高,显著高于试验Ⅰ组(P<0.05)。Chao1指数和Shannon指数各组间差异不显著(P>0.05)。
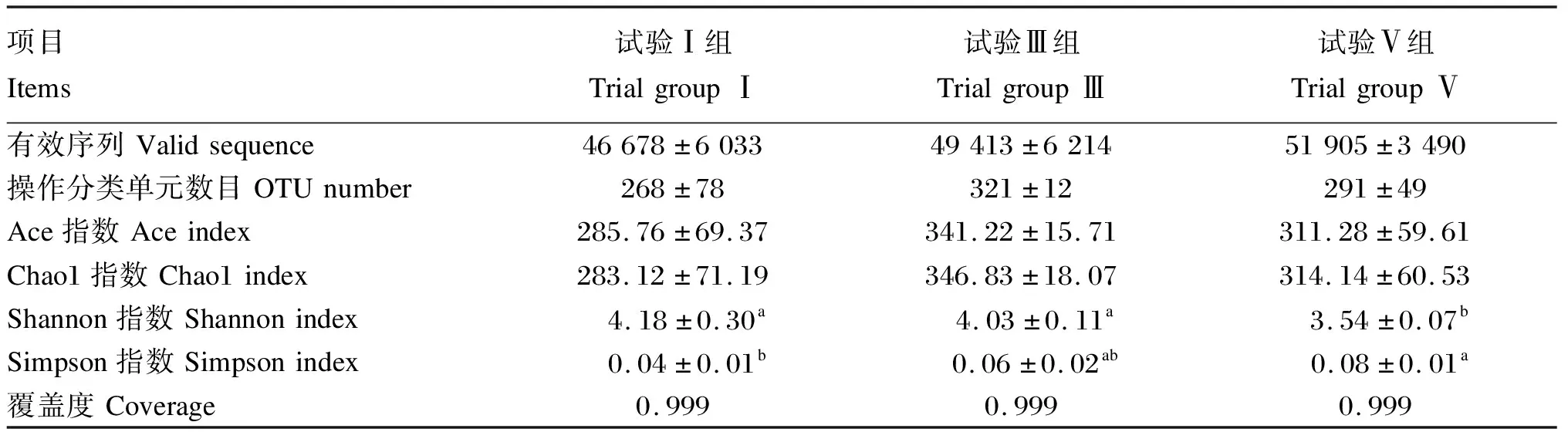
表6 alpha多样性指数
2.5.2 稀释曲线
采用对序列进行随机抽样的方法,以抽到的序列数与它们所能代表OTU数目构建稀释曲线,当曲线趋向平坦时,说明测序数据量合理,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU。从图1可知,所有样本的稀释曲线趋向平坦,说明测序数据量已基本合理。

T1:试验Ⅰ组 Trial group Ⅰ;T2:试验Ⅲ组 Trial group Ⅲ;T3:试验Ⅴ组 Trial group Ⅴ。下图同 The same as below。
2.5.3 韦恩图分析
韦恩图可用于统计多个样品中所独有与共有的OTU数目,能够比较直观地表现样品的OTU数目组成相似性及重叠情况。由图2可知,3个组之间共有307个OTU,其中试验Ⅰ组独有3个OTU,试验Ⅲ组独有8个OTU,试验Ⅴ组独有19个OTU。
2.5.4 基于OTU的主成分分析(PCA)
通过分析不同样品OTU(97%相似性)组成能够反映样品之间的差异和距离,PCA运用方差分解,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映方差值的2个特征值。由图3可知,试验Ⅴ组相对试验Ⅰ、Ⅲ组分散较远,相似性有较大差异。
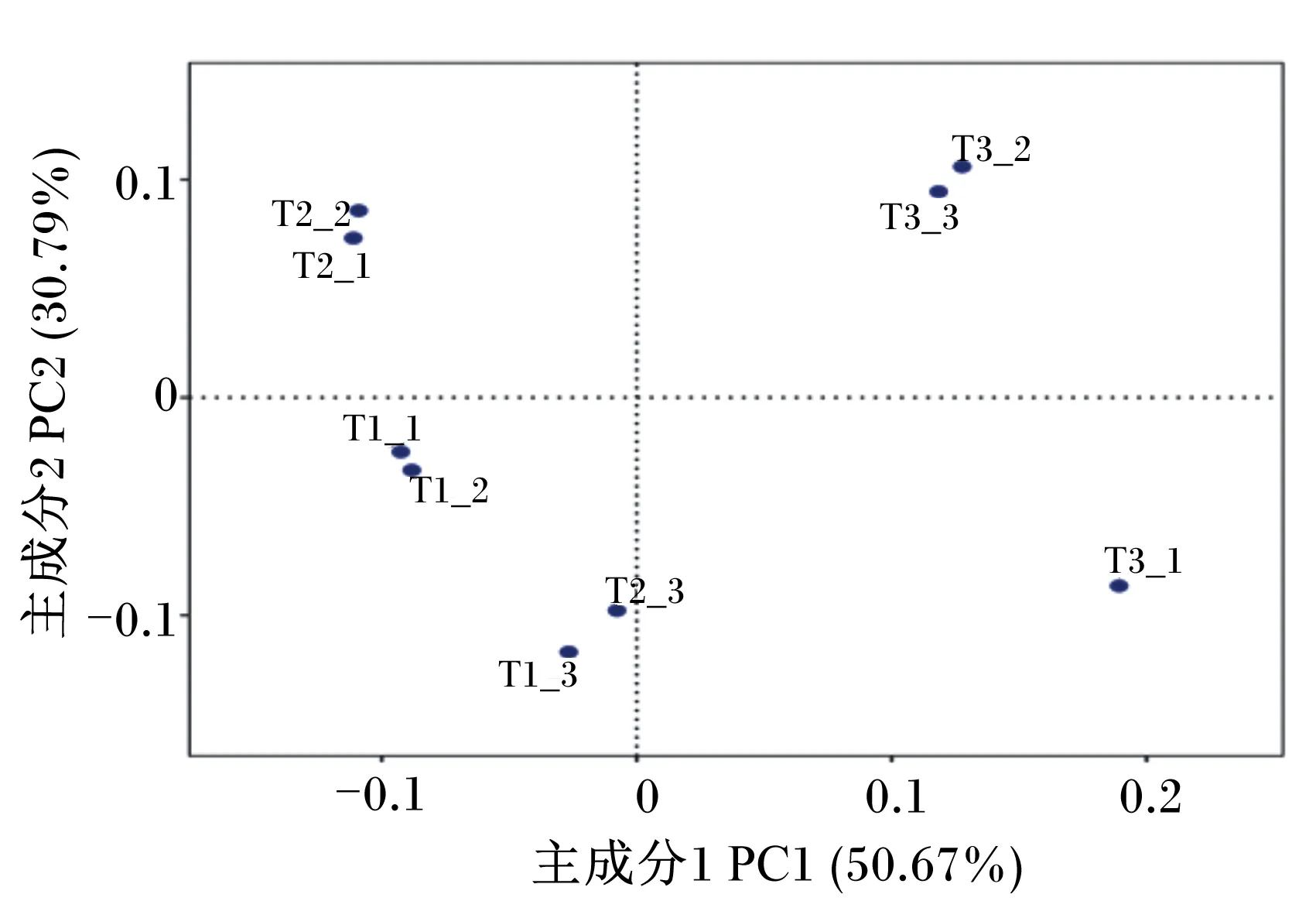
图3 PCA图
2.5.5 仔猪肠道菌群结构
由图4可知,每个样品中厚壁菌门(Firmicutes)都为其主要的门,相对丰度在63.48%~86.06%,其中以试验Ⅴ组厚壁菌门的相对丰度最高。各组间拟杆菌门(Bacteroidetes)的相对丰度变化较大,在3.01%~30.80%,以试验Ⅰ组的相对丰度最高,试验Ⅴ组的相对丰度最低。试验Ⅴ组变形菌门(Proteobacteria)的相对丰度最高,试验Ⅰ、Ⅲ组变形菌门的相对丰度变化不大。
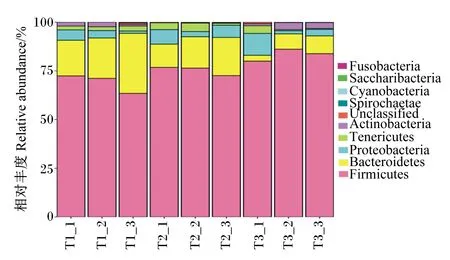
Firmicutes:厚壁菌门;Bacteroidetes;拟杆菌门;Proteobacteria;变形菌门;Tenericutes:无壁菌门;Actinobacteria:放线菌门;Spirochaetae:螺旋体门;Cyanobacteria:蓝藻门;Fusobacteria:梭杆菌门;Unclassified:无法归类。
由表7可知,在属水平上,各组均以乳杆菌属的相对丰度最高,其中试验Ⅴ组乳杆菌属的相对丰度显著高于试验Ⅰ、Ⅲ组(P<0.05)。试验Ⅰ组普氏菌属(Prevotella)的相对丰度显著高于试验Ⅲ、Ⅴ组(P<0.05)。试验Ⅲ组瘤胃球菌属(Ruminococcus)的相对丰度显著高于试验Ⅰ、Ⅴ组(P<0.05)。此外,试验Ⅴ组粪杆菌属(Faecalibacterium)的相对丰度显著高于试验Ⅰ、Ⅲ组(P<0.05)。各组埃希氏菌属(Escherichia)、Leeia、Subdoligranulum、考拉杆菌属(Phascolarctobacterium)的相对丰度差异不显著(P>0.05)。
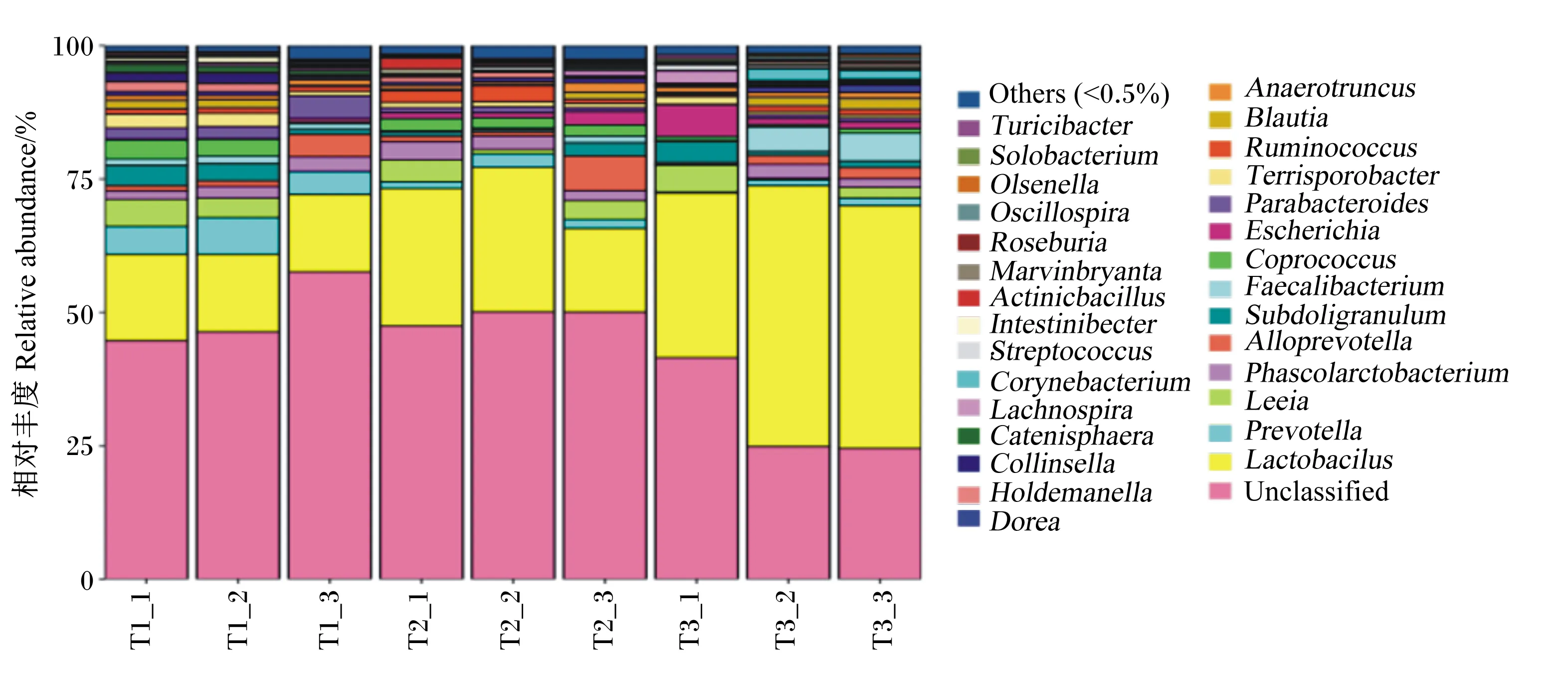
Others:其他;Turicibacter:苏黎世杆菌属;Solobacterium:单胞菌属;Olsenella:欧陆森氏菌属;Oscillospira:颤螺旋菌属;Roseburia:罗斯氏菌属;Actinicbacillus:放线杆菌属;Streptococcus:链球菌属;Corynebacterium:棒杆菌属;Lachnospira:毛螺旋菌属;Collinsella:柯林斯菌属;Dorea:多尔氏菌属;Anaerotruncus:厌氧棍状菌属;Blautia:布劳特氏菌属;Ruminococcus:瘤胃球菌属;Parabacteroides:副杆菌属;Escherichia:埃希氏菌属;Coprococcus:粪球菌属;Faecalibacterium:粪杆菌属;Alloprevotella:拟普雷沃菌属;Phascolarctobacterium:考拉菌属;Prevotella:普氏菌属;Lactobacilus:乳杆菌属;Unclassified:无法归类。
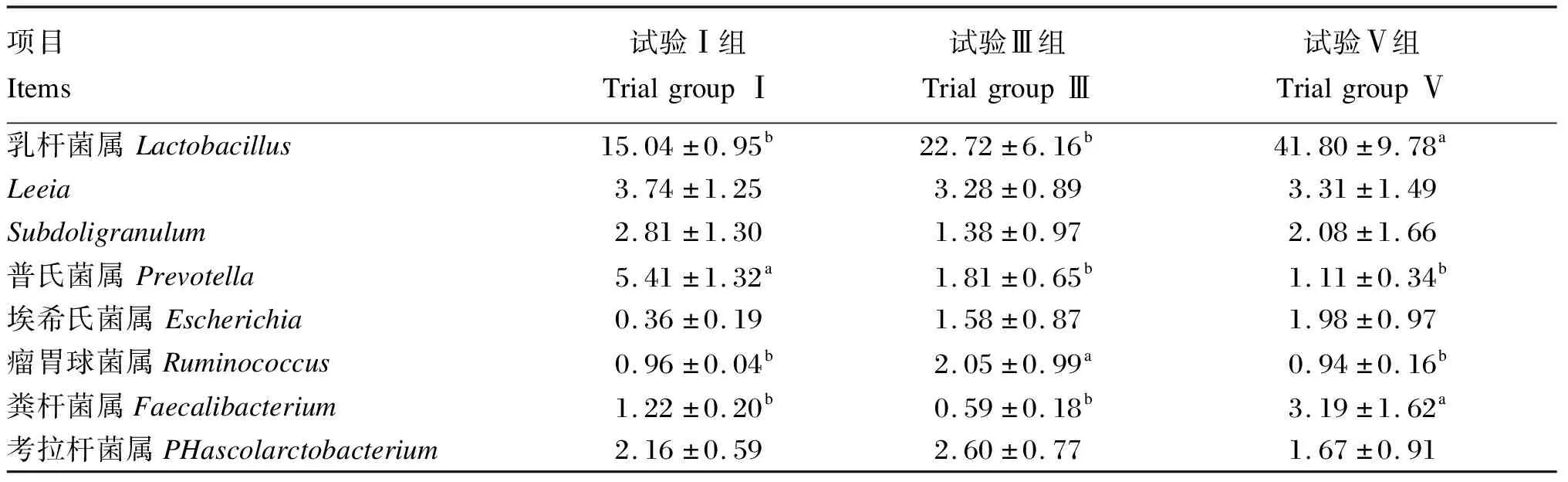
表7 属水平肠道菌群相对丰度
3 讨 论
3.1 酸汤对断奶仔猪生长性能的影响
酸汤中含有丰富的微生物、营养成分、有机酸及矿物质,对调节仔猪肠道微生态平衡有着重要作用,其中的有机酸能促进动物食欲,提高胃排空速率以及消化率,促进矿物质吸收,提高动物生长性能。Walsh等[7]、Guggenbuhl等[8]研究表明,在断奶仔猪饲粮中添加酸化剂可以提高ADG、ADFI。Grilli等[9]研究表明,在饲粮中添加0.3%的有机酸可以显著提高仔猪的ADG和末重。本试验中,饲粮中添加酸汤能提高断奶仔猪的ADFI、ADG,说明酸汤对提高断奶仔猪的生长性能具有一定功效,这与Halas等[10]的研究结果相似。本试验中试验Ⅴ组的生长性能最好,这可能是因为试验Ⅴ组饲粮中酸汤的添加量最大,改善了饲料的适口性,增加了采食量,同时能调节仔猪各方面生理机能。
3.2 酸汤对断奶仔猪血清免疫指标的影响
血清免疫球蛋白含量是反映动物机体免疫性能的重要指标之一,血清中IgA、IgG、IgM含量的升高表明动物体免疫机能增强。Han等[11]用有机酸替代金霉素,结果显示有机酸组血清IgA、IgG含量均高于金霉素组。Long等[12]的研究表明,复合有机酸替代抗生素可以提高断奶仔猪血清IgA含量。Ahmed等[13]在断奶仔猪饲粮中添加0.5%的纯柠檬酸后发现血清IgG含量显著高于阿普霉素组。He等[14]研究表明,柠檬酸、山梨酸等可以提高过氧化氢酶、溶菌酶等免疫相关基因的表达。本试验中试验Ⅴ组血清IgG含量显著高于试验Ⅰ组,这与上述研究结果相似,表明酸汤对仔猪的免疫机制有积极作用。
3.3 酸汤对断奶仔猪血清抗氧化指标的影响
动物血清中的抗氧化指标能直接反映机体的健康状况。张玲玲[15]在断奶仔猪饲粮中添加有机酸和植物精油,试验第28天,有机酸组血清SOD活性显著高于对照组。郭骥[16]在泌乳母猪饲粮中添加乳酸、延胡索酸和柠檬酸组成的复合型酸化剂,发现复合型酸化剂组血清MDA含量显著降低,血清SOD与GSH-Px活性显著增加。刘文辉[17]发现复合酸化剂能显著提高断奶仔猪血清SOD、GSH-Px活性。本试验中,试验Ⅴ组断奶仔猪血清SOD、GSH-Px活性显著高于试验Ⅰ组,且血清MDA含量显著低于试验Ⅰ组,与上述研究结果一致,表明在基础饲粮中添加酸汤能够有效提高断奶仔猪的抗氧化能力。
3.4 酸汤对断奶仔猪小肠形态的影响
仔猪的肠道形态特别是绒毛长度以及隐窝深度是影响仔猪生长性能与肠道健康的重要指标[18]。小肠绒毛的主要作用是吸收营养物质,绒毛高度增加能使小肠与营养物质的接触范围扩大,绒毛越长,机体对营养物质的消化吸收功能越强[19]。由于非常时期,猪成本价格太高,本试验只屠宰了试验Ⅰ组(未添加酸汤组)、试验Ⅲ组(酸汤添加量中间组)和试验Ⅴ组(酸汤添加量最高组)的试验猪,结果显示:添加酸汤的试验Ⅲ组和试验Ⅴ组小肠绒毛高度以及绒隐比均比试验Ⅰ组提高,隐窝深度均有所降低,且试验Ⅴ组空肠绒隐比显著高于试验Ⅰ组,说明酸汤对断奶仔猪的小肠发育产生了有利影响,这可能是因为酸汤中丰富的微生物以及有机酸对仔猪肠道内环境起到了改善作用。Högberg等[20]研究发现,当饲粮中益生菌数量升高时,断奶仔猪肠道内pH显著降低,挥发性脂肪酸含量增加。Risley等[21]在仔猪饲粮中添加1.5%的柠檬酸,胃内容物pH由4.07降到3.82,说明酸汤中有机酸也可以通过降低仔猪肠道pH以及直接作用于细菌等2种途径对肠道内环境进行改善,促进肠道发育。
3.5 酸汤对断奶仔猪肠道微生物区系的影响
肠道微生物区系的稳定直接影响着动物机体的健康,若微生物区系紊乱会导致动物机体免疫性能降低,引起多种疾病的发生[22]。反映alpha多样性的指标有Ace指数[23]、Shannon指数[24]、Chao1指数[25]与Simpson指数[26]等,其中前面3个指数越大,最后1个指数越小,说明样品中的物种越丰富。本试验中,各组的Ace指数与Chao1指数差异不显著,而试验Ⅰ组的Shannon指数最高,显著高于试验Ⅴ组,试验Ⅴ组的Simpson指数最高,显著高于试验Ⅰ组。上述结果表明酸汤能降低断奶仔猪肠道微生物群落多样性,这可能是由于酸汤添加在饲粮中降低了肠道pH以及酸汤中有益菌群的活动对仔猪肠道的有害菌起到了抑制作用。这与姚继明等[27]和汪海峰等[28]在断奶仔猪饲粮中添加复合有机酸对其肠道微生物菌群的影响结果相似。
本试验通过高通量测序发现,在门水平上,各组主要以厚壁菌门、拟杆菌门以及变形菌门为优势菌门,这与Whitehead等[29]的报道一致。Owens等[30]、Ai-Kassi等[31]研究表明,有等机酸可降低消化道pH,破坏革兰氏阴性菌的繁殖,抑制有害菌的发酵。本试验中所测3组样品中厚壁菌门的相对丰度在63.48%~86.06%,拟杆菌门的相对丰度在3.01%~30.80%,且添加酸汤有增加厚壁菌门相对丰度、降低拟杆菌门相对丰度的趋势。Barnes等[32]、曹志华等[33]研究发现,酸化剂能促进乳酸菌的增殖,同时其代谢产物乳酸能阻止大肠杆菌、沙门氏菌等的增殖,且乳酸菌能产生对沙门氏菌有杀灭作用的过氧化氢。饲粮中添加2.0%酸汤的试验Ⅴ组的乳杆菌属相对丰度显著高于未添加酸汤的试验Ⅰ组,表明在基础饲粮中添加酸汤可改善断奶仔猪肠道菌群结构,有利于肠道有益菌的增殖,这与李小飞等[34]将微生态制剂应用于断奶仔猪饲粮所得效果一致。
4 结 论
饲粮中添加酸汤能提高断奶仔猪的生长性能、免疫机能和抗氧化能力,能提高空肠绒隐比,有利于小肠形态发育;基于OTU的PCA发现饲粮粮中添加酸汤一定程度上改变了断奶仔猪盲肠菌群结构。

