宿主防御肽的生物学功能、表达特性及调控机制
窦秀静 张嘉依 王怡茹 单安山
(东北农业大学动物科学技术学院,哈尔滨 150038)
2019年7月9日,农业农村部发布“全面禁抗”公告,公告提出:为维护我国动物源性食品安全和公共卫生安全,决定停止生产、进口、经营、使用部分药物饲料添加剂,并对相关政策进行调整。研究表明,长期使用饲用抗生素,导致细菌的耐药性增强,使动物机体抵抗病原微生物感染的能力下降;此外,药物残留也严重影响了人类健康。因此,国内外科研人员正积极寻找可以增强动物机体免疫能力的饲用抗生素替代途径。宿主防御肽(host defense peptides,HDPs)作为机体先天性免疫防御系统的重要组成成分之一,发挥着极其重要的免疫作用[1]。透彻研究宿主防御肽的表达特性及调控规律为通过提高动物机体免疫力以替代饲用抗生素的使用提供重要思路。本文将综述宿主防御肽的概念、生物学功能及其表达特性和表达调控机制。
1 宿主防御肽的概念及分类
宿主防御肽是动物机体内组织细胞表达和分泌的一类具有多种功能的小分子多肽物质。宿主防御肽通常具有广谱的抗菌活性,又称抗菌肽(antimicrobial peptides,AMPs),是机体防御外来病原菌入侵的重要防线[2-3]。
宿主防御肽来源广泛[4],最早在昆虫体内发现,随后陆续在水生动物、禽类以及哺乳动物体内发现[5]。当前,抗菌肽数据库(http//apes.unmet.due/AP/main.hp)已经收录了3 000余种宿主防御肽,其中有2 356种动物源宿主防御肽,如从蝇蛆中分离得到的抗菌肽MAP17[6]、从哺乳动物体内分离得到的抗菌肽人源β-防御素3(human β-defensin-3,HBD3)[7]以及从水生动物体内分离得到的抗菌肽Hymenochirin-5Pe[8]等。氨基酸的种类和多肽的排列方式影响宿主防御肽的结构,根据其二级结构分为α-螺旋、β-折叠和无规则延伸3类[9]。α-螺旋类宿主防御肽常见于有抗菌活性的宿主防御肽,如天蚕素家族和LL-37等。β-折叠类宿主防御肽根据半胱氨酸残基的空间结构还可以分为植物防御素、无脊椎动物防御素、α-防御素、β-防御素和θ-防御素5个亚类[9]。无规则延伸常见于富含甘氨酸或脯氨酸的宿主防御肽,如牛肠源性β-防御素(enteric beta defensin,EBD)[10]等。依据抗菌肽的三级结构还可以将其分为线性-螺旋肽、环肽以及通过二硫键维系的α-螺旋结构和β-折叠结构、发卡结构、线性肽和无序的短肽[9]。结构的不同导致宿主防御肽的功能也有所不同,根据宿主防御肽对不同种类微生物具有的拮抗作用可将其分为抗病毒肽、抗细菌肽、抗肿瘤肽、抗寄生虫肽和抗真菌肽等[11]。根据宿主防御肽所带电量可以分为阳离子抗菌肽、阴离子抗菌肽以及中性抗菌肽[11]。
2 宿主防御肽的生物学功能
宿主防御肽具有多种生物学功能,包括抗菌、抗病毒、抗肿瘤、抗寄生虫和免疫调节等,因此又称“多功能肽”[12],其功能如图1所示。
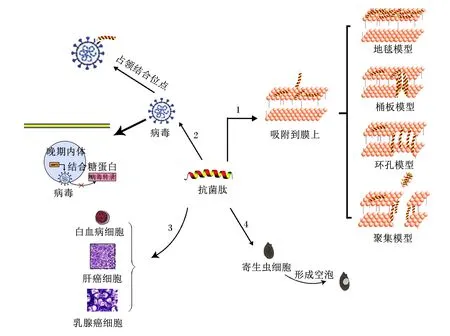
1:抗菌模式 antibacterial pattern;2:抗病毒模式 anti-virus pattern;3:抗肿瘤模式 anti-tumor pattern;4:抗寄生虫模式 anti-parasitic pattern。
2.1 抗菌
宿主防御肽通常具有广谱的抗菌活性。Nilsson[13]研究发现,LL-37、猪β-防御素2(porcine β-defensin-2,PBD2)和蜂毒素均对革兰氏阴性菌和革兰氏阳性菌有很好的抑制作用。Casciar等[14]发现,蛙体内分离得到的抗菌肽Esculentin-1a(1-21)NH2具有广谱抗菌活性,特别是对铜绿假单胞菌和白色念珠菌等。其抗菌机制可分为直接杀灭和间接杀灭。生理状态下,带正电荷的宿主防御肽以物理的方式吸附于细菌细胞膜,导致胞质外露,破坏细胞膜[15]。其机制分为4种模型,包括:1)地毯模型;2)桶板模型;3)聚集模型;4)环孔模型[3]。例如mBjAMP1,一种分离于日本分枝杆菌的抗菌肽,能够穿透细菌细胞膜,且不会引起膜破裂,对病原菌显示出有效的生长抑制和杀菌活性[16]。檀磊[17]研究表明,蛙吞噬细胞中分离的蛙皮素可以应用于革兰氏阳性细菌的治疗中。另外,抗菌肽亦可通过与细胞内阴离子结合,作用于细菌基因组,引起细胞结构破坏,达到抑菌效果。Scocchi等[18]发现,猪源抗菌肽PR-39可以通过阻止蛋白质的生物合成,诱导在DNA复制过程中的关键蛋白质降解,从而抑制细菌的繁殖生长。有些宿主防御肽虽不能直接杀灭细菌,但可以通过免疫调控发挥作用,破坏细菌细胞的生命进程[7],如鲨体内分离纯化的抗菌肽GFP-2[19]、存在于人体呼吸道内的LL-37[20],它们作为受体参与机体的免疫反应过程,竞争性抑制细菌与宿主细胞结合,起到抑菌作用。
2.2 抗病毒
宿主防御肽具有抗病毒活性,能有效抑制病毒的传播,提高机体抵抗病原感染的能力,例如宿主防御肽Protegrins可以增强人类抵抗先天性免疫缺陷(human immunodeficiency virus,HIV)[21]、家禽抵抗甲型流感[22]等疾病的能力。宿主防御肽抗病毒的作用机制可分为竞争性以及非竞争性两大类。病毒粒子侵入宿主细胞内,宿主防御肽抢先占领受体上的结合位点,导致病毒粒子无法与受体结合,进而抑制病毒粒子的活性。Casanova等[23]研究发现,富含甘氨酸的宿主防御肽LL-37主要对人轮状病毒起到直接的抗病毒作用。付杰等[24]研究发现,从红头丽蝇蛆血淋巴中分离纯化的抗病毒肽Alloferon1通过诱导机体产生干扰素(interferon,IFN),并激活自然杀伤细胞(natural killer cell,NK),阻断病毒吸附于宿主细胞,遏制病毒的代谢过程,阻断病毒的传播。鸡血抗菌肽能有效中和鸡痘病毒,在一定程度上抑制其增殖[25]。牛髓系抗菌肽BMAP27对淋巴结感染急性牛疱疹病毒具有潜在的抑制作用[26]。另外,宿主防御肽可以干扰病毒粒子的组装,使其在宿主细胞内无法形成完整结构,阻碍病毒粒子增殖,抑制病毒活性[27]。因此,通过营养干预提高宿主防御肽的表达以抵抗病毒感染宿主细胞是动物机体预防病毒感染性疾病的有效手段。
2.3 抗寄生虫
寄生虫病使得动物食欲减退、体力透支,长期危害动物机体健康,严重的可能致死,如猪疥螨病[28]、弓形体病[29]等。有些宿主防御肽可以直接作用于寄生虫的细胞膜,使虫体内部产生大空泡,内部形态遭到破坏而死亡,这一点体现在昆虫源宿主防御肽对疟原虫的抑制作用,如由叶水蛙体内分离得到的抗菌肽Dermatitis家族[30]以及Dermatitis衍生物S3、S4[31]等;另外,宿主防御肽还可以改变寄生虫细胞内线粒体的膜电位,影响寄生虫体内核酸和蛋白质的形成,导致寄生虫细胞凋亡,抑制寄生虫的活力[32]。
2.4 抗肿瘤
宿主防御肽具有显著的抗肿瘤活性,如人白血病细胞、肝癌细胞和乳腺癌细胞等。宿主防御肽可通过促使肿瘤细胞膜上形成多个孔洞,导致细胞内容物溢出,以直接抑制肿瘤细胞增殖,发挥抗肿瘤作用,如抗菌肽SK84[33]。除此之外,宿主防御肽亦可通过抑制肿瘤细胞内染色体DNA的合成,使其无法正常代谢,诱导肿瘤细胞凋亡[34]。抗菌肽HBD3还可通过旁分泌的方式抑制结肠癌细胞的转移和侵袭能力[5],同时抑制血管内皮因子诱导的癌细胞的迁移能力[35]。
2.5 免疫调节作用
宿主防御肽的免疫调节作用是近年来研究的热点,通过宿主防御肽的免疫调控,机体内固有免疫及获得性免疫均显著增强[36]。宿主防御肽除了通过杀灭病原体防止病原微生物进入宿主细胞内,还能通过分泌多种细胞因子抑制动物机体炎症发生[37],如唾液腺分泌富组蛋白和白细胞介素8、胰腺分泌β-防御素和牛乳腺上皮细胞分泌乳清蛋白等。Shan等[38]报道指出,乳铁蛋白也可以促进断奶仔猪的外周血和脾淋巴增殖,有效提高仔猪血清中免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M,IgM)和白细胞介素-2(interleukin-2,IL-2)的水平,提高机体免疫能力。此外,宿主防御肽还可以抑制内毒素(lipopolysaccharide,LPS)引起的炎症反应。宿主防御肽可通过与LPS结合发挥抗炎作用。Dou等[39]研究发现,抗菌肽具有结合LPS的能力,如蜂毒素通过与LPS结合,从而降低肿瘤坏死因子-α的表达和分泌,减少一氧化氮等促炎因子的产生,继而降低LPS诱导的促炎反应。另外,宿主防御肽还可通过免疫调节作用调节细胞内促炎信号的激活来发挥抗炎作用,如抗菌肽LTP-20通过作用于核转录因子-κB(nuclear transcription factor-κB,NF-κB)受体激活蛋白通路和促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路降低LPS刺激产生的促炎因子水平[40]。LL-37对体内多种细胞具有免疫调节作用,如单核细胞、上皮细胞和树突状细胞等,与粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimu-lating factor,GM-CSF)及白细胞介素-1(interleukin-1,IL-1)有协同作用,前者通过激活单核细胞并产生白细胞介素-8(interleukin-8,IL-8),后者通过激活光束纤维(aktinofibrils,AKT)、cAMP应答元件结合蛋白质(cAMP response element binding protein,CREB)和NF-κB等途径增强细胞因子和趋化因子活性,抑制由LPS引起的炎症反应[40]。宿主防御肽通过多种免疫调节机制维持和增强机体的免疫能力,其作用模式如图2所示。

1:抑制内毒素活性 inhibition of endotoxin activity;2:直接杀灭微生物 kill microorganisms directly;3:中和巨噬细胞和单核细胞的释放 neutralizing pro-inflammatory factors released by macrophages and monocytes;4:促进血管生成 promote angiogenesis;5:促进伤口愈合 promotes wound healing;6:激活并趋化免疫细胞 activate and chemotactic immune cells。
3 宿主防御肽的表达及调控特性
大量科学研究证实,动物机体分泌宿主防御肽的种类和水平依赖于动物的种属差异、组织差异以及生理状态、饲粮调节等,具有不同的表达特性。
3.1 营养调控特性
一些功能性营养物质对宿主防御肽的表达具有调控作用,如短链脂肪酸、氨基酸以及中草药、益生菌等,如表1所示。短链脂肪酸对宿主防御肽具有很好的表达调节活性,通过膳食纤维发酵产生乙酸、丙酸和丁酸等短链脂肪酸,可以调节机体内宿主防御肽的表达[42];丁酸钠及苯基丁酸钠[2,43],均可诱导猪肠上皮细胞及猪肾细胞中猪β-防御素3(porcine β-defensin-3,PBD3)、猪β-防御素128(porcine β-defensin-128,PBD128)等宿主防御肽的表达[44]。饲粮中添加异亮氨酸可有效促进猪空肠和回肠中猪β-防御素1(porcine β-defensin-1,PBD1)、PBD2等防御素的表达[41];添加精氨酸亦可促进猪肠上皮细胞中β-防御素的表达[45]。断奶仔猪饲粮中添加谷氨酰胺能显著促进骨髓及空肠黏膜抗菌肽PR-39 mRNA表达的上调[46]。中草药的种类繁多,从植物中分离出的物质,如穿心莲内酯、冬凌草甲素和异黄体生成素,诱导人结肠上皮细胞中HBD3的产生[47]。Gräber等[48]研究表明,仙鹤草预处理的细胞中人源β-防御素1(human β-defensin-1,HBD1)的表达量显著升高。何星等[49]发现,在饲粮中添加不同剂量的四君子散,对家兔圆小囊组织中兔防御素RSRAH的表达有明显的促进作用。曾庆辉等[50]发现,在饲粮中添加德氏乳酸菌后,黄河鲤皮肤中的肝表达抗菌肽-1(1iver-expressed antimicrobialpeptide-1,Leap-1)和肝表达抗菌肽-2(1iver-expressed antimicrobialpeptide-2,Leap-2)的相对表达量显著升高。

表1 功能性物质影响宿主防御肽表达
3.2 种属依赖性
目前,宿主防御肽在哺乳动物、鸟类、鱼类、两栖类、爬行动物以及昆虫中表达的种类以及水平各不相同,展现出明显的种属依赖性。
人源宿主防御肽主要分为α-防御素家族、β-防御素家族以及cathelicidin家族。如LL-37是表达于人体内的典型cathelicidin家族宿主防御肽[11]。PR-39、Protegrin-1(PG-1)是仅在猪体内高表达的猪源宿主防御肽PBD2、PBD3等在猪的各个组织中均有表达[51]。乳铁蛋白是典型的牛源宿主防御肽,由于其良好的抗肿瘤、增强机体免疫力活性,被应用于饲粮及食品当中[52],牛源宿主防御肽还包括Calisthenic[53]、BMAP-28[54]以及Bac1[55]等。绵羊β-防御素-1(sheep β-defensin-1,SBD-1)主要分布于绵羊的消化道、呼吸道、生殖道和脾脏当中[56]。另外,来自于兔圆虫圆形细胞中的兔宿主防御肽在体内各个部位均有表达[57]。Bommineni等[58]发现了鸡源抗菌肽,如Fowlicidin-1。鱼类宿主防御肽数目繁多,有鞘磷脂家族以及cathelicidins家族,如codCath1[59]、cathelicidin 5[60]等。Conlon等[61]发现,蛙皮肤分泌物中存在Lithobates forreri、Hylarana luctuosa/signata、Tigerinin-1R等抗菌肽。Sutomo[62]在科莫多巨蜥基因组中鉴定出66个β-防御素基因、6个卵防御素基因和3个cathelicidin基因。Freire等[63]从昆虫黄蜂毒液中分离得到的抗菌肽Synoeca-MP。
3.3 组织依赖性
宿主防御肽的表达具有组织依赖性,在同种动物不同组织器官中的表达种类及水平有所差异。LL-37在中性粒细胞和上皮细胞中呈构成性表达,在皮肤中呈诱导性表达[64]。PBD2在骨髓、淋巴组织、舌、肾脏和大肠中均有表达,但在肾脏和肝脏中的表达量最高[65];而PBD3、PBD4分别在口腔黏膜和肺泡组织中表达量较高,PBD123、PBD125和PBD129主要在猪雄性生殖组织中表达[61];猪源抗菌肽PR-39在骨髓和淋巴组织中表达,且具有抑菌活性[66]。有些牛源宿主防御肽,如牛气管抗菌肽(tracheal antimicrobial peptide,TAP),在牛的气管和肺泡巨噬细胞中表达量最高[67];牛源β-防御素5在牛的中性粒细胞中表达量较高[10];β-防御素在牛的乳头黏膜、肾脏、阴道、卵巢、结肠中表达量较高[52]。
3.4 生理状态依赖性
宿主防御肽的表达量随生理状态下变化而发生变化,诸多特殊的生理状态或时期可诱导或抑制机体宿主防御肽的表达。
3.4.1 泌乳期
奶牛的乳腺是一种高度发达的腺体组织,Varshney等[53]发现,奶牛乳腺内抗菌肽Calisthenic基因在泌乳早期不表达,但在中期检测时发现其表达量上调,泌乳后期又检测到表达量下调。奶牛在第1次和第2次泌乳期间,抗菌肽BMAP-28的表达量较第3次泌乳期高,在第4次泌乳期间抗菌肽BMAP-27的表达量再次上调[52]。
3.4.2 病理状态
研究表明,心肌衰竭者血清中脑钠肽的表达量显著低于正常水平[68]。Al-Adwani等[69]发现,LL-37的表达与银屑病密切相关,银屑病患者体内的LL-37的表达量较健康人群偏高。在龋齿患者的牙龈细胞中α-防御素-1/3、β-防御素-2/3和LL-37含量较高[70]。在肺结核和糖尿病患者体内,HBD2基因的表达受到抑制,表达量下降[71]。当机体感染炎症时,也会影响宿主防御肽的表达。例如,奶牛乳房炎的严重程度与宿主防御肽的表达量相关,炎症较轻时,奶牛体内抗菌肽Bac1基因的表达量上调,炎症严重时,抗菌肽Bac1和Bac5基因的表达量均上调[52]。奶牛乳房炎越严重,Calisthenic基因的表达量就越高[52]。另外,肠炎患者体内LL-37的表达量显著增加[72]。
3.4.3 发育阶段
研究发现,PBD2和PBD3都在猪的卵泡细胞中表达,PBD3的mRNA表达量与卵泡发育无关,但PBD2的mRNA表达量与卵泡发育有关,在小卵泡细胞内的表达量最高,在大卵泡细胞内的表达量最低[73]。另外,Zupin等[74]发现,HBD1在卵母细胞受精率高的女性体内的表达量高于卵母细胞受精率低的女性。Caverly等[75]发现,新生牛犊支气管肺泡洗液中阴离子抗菌肽的浓度是成年牛的3倍,但是其杀死溶血曼海姆菌(Mannheimiahaemolytica)的能力却明显比成年牛弱。有报道指出,迟发性脓毒症早产儿体内β-防御素的表达量比足月儿低,但是其杀菌活性却比足月儿高[76]。姚杨等[77]研究发现,家蝇体内抗菌肽MAF-1的表达量随着家蝇的发育阶段而产生变化,MAF-1在各个发育阶段的相对表达量为:2龄幼虫>1龄幼虫>3龄幼虫>雄蝇成虫>卵>雌蝇成虫>蛹。
4 宿主防御肽的表达调控机制
宿主防御肽的表达受多种信号通路的精细调控,如Toll样受体(Toll-like receptor,TLR)信号通路、MAPK信号通路、与TLR或MAPK相互作用的NF-κB信号通路、组蛋白去乙酰化修饰途径等[78]。
LPS感染宿主细胞后,TLR和血管活性肽(intermedin,IMD)受体信号通路被激活,肽聚糖识别受体蛋白(peptidoglycan-recognition protein,PGRP)将信号传递到细胞内,与宿主细胞TLR以及核苷酸结合,刺激核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)和NOD样受体(NOD-like receptors,NLRs)实现病原体相关分子模式(pathogen-associated molecular pattern,PAMPs),进而刺激机体分泌宿主防御肽,增强机体的免疫作用[79]。组蛋白去乙酰化修饰途径是宿主防御肽营养调控过程中发挥促进机体免疫作用的重要靶点,是免疫调控组蛋白修饰的重要途径[80]。组蛋白去乙酰化酶(histone deacetylase,HDAC)去除赖氨酸残基上的乙酰基,组蛋白乙酰转移酶(histone acetyltransferase,HAT)将乙酰基转移至组蛋白N端赖氨酸残基上,通过组蛋白乙酰化使得染色体结构打开,促进动物肠道宿主防御肽表达[81]。Dou等[82]发现,TLR2/4可通过p65磷酸化和NF-κB抑制蛋白激酶(inhibitor of NF-κB kinase,IKK)的延迟合成激活NF-κB途径,促进宿主防御肽的表达。Johansen等[83]研究表明,MAPK信号通路可以通过刺激HBD2启动子与NF-κB和激活蛋白-1(activator protein-1,AP-1)DNA序列结合,调控HBD2的表达。其他途径,如G蛋白偶联受体109A(G protein-coupled receptor 109A,Gpr109a)信号通路能够诱导调节结肠上皮中产生白细胞介素-18(interleukin-18,IL-18)和白细胞介素-10(interleukin-10,IL-10)的T细胞分化,促进结肠内宿主防御肽的表达,增强机体的免疫作用,抑制肠道炎症[42]。宿主防御肽的表达受多种信号分子的共同调控作用。正是由于不同刺激源对于宿主防御肽调控的机制有差异,因而,在同样调控宿主防御肽表达的情况下,对动物机体产生了不同的影响。例如,Dou等[43]研究表明丁酸钠可通过TLR或表皮生长因子受体等介导猪肠道上皮细胞宿主防御肽的表达,但同时对白细胞介素-6(interleukin-6,IL-6)等促炎因子无增加效应,提示丁酸钠诱导该细胞宿主防御肽表达的同时不引起炎症反应,该结果可为通过增强动物机体免疫力预防病原微生物感染提供重要思路;但是,研究还表明宿主防御肽作为机体重要的免疫防御系统,可在机体遭受外源病原微生物刺激时迅速合成并分泌,以此作为动物机体应对外源刺激启动自身保护和防御机制的反应,但同时该过程也引起了一系列的促炎因子产生,引起炎症反应,而且病原微生物的持续或严重感染可使动物体内的宿主防御肽水平降低,使病原微生物逃避机体的先天免疫反应,更加严重地感染动物机体,产生疾病[84-85]。综上所述,宿主防御肽的表达受多种信号分子的共同调控作用,部分机制如图3所示。
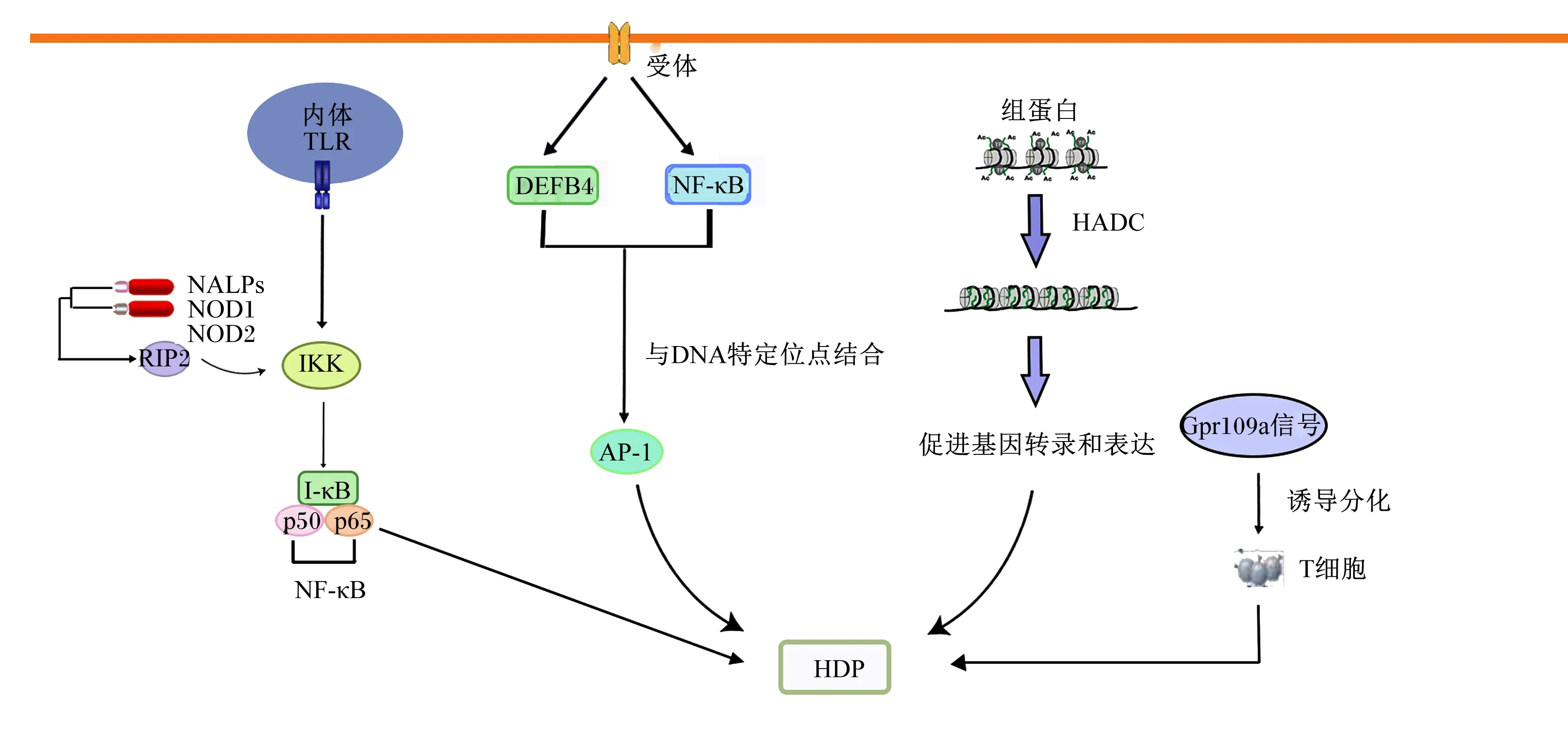
TLR:Toll样受体 Toll-like receptor;NALPs:嗜中性白细胞碱性磷酸酶neutrophilic alkaline phosphatases;NF-κB:核转录因子-κB nuclear transcription factor-κB;IκB:NF-κB抑制蛋白 inhibitor of NF-κB;IKK:IκB激酶 IκB kinase;AP-1:激活蛋白-1 activator protein-1;RIP2:受体相互作用蛋白2 receptor-interacting protein 2;HDAC:组蛋白去乙酰化酶 histone deacetylase;Gpr109a:G蛋白偶联受体109A G protein-coupled receptor 109A;NOD:核酸结合寡聚化结构域 nucleotide-binding oligomerization domain;DEFB4:DEFB4人源全长重组蛋白(P01)DEFB4(human)recombinant protein(P01)。
5 小结与展望
宿主防御肽不仅具有很多优良的特性,且在动物产品的生产、畜牧业以及医疗各方面均发挥重要的作用。本文综述了宿主防御肽的抗菌、抗病毒、抗肿瘤、抗寄生虫和免疫调节功能及其作用机制,特别归纳了宿主防御肽在表达上的调控特性、种属依赖性、组织特异性和生理状态依赖性。目前,宿主防御肽的相关研究还有很多需要解决的问题,如宿主防御肽在动物其他生理时期的表达特性、受外源物质调控特性及机制等。透彻探明宿主防御肽的表达特性以及作用机制可为增强动物机体内宿主防御肽表达以提高机体免疫力提供新思路,为宿主防御肽更明朗地应用于动物饲料的研制和畜牧产业的发展中提供重要理论基础。

