关于胶体化学的教学思考
叶明富,马 亮,严菊芬,张 奎,吴芳辉,王诗生
(1.安徽工业大学化学与化工学院,安徽马鞍山243002;2.安徽工业大学能源与环境学院,安徽马鞍山243002;3.南开大学先进能源材料化学教育部重点实验室,天津300071)
胶体[1-4]一词最早是在1861年由英国科学家格雷厄姆(Thomas Graham,1805-1869)提出来的。他比较在水中不同物质的扩散速度时,发现一些物质如糖、无机盐、尿素等易扩散,另一些物质如Al(OH)3、Fe(OH)3、明胶等扩散很慢,而当蒸去水分后,前一类物质析出晶体,后一类物质则得到胶状物,因此他把后一类物质称为胶体。多年后俄国科学家维伊曼经过200 多次的实验证实这样的分类并不合适,因为许多晶体物质在适当的介质中也能得到具有胶体特征的体系,所以,应当把胶体看成在一定分散范围内物质存在的一种状态,而不是某一类物质固有的特性。直到1903 年,德国科学家齐格蒙第(Richard Zsigmondy,1865-1929)和西登托夫(Henry Siedentopf,1872-1940)发明了超显微镜,肯定了胶体系统的多相性,从而明确了胶体化学是界面化学的这一根本问题。1907 年,德国化学家奥斯特瓦尔德(Friedrich Wilhelm Ostwald,1853-1932)创办了第一个胶体化学杂志《胶体化学和工业杂志》,因而世人将1907 年视为胶体化学正式成为一门独立学科的起点。近百年来,随着科学技术的发展,胶体化学这一门学科也逐渐趋于成熟,对于胶体化学的研究实现了从宏观到微观的跃进。
在胶体中含有两种不同状态的物质,一种连续,另一种分散。分散的那一部分是由微小的粒子或液滴所组成(粒径1~100 nm),即胶体粒子,称之为分散相;连续的一部分起分散作用,称为分散介质。胶体体系的重要特征之一是以分散相粒子的大小为依据,显然,只要不同分散相的颗粒大小1~100 nm,则在不同状态的分散介质中均可形成胶体体系。若按分散介质和分散相的聚集状态进行分类,构成的胶体体系如表1。

表1 不同聚集状态分散相分散于不同介质形成的不同胶体体系
传统习惯将分散介质为液体的胶体系统称为液溶胶(简称为溶胶),如介质为水则称为水溶胶;介质为固体时,称为固溶胶。由此可见,存在多种多样的胶体系统。
当按稳定性对胶体溶液进行分类,则可分为亲液溶胶和憎液溶胶。亲液溶胶是指半径1~100 nm 的大分子溶解在合适的溶剂中,将溶剂蒸发后大分子化合物凝集,但再加入溶剂其又可形成溶胶,亲液溶胶是热力学上稳定、可逆的系统。憎液溶胶是指半径落在胶体粒子范围内的固态难溶物粒子分散在液体介质中,有很大的相界面,是热力学上的不稳定系统,易聚沉。一旦将介质蒸发掉再加入介质时,其无法再形成溶胶,是一个不可逆系统。
1 胶体的结构和性质[4-8]
1.1 胶体的结构
任何溶胶粒子的表面上总是带有电荷,目前人们普遍认同的胶团结构为双电层结构。由于胶粒的结构比较复杂,下面以稀AgNO3与过量的稀KI 溶液反应制备AgI胶体为例,来说明胶团的结构。即:
AgNO3+KI→KNO3+AgI ↓
反应生成的难溶物AgI聚集形成胶粒的中心,称为胶核。剩余的KI 起稳定性的作用,然后胶核选择性地吸附稳定剂中的I-,形成紧密的吸附层。由于正负电荷相吸,K+作为反离子,会在紧密层外形成反离子的包围圈,胶核表面的I-和靠近的K+构成吸附层,胶核与吸附层统称为胶粒。另一方面,扩散在胶粒周围的K+构成了扩散层,扩散层中的反离子与胶粒形成了一个电中性的胶团。碘化银胶团的结构示意图如图1所示。
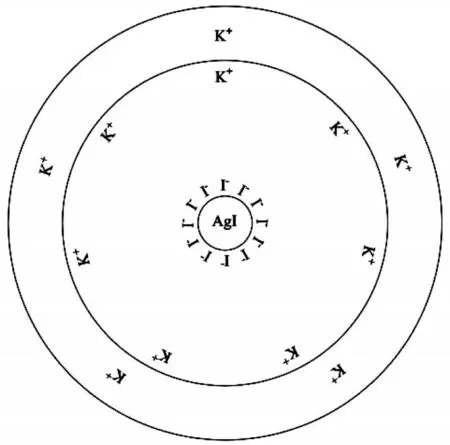
图1 碘化银胶团结构示意图
胶团的结构表达式为:
[(AgI)mnI-,(n-x)K+]X-xK+
式中:m—胶核中AgI 的分子数;n—胶核所吸附的I-离子数;(n-x)—吸附层中的带相反电荷的离子数;x—扩散层中的反号离子数。
应当指出,胶核选择性地吸附离子,同离子效应使胶核不易溶解,因此首先吸附与胶核中相同的某种离子;若无相同离子,则首先吸附水化能力较弱的负离子,自然界中的胶粒大多带负电就是这个原因导致的。不同溶胶的胶团可有各种不同的形状,例如聚苯乙烯溶胶的胶团接近球形,而Fe(OH)3溶胶为针状,V2O3溶胶为带状。胶粒的形状对胶体性质有重要的影响。
1.2 胶体的性质
胶体的性质与结构有关,在讨论胶体的性质时,必须综合考虑胶粒的分散程度、多相性以及稳定性三个基本方面特性才会得到正确的概念,只有典型的憎液溶胶才能全面表现胶体的所有特性。总的来说,其基本特性可以归纳为特有的分散程度、聚集不稳定性和不均匀性。目前人们归纳的胶体基本性质主要分为溶胶的运动性质、溶胶的光学性质、溶胶的电学性质、胶体系统的流变性质、胶体稳定性等几个方面。
1809 年,俄国化学家Scheele 发现了土粒的电泳现象(电泳是指带电胶粒或大分子在外加电场的作用下向带相反电荷的电极定向移动的现象)。由于溶胶是电中性的,而胶粒带电,则介质必然带与胶粒相反的电荷。胶粒在重力场作用下发生沉降,从而产生沉降电势;带电的介质发生流动,会产生流动电势,这是因动而产生电;因外加电场作用,胶粒和介质分别向带相反电荷的电极移动,就产生了电泳和电渗的电动现象,这是因电运动。上述都是溶胶的电学性质。1829 年,英国植物学家布朗(Robert Brown,1773-1858)观察到花粉的布朗运动,即在花粉颗粒的水溶液中观察到花粉不停顿地无规则运动。布朗运动是胶体的运动性质,是分子热运动的必然结果,是大粒子所具有的热运动。热运动的本质是分子的不规则运动,它使粒子从高浓度区向低浓度区移动,而最终趋于平衡。即由于布朗运动的存在,当溶胶中的胶粒存在浓度差时,就会发生扩散。1869 年丁达尔(John Tyndall, 1820~1893)发现当一束光通过溶胶时,在与光束垂直的方向可以看到溶胶中有明亮的光线轨道,这就是丁达尔效应(Tyndall Effect),是胶体的光学性质的重要体现,实际上丁达尔效应已经成为判别溶胶与分子溶液的最简便的方法。
2 胶体化学的应用[8-11]
直到二十世纪初胶体化学才真正成为一门独立学科。胶体化学不仅要了解胶体体系本身的许多基本性质,而且要研究与这些基本性质相联系的许多实际问题。只要涉及分散体系的形成、破坏以及它们的物理化学性质等问题都是胶体化学所要研究的。因此,胶体化学的研究内容包括分散体系和界面现象。
界面现象是发生在物理界面上的各种物理化学行为、过程及其性质,研究界面现象的科学就称为界面化学,界面化学以多相体系为研究对象。随着分散体系分散度的增加,物体的比表面积也相应增大,胶体的各种性质与比表面积密切相关,所以对表面现象的研究也是胶体化学的主要内容之一。
胶体化学的知识和研究成果在工农业生产和日常生活中应用广泛,尤其在当代科学技术的各个前沿领域,如环境科学与工程中的絮凝、吸附,空气中气溶胶与气候变迁的关系,各种亲液溶胶的性质、表面催化和吸收对环境的影响等深层次问题,正是目前人们研究的热点;在仿生科学中的生物膜模拟方面,各种膜的微观结构以及细胞、蛋白质和在生理过程中实现物质吸收、维持新陈代谢等作用的各种膜的精巧功能的深入研究,都是在不断进步的胶体技术带动下进行的;在材料科学中的纳米材料领域,均匀胶体的研究已成为研制新材料的主要方向之一,由均匀纳米陶粒制作的材料,其耐磨、耐温、绝缘性能是普通材料无法比拟的;形状、大小均一的纳米材料磁性粒子具有优异的记录和记忆功能,是制作高密度、高保真器材的理想材料;医疗与医药领域的微胶囊技术,成为医药在人体中储存和传输的胶体方式;此外在能源科学中的三次采油和水煤浆技术以及膜科学中的LB膜、BLM和自组装膜等领域中,胶体化学都起着重要作用。
3 结束语
中国著名胶体化学家博鹰院士说过“一种科学的历史是那门科学的最宝贵的一部分,科学只能给我们知识,而历史却能给我们智慧”。胶体化学作为一门应用性极强的学科,教学过程中首先通过介绍胶体化学的发展简史以及胶体概念,激发学生的学习兴趣,接着引出对胶体结构的探讨,并且以具体的例子详细解析了其结构特性,从而又发现胶体性质与结构有关,并对其进行详细论述。在介绍基本概念时,通过理论结合实际,极大地调动了学生的学习积极性。最后又结合胶体化学的实际应用,使学生对胶体化学的理解更加深刻,有效提高了课堂教学质量。

