治疗前后血清缺血修饰白蛋白、可溶性血管黏附蛋白1水平变化率对短暂性脑缺血发作患者继发急性脑梗死的预测价值研究
薛莉,王鑫,李转会
研究显示,短暂性脑缺血发作(transient ischemic attack,TIA)患者发病后5年内脑梗死发生率可达20%左右,严重威胁患者生命安全[1]。目前临床虽然可根据影像学检查如磁共振血管成像及临床表现评分系统等对TIA患者继发急性脑梗死(acute cerebral infarction,ACI)进行评估,但是该方法仅能反映当前的病情,却难以预测患者预后,而TIA患者治疗前后生化指标的变化对其继发ACI具有一定预测价值[2-3]。缺血修饰白蛋白(ischemia modified albumin,IMA)属于常见的脑血管缺血标志物,其灵敏度高,研究发现,相较于健康人群,TIA患者血清IMA水平偏高,且与脑梗死发生风险、梗死面积均有关[4-5],故推测血清IMA水平对TIA患者继发ACI的风险、预后有重要的预测价值。可溶性血管黏附蛋白1(soluble vascular adhesion protein-1,sVAP-1)可通过调控转录因子、趋化因子、其他黏附分子而调节机体炎症微环境,研究发现,sVAP-1在心肌梗死患者的缺血区血管中过度表达,对缺血性疾病病情及患者预后的判断具有重要意义[6]。但是血清IMA联合sVAP-1对TIA患者继发ACI的预测价值尚不清楚,需进一步研究。本研究旨在探究治疗前后血清IMA、sVAP-1水平变化率对TIA患者继发ACI的预测价值,以期为TIA患者继发ACI的防控提供指导。
1 对象与方法
1.1 研究对象 回顾性选取2018年1月—2019年5月西安·兵器工业五二一医院收治的TIA患者119例为观察组,选取同期于本院体检的健康者108例为对照组。本研究经西安·兵器工业五二一医院医学伦理委员会审核批准。
1.2 纳入与排除标准 观察组纳入标准:(1)确诊为TIA[7]:由颈部动脉疾病引发,具体情况为突然起病,持续时间通常5~20 min,症状(椎内动脉系统TIA:可有偏瘫、偏盲、偏身感觉障碍,主侧半球损伤常有失语,可出现偏瘫对侧一过性视觉障碍;椎基底动脉系统TIA:眩晕、平衡障碍、眼震、共济失调、复视、构音困难、吞咽困难、交叉性感觉运动障碍,可猝倒及出现短暂性全面遗忘症)在24 h内恢复,一般神经功能缺损症状也可恢复,但常反复发作,每次发作的局灶症状较刻板;(2)有完整的临床资料。排除标准:(1)合并严重器质性疾病者;(2)伴有血液系统疾病者;(3)伴有免疫缺陷者;(4)有脑出血病史者;(5)近期有手术或出血史者;(6)既往患有脑梗死者。
对照组纳入标准:(1)进行全面体检(包括颅脑计算机断层扫描检查)的健康者;(2)有完整的体检资料。
1.3 方法
1.3.1 观察组治疗方法 观察组患者给予对症治疗:包括神经保护剂、脱水剂、降压药等常规治疗,另给予阿司匹林肠溶片(拜耳医药保健有限公司生产,国药准字J20171021)100 mg/d、阿托伐他汀钙片(辉瑞制药有限公司生产,国药准字H20051408)20 mg/d至出院继续服用。
1.3.2 一般资料收集 收集两组受试者一般资料,包括性别、年龄、收缩压、舒张压、空腹血糖、总胆固醇、三酰甘油及观察组患者合并疾病、吸烟史(吸烟指数>100支年定义为有吸烟史)、饮酒史(近6个月内平均摄入乙醇量>40 g/d定义为有饮酒史)、既往有无高尿酸血症病史、纤维蛋白原水平、血红蛋白水平、血小板计数、TIA发作频率、TIA发作持续时间、TIA首次发作至入院时间、TIA治疗前发作总次数。
1.3.3 血清IMA、sVAP-1水平收集 收集观察组治疗前、治疗1周后及对照组体检当天血清IMA、sVAP-1水平,其检测方法为:采集受试者静脉血2 ml,常温下以3 500 r/min离心10 min(离心半径8 cm),取血清,采用酶联免疫吸附试验测定血清IMA、sVAP-1水平,严格按照试剂盒(美国Sigma公司生产)说明书步骤进行操作,具体为:将标准品、待测样本加入到预先包被人IMA、sVAP-1单克隆抗体的酶标板中,温育以使标准品及样本中的抗原IMA、sVAP-1分别与已包被的人IMA、sVAP-1单克隆抗体结合,之后洗涤出去未结合部分,分别加入酶标记的IMA、sVAP-1单克隆抗体工作液,温育,洗涤,再分别依次加入底物四甲基联苯胺,反应产物为蓝色,最后分别加入终止液变成黄色,颜色的深浅与样本浓度呈正相关,在酶标仪(型号:BIO-RAD 550)450 nm处读取吸光度,绘制标准曲线,根据标准品及待测样本的吸光度分别计算血清IMA、sVAP-1水平及其变化率,变化率(%)=治疗前水平与治疗1周后水平差值的绝对值/治疗前水平×100%。
1.3.4 观察组随访资料收集 所有患者出院后电话随访1年,每个月随访1次,随访内容主要包括患者生活状况、用药治疗情况、饮食情况、病情演变情况等及短暂性运动障碍、突然偏身感觉障碍、眩晕、平衡障碍、吞咽困难、跌倒等不良事件的发生情况。针对出现突发肢体功能缺损症状,如偏瘫、偏盲、偏身感觉障碍、言语不能等,且伴有头晕、呕吐等颅内高压症状的患者进行颅脑计算机断层扫描排除脑出血,颅脑磁共振成像检查明确脑内有梗死灶者记为继发ACI。
1.4 观察指标 (1)比较两组受试者治疗前、治疗1周后血清IMA、sVAP-1水平;(2)统计随访期间观察组患者继发ACI情况;(3)比较观察组继发ACI患者与未继发ACI患者一般资料和治疗前、治疗1周后血清IMA、sVAP-1水平及其变化率;(4)分析TIA患者继发ACI的影响因素;(5)分析血清IMA、sVAP-1水平变化率及其联合对TIA患者继发ACI的预测价值。
1.5 统计学方法 采用SPSS 20.0统计学软件进行数据分析。计量资料以(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验;TIA患者继发ACI的影响因素分析采用单因素及多因素Cox回归分析;绘制血清IMA、sVAP-1水平变化率及其联合预测TIA患者继发ACI的受试者工作特征曲线(receiver operating characteristic curve,ROC曲线),计算曲线下面积(area under curve,AUC),AUC的比较采用Z检验,确定最佳截断值,计算灵敏度、特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者一般资料比较 两组受试者性别、年龄比较,差异无统计学意义(P>0.05);观察组患者收缩压、舒张压、空腹血糖、总胆固醇、三酰甘油高于对照组,差异有统计学意义(P<0.05),见表1。
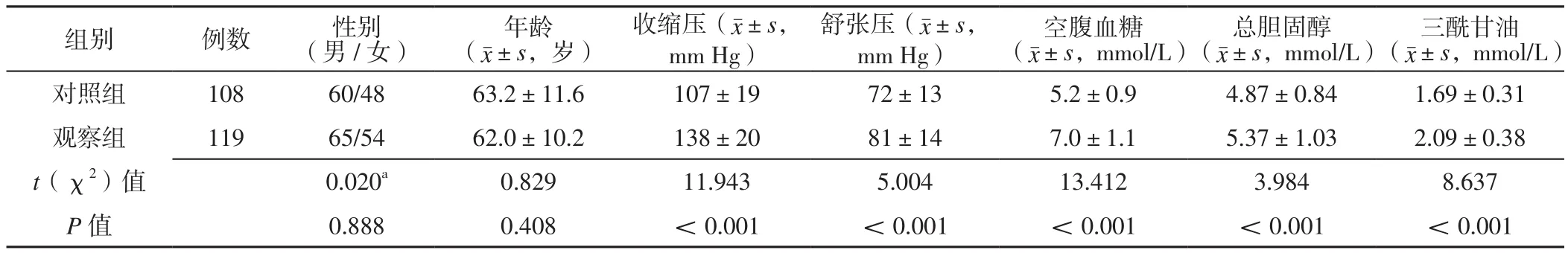
表1 两组受试者一般资料比较Table 1 Comparison of general data between the two groups
2.2 两组受试者治疗前后血清IMA、sVAP-1水平比较观察组患者治疗前血清IMA、sVAP-1水平均高于对照组,差异有统计学意义(P<0.05);观察组患者治疗1周后血清IMA、sVAP-1水平均低于治疗前,差异有统计学意义(P<0.05),见表2。
表2 两组受试者治疗前后血清IMA、sVAP-1水平比较(±s)Table 2 Comparison of serum IMA and sVAP-1 levels between the twogroups before and after treatment
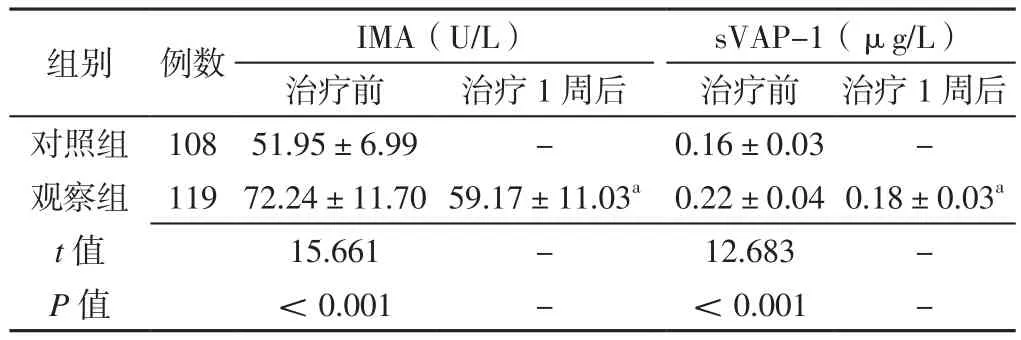
表2 两组受试者治疗前后血清IMA、sVAP-1水平比较(±s)Table 2 Comparison of serum IMA and sVAP-1 levels between the twogroups before and after treatment
注:与本组治疗前比较,aP<0.05;IMA=缺血修饰白蛋白,sVAP-1=可溶性血管黏附蛋白1;-为无相关数据
组别 例数 IMA(U/L) sVAP-1(μg/L)治疗前 治疗1周后 治疗前 治疗1周后对照组 108 51.95±6.99 - 0.16±0.03 -观察组 11972.24±11.7059.17±11.03a 0.22±0.040.18±0.03a t值 15.661 - 12.683 -P值 <0.001 - <0.001 -
2.3 随访期间观察组患者继发ACI情况 随访期间观察组中共有24例患者继发ACI,发生率为20.2%(24/119),其中10例患者6个月内发病,14例患者6个月~1年发病。
2.4 观察组继发ACI患者与未继发ACI患者一般资料和治疗前后血清IMA、sVAP-1水平及其变化率比较观察组继发ACI患者与未继发ACI患者男性占比、年龄、合并冠心病者所占比例、吸烟史、饮酒史、既往有高尿酸血症病史、血红蛋白水平、血小板计数比较,差异无统计学意义(P>0.05);观察组继发ACI患者合并高血压、糖尿病、高脂血症者所占比例和纤维蛋白原水平、TIA发作频率高于未继发ACI患者,TIA发作持续时间、TIA首次发作至入院时间长于未继发ACI患者,TIA治疗前发作总次数多于未继发ACI患者,差异有统计学意义(P<0.05),见表3。
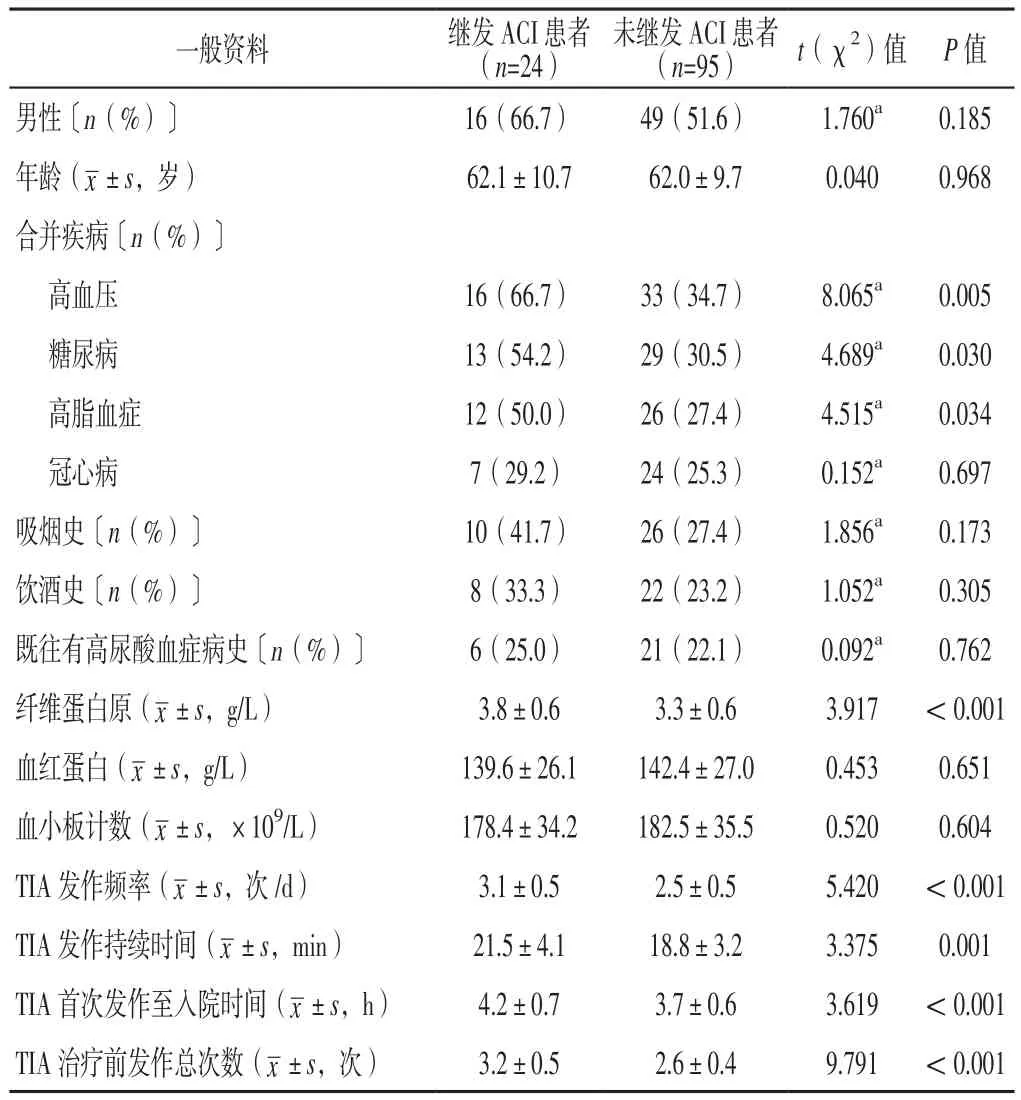
表3 观察组继发ACI患者与未继发ACI患者一般资料比较Table 3 Comparison of general information between patients with secondary ACI and patients without secondary ACI in the observation group
观察组未继发ACI患者治疗前、治疗1周后血清IMA、sVAP-1水平低于继发ACI患者,血清IMA、sVAP-1水平变化率高于继发ACI患者,差异有统计学意义(P<0.05);观察组继发ACI患者、未继发ACI患者治疗1周后血清IMA、sVAP-1水平均低于本组治疗前,差异有统计学意义(P<0.05),见表4。
表4 观察组继发ACI患者与未继发ACI患者治疗前后血清IMA、sVAP-1水平及其变化率比较(±s)Table 4 Comparison of serum IMA,sVAP-1 levels and their change rates between patients with secondary ACI and patients without secondary ACI in the observation group before and after treatment
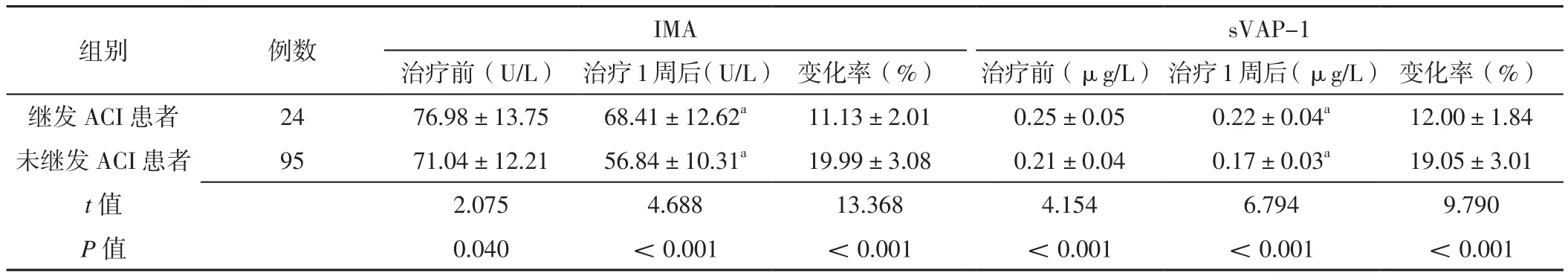
表4 观察组继发ACI患者与未继发ACI患者治疗前后血清IMA、sVAP-1水平及其变化率比较(±s)Table 4 Comparison of serum IMA,sVAP-1 levels and their change rates between patients with secondary ACI and patients without secondary ACI in the observation group before and after treatment
注:与本组治疗前比较,aP<0.05
sVAP-1治疗前(U/L) 治疗1周后(U/L) 变化率(%) 治疗前(μg/L) 治疗1周后(μg/L) 变化率(%)继发 ACI患者 24 76.98±13.75 68.41±12.62a 11.13±2.01 0.25±0.05 0.22±0.04a 12.00±1.84未继发 ACI患者 95 71.04±12.21 56.84±10.31a 19.99±3.08 0.21±0.04 0.17±0.03a 19.05±3.01 t值 2.075 4.688 13.368 4.154 6.794 9.790 P值 0.040 <0.001 <0.001 <0.001 <0.001 <0.001组别 例数 IMA
2.5 TIA患者继发ACI的影响因素分析
2.5.1 单因素Cox回归分析 以性别、年龄、合并高血压情况、合并糖尿病情况、合并高脂血症情况、合并冠心病情况、吸烟史、饮酒史、既往有高尿酸血症病史、纤维蛋白原水平、血红蛋白水平、血小板计数、TIA发作频率、TIA发作持续时间、TIA首次发作至入院时间、TIA治疗前发作总次数、血清IMA水平变化率、血清sVAP-1水平变化率为自变量,TIA患者继发ACI情况为因变量,变量赋值见表5,进行单因素Cox回归分析,结果显示,年龄≥65岁、合并高血压、合并糖尿病、合并高脂血症、纤维蛋白原水平、TIA发作频率、TIA发作持续时间、TIA首次发作至入院时间、TIA治疗前发作总次数、血清IMA水平变化率、血清sVAP-1水平变化率可能是TIA患者继发ACI的影响因素(P<0.05),见表6。

表5 TIA患者继发ACI影响因素的Cox回归分析变量赋值表Table 5 Variable assignment table of Cox regression analysis on influencing factors of secondary ACI in patients with TIA
2.5.2 多因素Cox回归分析 自变量同单因素Cox回归分析,以TIA患者继发ACI情况为因变量,赋值见表5,进行多因素Cox回归分析,结果显示,年龄≥65岁、合并高血压、合并糖尿病、合并高脂血症、纤维蛋白原水平、TIA发作频率、TIA发作持续时间、TIA首次发作至入院时间、TIA治疗前发作总次数、血清IMA水平变化率、血清sVAP-1水平变化率是TIA患者继发ACI的独立影响因素(P<0.05),见表6。
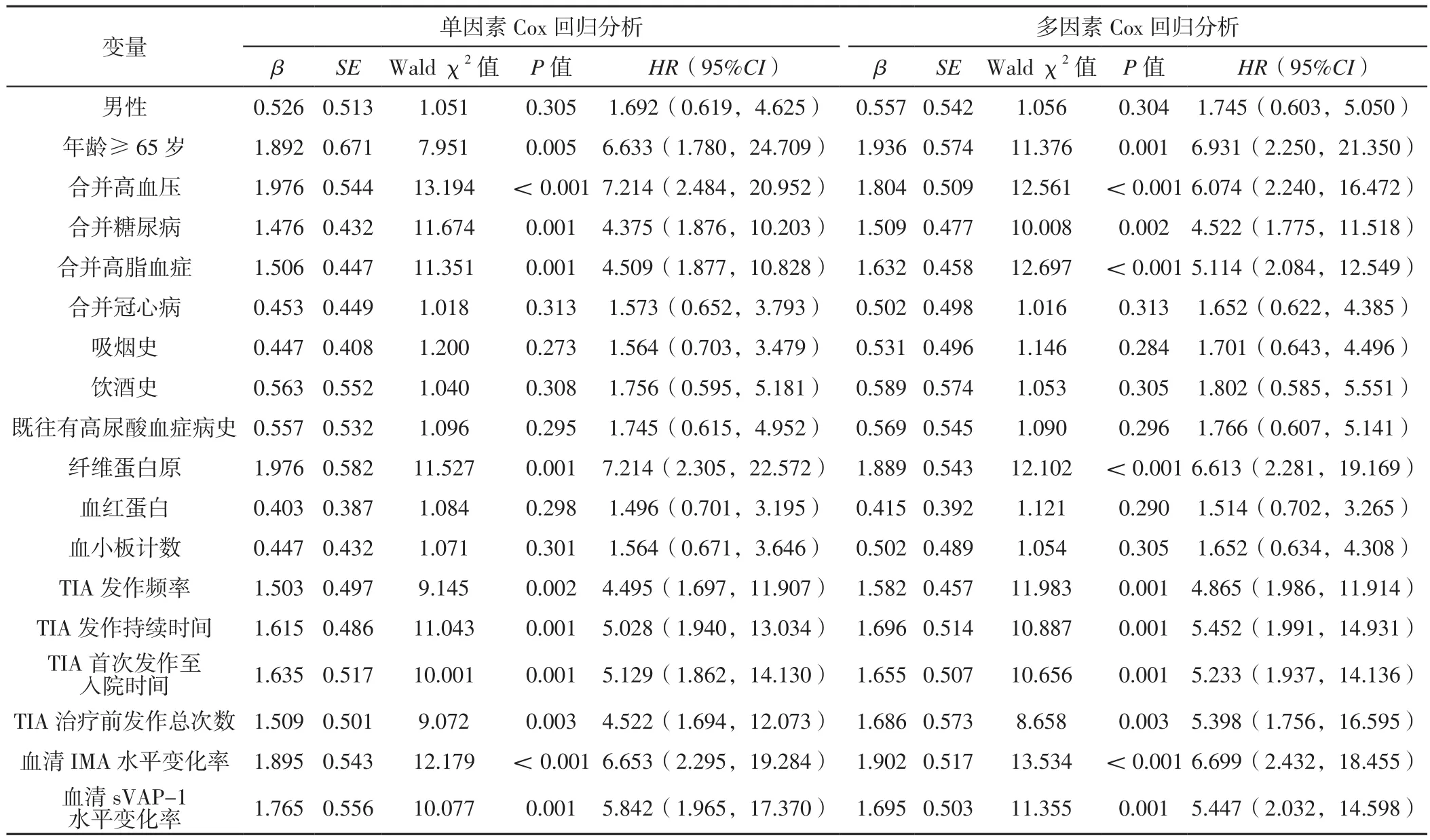
表6 TIA患者继发ACI影响因素的Cox回归分析Table 6 Cox regression analysis of influencing factors of secondary ACI in patients with TIA
2.6 血清IMA、sVAP-1水平变化率及其联合对TIA患者继发ACI的预测价值 ROC曲线分析结果显示,血清IMA、sVAP-1水平变化率预测TIA患者继发ACI的 AUC 分 别 为 0.771〔95%CI(0.685,0.843)〕、0.864〔95%CI(0.790,0.920)〕,最佳截断值分别为15.23%、14.85%,灵敏度分别为79.17%、83.33%,特异度分别为89.47%、86.32%;血清IMA水平变化率联合血清sVAP-1水平变化率预测TIA患者继发ACI的AUC为0.914〔95%CI(0.825,0.943)〕,灵敏度、特异度分别为79.17%、94.74%。血清IMA水平变化率联合血清sVAP-1水平变化率预测TIA患者继发ACI的AUC大于血清IMA、sVAP-1水平变化率单独预测TIA患者继发ACI的AUC,差异有统计学意义(Z=2.001,P=0.046;Z=1.992,P=0.048),见图1。
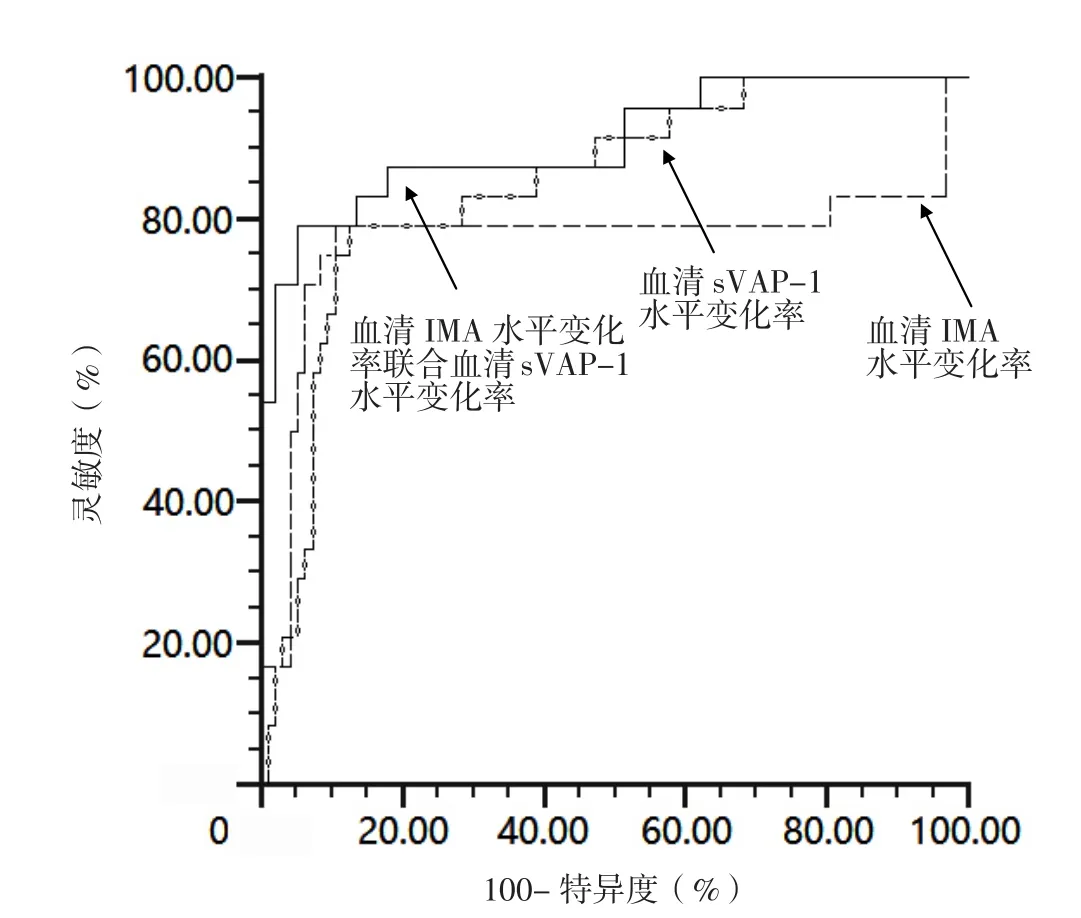
图1 血清IMA、sVAP-1水平变化率及其联合预测TIA患者继发ACI的ROC曲线Figure 1 ROC curve of change rates of serum IMA and sVAP-1 levels and the combination of the two in prediction of secondary ACI in TIA patients
3 讨论
IMA是重要的脑缺血生化标志物,有研究显示,位于血清白蛋白氨基酸序列上的铜离子等过渡重金属离子的结合位点对于生化因素破坏的抵抗能力较低,导致生化因素降解修饰的IMA水平可在短时间内升高[8]。sVAP-1是一种内皮黏附分子,可介导脱氨基产生毒性产物,通过增强炎性反应而参与内皮功能损伤。薛有平等[9]研究表明,TIA患者血清IMA、sVAP-1水平均高于健康者;本研究结果显示,观察组患者治疗前血清IMA、sVAP-1水平均高于对照组,治疗1周后血清IMA、sVAP-1水平均低于治疗前,表明TIA患者血清IMA、sVAP-1水平较高。脑缺血后机体自由基增加,增多的自由基可加重血管内皮损伤,进而造成机体sVAP-1水平升高。国内外研究发现,血清IMA水平可在机体器官缺血后快速升高,这可能与缺血后氧自由基增多导致血清白蛋白的氨基酸序列被破坏有关[10-11]。MISHRA等[12]研究发现,当机体发生心肌缺血、局部血液的供氧和灌注减少时,机体组织细胞进行无氧代谢,进而造成局部微环境内pH值降低,导致核酸与蛋白质受损,脂质过氧化,进而使IMA水平升高。高水平sVAP-1可促进机体发生动脉硬化,同时内皮中的sVAP-1也可利用自身的酶活性与淋巴细胞、粒细胞、单核细胞结合,进而参与炎性反应。樊嘉欣等[13]研究发现,ACI患者血清IMA水平过高,血清IMA水平与其脑动脉狭窄发生率呈正相关,且狭窄程度越重或狭窄支数越多,则血清IMA水平升高越明显,证实血清IMA水平过高易造成ACI的发生。本研究结果显示,TIA患者继发ACI的发生率为20.2%,低于肖章红等[14]研究显示的后循环TIA患者继发ACI的发生率为25.00%,可能是因为纳入患者的治疗状况、疾病情况等不同导致,同时也证实TIA患者继发ACI的风险较高。本研究结果还显示,观察组未继发ACI患者治疗前、治疗1周后血清IMA、sVAP-1水平低于继发ACI患者,血清IMA、sVAP-1水平变化率高于继发ACI患者,提示TIA患者血清IMA、sVAP-1水平升高可能与其继发ACI有关。
本研究多因素Cox回归分析结果显示,年龄≥65岁、合并高血压、合并糖尿病、合并高脂血症、纤维蛋白原水平、TIA发作频率、TIA发作持续时间、TIA首次发作至入院时间、TIA治疗前发作总次数、血清IMA水平变化率、血清sVAP-1水平变化率是TIA患者继发ACI的独立影响因素,提示导致TIA患者继发ACI的危险因素较多,临床医务工作者应给予充分重视,以降低ACI的发生风险。随着年龄的增长,机体血管的顺应性降低,且多数患者伴有基础疾病,机体免疫功能降低,导致TIA患者继发ACI的风险增加。长期高血压易引起小动脉中层损伤,管腔扩张,动脉内膜纤维化,小动脉玻璃样变、坏死及形成微动脉坏死,最终导致ACI的发生[15]。高血糖可促进氧化,产生氧自由基,抑制机体内皮细胞DNA的合成,损伤内皮屏障,引起血管壁损伤,进而诱导ACI的发生[15-17]。高脂血症可增加机体血液黏滞度,使血流速度减慢,易造成血小板聚集,导致血栓形成,增加ACI的发生风险。纤维蛋白原是一种凝血因子,高水平纤维蛋白原可以促进人体血栓形成,且对机体血液黏稠度产生影响,进而导致ACI的发生[18]。在临床工作中应针对上述因素加强防控,建议严格遵循二级预防策略,提倡采用有效药物、有效剂量进行维持治疗,包括阿司匹林、降压药物、调脂药物、降糖药物、中药等,并进行康复教育,同时配合积极运动、控制体质量、合理饮食、戒烟限酒、稳定情绪等措施以降低TIA患者继发ACI的风险。
本研究ROC曲线分析结果显示,血清IMA、sVAP-1水平变化率及其联合预测TIA患者继发ACI的AUC分别为0.771、0.864、0.914,提示血清IMA、sVAP-1变化率及其联合可预测TIA患者继发ACI。血清IMA水平变化率联合血清sVAP-1水平变化率预测TIA患者继发ACI的AUC大于血清IMA、sVAP-1水平变化率单独预测TIA患者继发ACI的AUC,提示血清IMA水平变化率联合血清sVAP-1水平变化率对TIA患者继发ACI有更好的预测价值。TIA患者发病后,机体能量代谢出现障碍,兴奋性神经递质释放钙离子,机体自由基过度增加,导致脑细胞死亡等缺血连锁反应,进而导致机体出现IMA水平升高情况,且升高的程度与患者缺血、再灌注损伤发生有关[19]。IMA水平升高与TIA患者机体能量代谢障碍和自由基增多有关,可导致神经元凋亡和神经组织损伤[20];而sVAP-1水平升高则是动脉粥样硬化斑块形成和破裂的重要因素,且动脉粥样硬化斑块形成和破裂是ACI发生的危险因素,因此二者可从不同角度反映TIA患者继发ACI的风险,而二者联合预测TIA患者继发ACI可减少漏诊,预测效能更为理想。
本研究虽发现血清IMA水平变化率、血清sVAP-1水平变化率均是TIA患者继发ACI的危险因素,且二者联合可预测TIA继发ACI的风险,但二者参与TIA继发ACI的具体作用机制目前尚不明确,后期应重点探讨该问题,以期探讨有针对性的TIA继发ACI的防控方案。
综上所述,TIA患者血清IMA、sVAP-1水平偏高,且继发ACI的TIA患者血清IMA、sVAP-1水平高于未继发者;年龄≥65岁、合并高血压、合并糖尿病、合并高脂血症、纤维蛋白原水平、TIA发作频率、TIA发作持续时间、TIA首次发作至入院时间、TIA治疗前发作总次数、血清IMA水平变化率、血清sVAP-1水平变化率均是TIA患者继发ACI的影响因素,且治疗前后血清IMA、sVAP-1水平变化率可联合应用于临床预测TIA患者继发ACI的风险。
作者贡献:薛莉进行文章的构思与设计、数据收集,撰写论文,进行英文的修订;薛莉、王鑫进行研究的实施与可行性分析、数据整理、统计学处理、论文的修订;薛莉、李转会进行结果的分析与解释,负责文章的质量控制及审校;李转会对文章整体负责,监督管理。
本文无利益冲突。

