绝经后宫颈高级别鳞状上皮内病变妇女术式选择的定量指标研究
王爽,徐海洋,梁华茂,王彦洁,游珂,耿力
随着宫颈病变筛查三阶梯方案的推广,越来越多的老年宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesions,HSIL)患者得到诊断。对于此类患者,按诊疗原则应行宫颈锥切术,根据锥切病理结果,对其中HSIL病变广泛、切缘未净、宫颈浸润癌者再进一步治疗,如行筋膜外全子宫切除或者广泛子宫切除。但由于该类患者绝经后宫颈及阴道有不同程度的萎缩,部分患者因宫颈萎缩严重,行宫颈锥切手术困难,只能直接采取筋膜外全子宫切除的方式。后者除手术范围大、并发症发生率较宫颈锥切更高外,尚存在术后病理结果超出宫颈癌 IA2 期,需补充放疗等特殊情况。目前对绝经期罹患 HSIL 患者的治疗,尚缺乏有效的量化指标和依据以指导术式选择,临床上多为术者根据临床经验选择术式。前期的研究显示,应用阴道镜下宫颈图像测量宫颈径线方便快捷。本研究对我院绝经后HSIL患者的宫颈萎缩情况进行定量研究,探讨此类患者术式的选择与阴道镜下宫颈量化指标的关系,以期为临床术式选择提供参考。
1 资料和方法
1.1 一般资料
回顾性分析北京大学第三医院2012年1月至2019年4月收治的50 岁及以上患有HSIL的绝经后妇女572例的临床资料。根据手术方式分为两组,因宫颈严重萎缩行锥切手术困难而直接行开腹或腹腔镜子宫全切组共57例(A组),其中我院有阴道镜检查数据者41例。515例行宫颈锥切术,其中378例患者锥切后宫颈病变降级,无需进一步治疗。宫颈锥切术后再次行子宫切除术组共137例(B组),其中我院有阴道镜检查数据者72例。记录患者术前一般资料、围手术期情况及术后病理。
1.2 病理诊断标准
根据 2012 年美国病理学会(CAP)和美国阴道镜及宫颈病理学会 (ASCCP)联合发表的下生殖道 HPV 相关的鳞状病变的标准化诊断系统,鳞状上皮内病变(squamous intraepithelial lesion,SIL)分为2级,即低级别宫颈鳞状上皮内病变(low grade squamous intraepithelial lesion,LSIL)和HSIL[1]。在我院行阴道镜检查者由固定的妇科病理医师进行诊断,在其他医院行阴道镜检查及活检者由我院妇科病理医师复核病理结果。
1.3 阴道镜下宫颈量化指标研究方法
应用北京四维赛洋阴道镜,型号 3ML LED。患者常规行阴道镜检查及活检,留取阴道镜下宫颈图像。所选宫颈图像均为7.5倍放大图片,固定一人进行图像测量。采用阴道镜成像测量软件,首先识别图像中宫颈边缘3、6、9、12点位置,以宫颈口为原点,宫颈12点边缘过原点到6点边缘的直线距离为前后径,宫颈9点边缘过原点到3点边缘的直线距离为横径。经过3、6、9、12点勾勒宫颈边缘,测量宫颈面积。每个径线和面积分别测量 3 次,取平均值,精确到 0.1 mm。
1.4 统计学分析

2 结果
2.1 两组一般资料比较
A组患者年龄和绝经年限均大于B组,差异均有统计学意义(P<0.05)。两组患者的绝经年龄、分娩次数、体质量指数(body mass index,BMI)比较,差异均无统计学意义(P>0.05)。详见下页表1。
2.2 两组患者阴道镜下宫颈量化指标比较
阴道镜下,A组患者的宫颈前后径、横径和宫颈面积值均小于B组,差异均有统计学意义(P<0.05),详见下页表2。

表1 两组患者临床资料对比
宫颈各量化指标的截断值:前后径为1.79 cm,横径为1.84 cm,面积为3.38 cm2。宫颈各量化指标的曲线下面积(area under curve,AUC)对比结果,宫颈前后径与宫颈横径间、宫颈面积与宫颈横径间AUC差异有统计学意义(Z=3.108、3.978,P=0.0019、0.0001);而宫颈前后径与宫颈面积对比,差异无统计学意义(Z=1.256,P=0.209)。以AUC最大的宫颈前后径1.79 cm作为截断值,则预测直接行全子宫切除术的敏感性为0.806,特异性为0.732,详见表3、图1。
2.3 是否经历宫颈锥切术对HSIL患者最终病理结果的影响
A组患者术后病理结果无SIL病变的比例低于B组患者;而术后病理仍存在SIL病变比例高于B组患者,两组间差异有统计学意义(P<0.05)。A组患者术后病理结果为升级癌的比例略高于B组患者,差异无统计学意义(P>0.05)。详见表4。
2.4 手术安全性及并发症
A、B两组患者全子宫切除术平均手术时间[(92.14±51.63)min vs (98.99±53.84)min]和平均出血量[(27.72±28.83)mL vs (32.55±38.41)mL]比较,差异均无统计学意义(t=24.597、11.862,P=0.415、0.394)。A组全子宫切除术有1 例患者术中盆腹腔粘连严重,发生小肠破裂,行小肠部分切除吻合术。其余患者术中、术后经过顺利,无近期并发症发生。
3 讨论
绝经后宫颈萎缩患者HSIL病变的处理仍有争议[1-2]。国际指南对于老年女性群体HSIL的诊断和治疗与育龄女性并无区别,宫颈锥切术是公认的宫颈癌癌前病变的首要治疗方式[3]。与宫颈锥切相比,直接全子宫切除术后发现为宫颈浸润癌,按照美国国立综合癌症网络指南,定义为意外发现的宫颈癌[4]的处理更为棘手。因此必须谨慎避免全子宫切除术成为绝经后或不再生育的HSIL患者的主要治疗方式。只有在有把握排除浸润型宫颈癌存在时,才可进行。而且既往有研究表明宫颈冷刀锥切术适用于绝经后患HSIL妇女,可避免漏诊和过度治疗[5]。因此对于绝经后患有HSIL的妇女也需尽量采取宫颈锥切术。但绝经后妇女宫颈、阴道有不同程度的萎缩,部分萎缩严重的患者行宫颈锥切术相对困难。但宫颈萎缩到何种状态下无法进行锥切而需选择全子宫切除,尚无指南、共识或标准以指导临床[6]。因此如何经过临床评估选择手术方式仍存在争议。本研究利用阴道镜检查时保留的宫颈图像,对宫颈径线进行测量,以期寻找宫颈量化指标,帮助临床指导此类患者手术术式的选择。

表2 两组患者阴道镜下宫颈量化指标对比
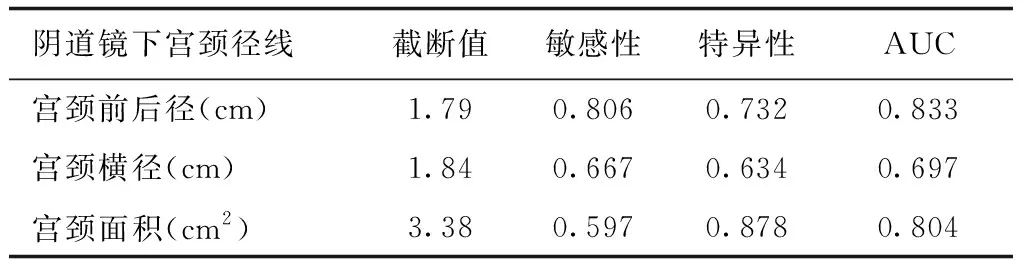
表3 阴道镜下宫颈量化指标截断值及曲线下面积

图1 阴道镜下宫颈量化指标的ROC曲线图

表4 两组患者阴道镜活检病理与子宫全切病理对比[例(%)]
本研究结果显示,对于绝经后HSIL患者,因宫颈萎缩明显直接行全子宫切除者(A组)和宫颈大小尚可以行宫颈锥切者(B组)阴道镜下宫颈前后径、横径和宫颈面积相比较差异均有统计学意义。因临床认定行宫颈锥切困难而直接行全子宫切除组患者宫颈的前后径和横径分别为1.61 cm和1.69 cm,而可行宫颈锥切者宫颈各径线更大,分别为2.13 cm和1.97 cm ;无法行宫颈锥切者的宫颈面积约为可行宫颈锥切者的65%。这可能与A组患者较B组患者年龄更大[(61.3±5.16)岁vs(58.42±5.17)岁],绝经年限更长[(11.53±5.49)年vs(9.07±5.43)年],因而宫颈萎缩更明显有关。
但用哪些指标可以更方便快捷地区分出哪些患者宫颈萎缩明显,行宫颈锥切困难,而考虑直接行全子宫切除?ROC曲线结果显示,宫颈前后径和宫颈面积均可作为区分是否需直接行全子宫切除术的量化指标,两者的截断值分别为1.79 cm和3.38 cm2。但宫颈前后径比宫颈面积具有更高的敏感性和特异性,而且比宫颈面积更易测量,因而更具有推广价值。而宫颈横径可能与患者产次、宫颈陈旧性裂伤等有关,因而变异稍大,作为参考指标效果欠佳。因此,以本研究结果为例,在实际工作中,可考虑以阴道镜下宫颈前后径1.79 cm作为截断值,小于该径线者宫颈锥切相对困难,直接行全子宫切除的可能性更大。而大于此径线者,应考虑行宫颈锥切术。
绝经后女性行宫颈锥切的困难之处在于宫颈及阴道穹窿严重萎缩,这一特点可以通过上推膀胱子宫反折腹膜,暴露更多宫颈得以部分克服。因此,并非所有宫颈萎缩患者均无法行宫颈锥切术。同时,子宫颈切除对于宫颈阴道部短缩的宫颈上皮内瘤变患者也是一种安全有效、相对微创的手术方式[10]。但部分绝经后妇女同时存在阴道萎缩,因此,阴道扩张、宫颈暴露、切除及缝合均十分困难,且易造成膀胱等临近器官损伤,因此,在无法安全暴露术野、顺利行阴式手术时,或患者存在附件病变,在充分评估患者状况及宫颈癌风险后,可选择全子宫切除术。
全子宫切除术作为行宫颈锥切困难的老年HSIL患者的主要治疗手段,在切除宫颈病变的同时,亦可减少未来子宫体及附件发生病变的概率。同时,即使已行宫颈锥切且边缘阴性,在随后所行的全子宫切除标本中可见HSIL病灶残留的概率在绝经后妇女亦比绝经前妇女要高[7]。因此,从一定程度上来说,全子宫切除对于HSIL患者有一定的应用价值。但应该了解,全子宫切除术可能不足以全部切除宫颈病变延伸至阴道的部分;而且,越过宫颈锥切直接行全子宫切除有术后宫颈病变升级为浸润癌、需术后补充治疗的风险[8-9]。对这部分高龄患者行全子宫切除亦会增加年龄相关的死亡率。因此,研究此类患者宫颈的量化指标,在指导术式选择上具有更为重要的价值。
本研究有一定的局限性。首先,这是一项单中心回顾性研究,样本量较少,有待未来扩大样本量并行多中心研究以检验此方法及诊断标准的准确性。其次,对于阴道镜下宫颈径线的测量指标尚在探索中,缺乏对阴道狭窄、宫颈展平和穹窿消失情况的量化标准,因此,需要未来不断探索新的指标以综合反映患者生殖道萎缩情况。但至少应用阴道镜下检查的同时实施宫颈径线的测量,简单、方便,可作为老年宫颈萎缩患者术式选择的一项评估方法。
综上,对于宫颈严重萎缩的HSIL患者,阴道镜下测量宫颈前后径和宫颈面积可作为术式选择的临床量化指标。本研究显示,宫颈前后径对于术式选择更有价值。阴道镜下宫颈量化指标的应用,可使术前评估更为简便且有依据,对于预测可能宫颈锥切手术困难,需行全子宫切除等进一步治疗具有一定价值。

